1. 领域背景与文献引入
文献英文标题:Biomarkers and prognostic factors of PD-1/PD-L1 inhibitor-based therapy in patients with advanced hepatocellular carcinoma;发表期刊:Biomarker Research;影响因子:未公开;研究领域:晚期肝细胞癌免疫治疗生物标志物研究。
肝细胞癌(HCC)是全球第四大致死性癌症,因起病隐匿、早期无症状,约70%患者确诊时已达晚期,传统治疗(如索拉非尼)疗效有限,5年生存率不足10%。2017年,PD-1抑制剂(如纳武利尤单抗)获批晚期HCC二线治疗,开启免疫治疗时代;随后联合治疗(如PD-1+酪氨酸激酶抑制剂[TKI]/抗血管内皮生长因子[VEGF]抗体)显著提高客观缓解率(ORR)至25%-42.5%,成为一线标准方案。然而,仅15%-40%患者对免疫治疗响应,且部分患者出现超进展或耐药,亟需精准生物标志物筛选获益人群、动态监测疗效及预测预后。
本综述针对这一临床需求,整合肿瘤微环境、基因组特征、临床表型、液体活检、肠道微生物组五大维度的最新研究,系统总结PD-1/PD-L1抑制剂治疗的生物标志物及预后因素,为晚期HCC免疫治疗的个体化决策提供依据。
2. 文献综述解析
作者以“多维度生物标志物整合”为核心逻辑,将现有研究分为五大类:肿瘤微环境(TME)、基因组特征、临床特征、液体活检、肠道微生物组,逐一梳理各领域的研究结论、优势及局限,并指出当前研究的核心问题:
1. 肿瘤微环境标志物:PD-L1表达是传统预测指标,但存在空间/时间异质性(如CheckMate 040研究中PD-L1≥1%患者ORR更高,但Avelumab研究中无差异);肿瘤浸润淋巴细胞(TILs)的密度(CD3+/CD8+ TILs高者响应好)及空间分布(非肿瘤区淋巴细胞比例高者OS更长)是潜在标志物,但检测方法未标准化。
2. 基因组特征标志物:肿瘤突变负荷(TMB)、拷贝数变异(CNAs)、驱动基因(TP53、CTNNB1)与预后相关,但TMB的cut-off值(HCC约7 Muts/Mb)未统一,驱动基因的作用需大样本验证。
3. 临床特征标志物:肿瘤负荷(大小<5cm、数量少)、肝功能(Child-Pugh A、ALBI 1级)、动态指标(AFP早期下降)是临床实用指标,但缺乏动态监测的统一标准。
4. 液体活检标志物:循环肿瘤DNA(ctDNA)、循环肿瘤细胞(CTC)具有非侵入性、动态监测优势,但仍需大样本验证其敏感性和特异性。
5. 肠道微生物组标志物:菌群多样性、特定菌属(如Lachnospiraceae)与响应相关,但代谢机制未完全阐明。
本综述的创新点在于整合了新技术(单细胞测序、空间转录组、液体活检)带来的新标志物,如单细胞测序揭示的肿瘤细胞异质性(SPP1表达预测肿瘤状态)、空间转录组发现的肿瘤免疫屏障(TIB,由SPP1+巨噬细胞与癌相关成纤维细胞[CAFs]形成),为理解免疫耐药机制提供了新视角。
3. 研究思路总结与详细解析
本综述采用“分维度系统综述”的研究框架,核心目标是整合晚期HCC免疫治疗的生物标志物,科学问题是“哪些生物标志物可有效预测PD-1/PD-L1抑制剂的响应及预后”,技术路线为“肿瘤微环境→基因组特征→临床特征→液体活检→肠道微生物组”的多维度覆盖,每个维度下细分具体标志物并结合临床研究与新技术进展。
3.1 肿瘤微环境生物标志物解析
实验目的:阐述TME中免疫细胞(PD-L1、TILs、其他免疫细胞)对免疫治疗的影响。
方法细节:结合临床研究(如CheckMate 040、KEYNOTE-224)、基础研究(小鼠模型)及新技术(单细胞测序、空间转录组)。
结果解读:
- PD-L1表达:CheckMate 040研究显示PD-L1≥1%患者ORR(20% vs 12%)更高,但Avelumab研究中无差异,异质性(空间分布、动态变化)是主要局限。
- TILs:CheckMate 040亚组分析显示,响应者CD3+/CD8+ TILs密度更高(P<0.05);空间分布研究发现,非肿瘤区淋巴细胞比例(RLTCC)高者OS更长(45.7 vs 18.6个月,P=0.006)。
- 其他免疫细胞:小鼠模型显示,刺激性树突状细胞(SDCs)、常规树突状细胞1(cDC1s)可增强抗PD-1响应;临床研究发现CD38+巨噬细胞与响应相关(Ng等,n=100,P<0.05)。
- 新技术应用:单细胞测序揭示SPP1表达预测肿瘤细胞状态(Ma等);空间转录组发现SPP1+巨噬细胞与CAFs形成TIB,导致免疫耐药(Liu等,动物模型验证靶向SPP1可破坏TIB)。
产品关联:文献未提及具体实验产品,领域常规使用PD-L1抗体(如22C3、SP263)、TILs标志物抗体(CD3、CD8)进行免疫组化检测。
3.2 基因组特征生物标志物解析
实验目的:探索基因组特征(TMB、CNAs、驱动基因)与免疫治疗预后的关系。
方法细节:基于TCGA队列、临床研究及NGS检测。
结果解读:
- TMB:小样本研究显示HCC的TMB cut-off为7 Muts/Mb,高于此值的患者响应更好,但需大样本验证(Li等,n=50,P<0.05)。
- CNAs:Bassaganyas等研究发现,高CNAs负担与免疫排斥表型相关(n=370,P<0.01)。
- 驱动基因:TP53突变患者OS更短(Long等,n=200,P<0.05);CTNNB1突变与WNT/β-catenin通路激活相关,导致免疫耐药(Ruiz de Galarreta等,小鼠模型验证)。
产品关联:文献未提及具体实验产品,领域常规使用NGS panel(如FoundationOne)检测基因组特征。
3.3 临床特征生物标志物解析
实验目的:总结临床可及的标志物(肿瘤负荷、肝功能、影像学、动态指标)。
方法细节:回顾性队列研究、前瞻性临床研究。
结果解读:
- 肿瘤负荷:肿瘤大小<5cm(Sung等,n=33,P=0.034)、肿瘤负荷评分(TBS<8,Yang等,n=378,P<0.05)患者OS更长;肺转移患者ORR最高(Lu等,n=75,P<0.05)。
- 肝功能:Child-Pugh A患者OS更长(10.7 vs 2.8个月,Choi等,n=203,P<0.01);ALBI 1级患者OS最长(22.5个月,Pinato等,n=150,P<0.001)。
- 影像学:EOB-MRI肝胆期高信号患者PFS更短(2.7 vs 5.8个月,Aoki等,n=18,P=0.007);PET/CT代谢参数(如总病灶糖酵解)与响应相关(Wang等,n=50,P<0.05)。
- 动态指标:AFP早期(4周内)下降是独立预后因素(Shao等,n=100,P<0.05);PIVKA-II下降>50%患者PFS更长(Sun等,n=50,P<0.05)。
产品关联:文献未提及具体实验产品,领域常规使用Child-Pugh评分、ALBI评分评估肝功能,EOB-MRI、PET/CT进行影像学检测。
3.4 液体活检生物标志物解析
实验目的:探索非侵入性标志物的预测价值。
方法细节:液体活检(ctDNA、CTC)、动态监测。
结果解读:
- ctDNA:治疗后ctDNA下降与PFS延长相关(Hsu等,n=50,P<0.05);cfDNA拷贝数变异(CNV)风险评分低者OS更长(Yang等,n=100,P<0.05)。
- CTC:PD-L1+ CTC患者响应更好(Winograd等,n=30,P<0.05)。
产品关联:文献未提及具体实验产品,领域常规使用数字PCR、NGS检测ctDNA,CellSearch系统检测CTC。
3.5 肠道微生物组生物标志物解析
实验目的:阐述肠道菌群与免疫治疗的关联。
方法细节:粪便样本16S rRNA测序、代谢组分析。
结果解读:
- 菌群多样性:多样性高的患者响应更好(Zheng等,n=50,P<0.05)。
- 特定菌属:Lachnospiraceae丰度高者OS更长(Lee等,n=65,P<0.05);Prevotella 9丰度高者OS更短(n=65,P<0.05)。
- 代谢物:胆汁酸(由菌群调控)与ORR相关(Lee等,n=65,P<0.05)。
产品关联:文献未提及具体实验产品,领域常规使用16S rRNA测序检测菌群组成,LC-MS检测代谢物。
4. Biomarker 研究及发现成果解析
4.1 Biomarker 定位与筛选逻辑
本综述覆盖的Biomarker分为五大类,筛选/验证逻辑如下:
- 肿瘤微环境:通过临床研究(如CheckMate 040)验证PD-L1、TILs;通过新技术(单细胞、空间转录组)发现TIB相关标志物(SPP1)。
- 基因组:基于TCGA队列验证TMB、CNAs;通过临床研究验证驱动基因(TP53、CTNNB1)。
- 临床特征:通过回顾性队列验证肿瘤负荷、肝功能;通过前瞻性研究验证动态指标(AFP、PIVKA-II)。
- 液体活检:通过动态监测验证ctDNA、CTC。
- 肠道微生物组:通过粪便测序验证菌群组成、代谢物。
4.2 研究过程与核心数据
- PD-L1表达:免疫组化检测肿瘤组织,cut-off≥1%,CheckMate 040研究显示响应者ORR更高(20% vs 12%,n=262,P<0.05);KEYNOTE-224研究显示CPS≥1更优(ORR 23% vs 12%,n=104,P<0.05)。
- TILs密度与空间分布:免疫组化检测CD3+/CD8+ TILs,CheckMate 040亚组分析显示响应者密度更高(P<0.05);Lee等研究发现非肿瘤区RLTCC高者OS更长(45.7 vs 18.6个月,n=100,P=0.006)。
- 肿瘤负荷评分(TBS):整合肿瘤大小与数量,Yang等研究显示TBS<8者OS更长(18.0 vs 10.0个月,n=378,P<0.05)。
- CRAFITY评分(AFP+CRP):血清检测,Scheiner等研究显示基线AFP≥100ng/mL、CRP≥1mg/dL是独立预后因素(HR=2.1,n=200,P<0.01)。
- ctDNA动态变化:Hsu等研究显示治疗后ctDNA下降≥50%者PFS更长(10.0 vs 4.0个月,n=50,P<0.05)。
- 肠道菌群多样性:Zheng等研究显示多样性高者ORR更高(35% vs 15%,n=50,P<0.05)。
4.3 核心成果提炼
本综述的关键发现是多维度生物标志物的整合价值:
- 传统标志物(PD-L1、TILs、Child-Pugh评分)仍是临床基础;
- 新技术标志物(TIB、ctDNA、肠道菌群)为精准治疗提供了新方向;
- 动态监测(AFP早期下降、ctDNA变化)可及时调整治疗方案。
例如,PD-L1≥1%结合TBS<8的患者,免疫治疗OS更长(Yang等,n=378,P<0.05);ctDNA动态下降结合菌群多样性高的患者,ORR可达40%(Zheng等,n=50,P<0.05)。
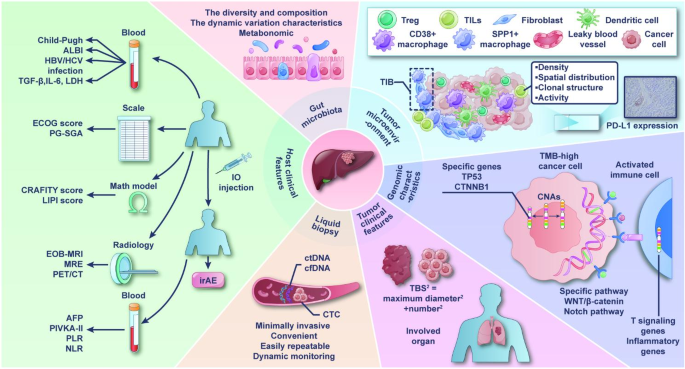
(注:图1总结了本综述的核心Biomarker,包括肿瘤微环境、基因组、临床特征、液体活检、肠道微生物组五大类,直观展示了各标志物的关联与临床价值。)
结论
本综述系统整合了晚期HCC免疫治疗的多维度生物标志物,为临床筛选获益人群、动态监测疗效及预测预后提供了全面依据。未来研究需聚焦统一标志物检测标准、验证多维度panel、探索耐药机制,推动免疫治疗向精准化迈进。
