1. 领域背景与文献引入
文献英文标题:Identification of exosomal microRNA panel as diagnostic and prognostic biomarker for small cell lung cancer;发表期刊:Biomarker Research;影响因子:未公开;研究领域:小细胞肺癌(SCLC)外泌体生物标志物研究。
小细胞肺癌是肺癌中恶性程度最高的亚型,约占肺癌的15%,其特点是增殖快、早期易发生血行转移,70%的患者确诊时已处于广泛期(ED-SCLC),5年生存率不足10%(领域共识)。目前SCLC的诊断主要依赖支气管镜或经皮肺穿刺活检,但有创操作难以早期发现微小病灶;现有血清生物标志物如神经元特异性烯醇化酶(NSE)、胃泌素释放肽前体(ProGRP)的敏感性(约60%-70%)和特异性(约70%-80%)有限,无法满足早期诊断和预后分层的需求。外泌体作为细胞分泌的纳米级囊泡,携带的microRNA(miRNA)具有组织特异性强、血液循环中稳定的特点,已成为液体活检的核心候选生物标志物。然而,SCLC相关外泌体miRNA的研究多集中在单个分子,且样本量小、缺乏大样本验证;同时,单个miRNA的诊断效能不足,联合panel的研究尚未系统开展。因此,本研究旨在通过miRNA芯片结合大样本验证,筛选SCLC患者血清外泌体中的特异性miRNA,构建高效的诊断和预后panel,为SCLC的早期诊断和预后评估提供新策略。
2. 文献综述解析
文献综述围绕“SCLC临床痛点-外泌体生物学特性-外泌体miRNA生物标志物研究现状”的逻辑展开评述。作者首先强调SCLC早期诊断困难、预后差的临床需求,指出现有生物标志物的局限性;随后介绍外泌体的核心特性:携带来源细胞的miRNA、稳定性高、可通过液体活检获取,已在乳腺癌、结直肠癌等癌症中表现出诊断价值;接着评述SCLC相关研究的不足:多聚焦单个miRNA、样本量小(<50例)、未验证预后价值,且单个miRNA的诊断特异性不足。
现有研究的局限性主要包括:1)未系统筛选SCLC特异性外泌体miRNA,缺乏全基因组水平的差异分析;2)未通过大样本验证miRNA的诊断效能;3)未探讨miRNA联合panel的预后价值。本研究的创新点在于:1)采用“芯片筛选-小样本验证-大样本确认”的系统策略,确保miRNA的特异性;2)构建miRNA联合panel,通过ROC分析评估其诊断效能;3)结合生存分析和功能实验,验证panel的预后价值及分子机制。
3. 研究思路总结与详细解析
本研究的核心目标是鉴定SCLC血清外泌体中的特异性miRNA panel,评估其诊断和预后价值;核心科学问题是“哪些外泌体miRNA可作为SCLC的诊断/预后生物标志物?联合panel是否优于单个miRNA?”;技术路线为“样本收集→外泌体分离与鉴定→miRNA芯片筛选→qRT-PCR验证→诊断/预后模型构建→功能验证”的闭环。
3.1 临床样本收集与分组
实验目的是获取SCLC患者与健康对照的血清样本,为后续外泌体分离和miRNA分析提供临床材料。方法细节:收集126例血清样本,包括28例局限期SCLC(LD-SCLC)、48例广泛期SCLC(ED-SCLC)和50例健康对照;样本分为“分析集”(5例SCLC+5例肺结节对照,用于miRNA芯片)和“测试集”(76例SCLC+50例健康对照,用于验证)。结果解读:样本基线特征符合SCLC的临床分布(广泛期占比63%),为后续研究提供了可靠的临床队列。实验所用关键产品:文献未提及具体样本收集产品,领域常规使用BD Vacutainer血清分离管。
3.2 外泌体分离与鉴定
实验目的是从血清中分离外泌体并验证其形态、粒径和标志蛋白。方法细节:采用超高速离心法(100,000×g,70分钟)分离外泌体;通过透射电子显微镜(TEM)观察形态,纳米颗粒追踪分析(NTA)检测粒径分布,Western blot检测外泌体标志蛋白(TSG101、HSP90、CD63、CD81)。结果解读:TEM显示外泌体呈典型的“杯状”结构(图1A);NTA结果显示外泌体粒径集中在100-120 nm(图1B-D);Western blot检测到TSG101、CD63、CD81等标志蛋白的表达(图1F),证实分离的囊泡为外泌体。实验所用关键产品:透射电子显微镜(Hitachi H7600)、纳米颗粒追踪分析仪(Malvern NanoSight NS300)、抗体(TSG101:ab125011,Abcam;CD63:sc-5275,Santa Cruz)。
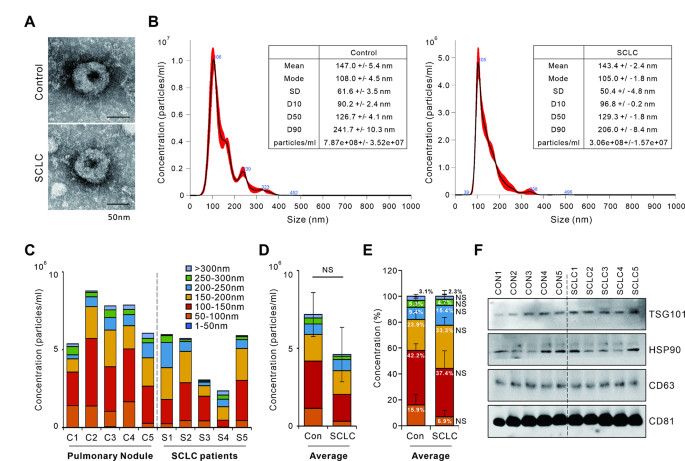
3.3 miRNA芯片筛选与候选miRNA选择
实验目的是筛选SCLC与对照之间的差异外泌体miRNA。方法细节:从“分析集”样本中提取外泌体RNA,采用Affymetrix GeneChip® miRNA 4.0 Array进行miRNA表达谱分析;通过主成分分析(PCA)、火山图(FC>|2.0|,p<0.05)和热图筛选差异miRNA,结合Top10差异基因选择候选miRNA。结果解读:PCA显示SCLC组与对照组的miRNA表达模式明显区分(图2A);火山图和热图共筛选出31个差异miRNA(19个上调,12个下调)(图2D-E);结合Top10差异基因,最终选择51个候选miRNA。实验所用关键产品:miRNA芯片(Affymetrix GeneChip® miRNA 4.0 Array)、RNA提取试剂盒(Qiagen miRNeasy mini kit)。
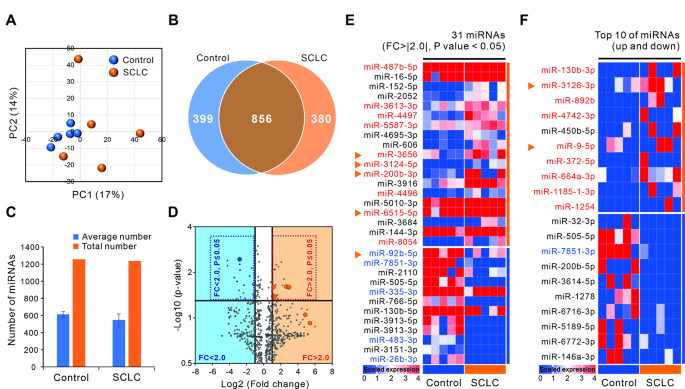
3.4 大样本qRT-PCR验证差异miRNA
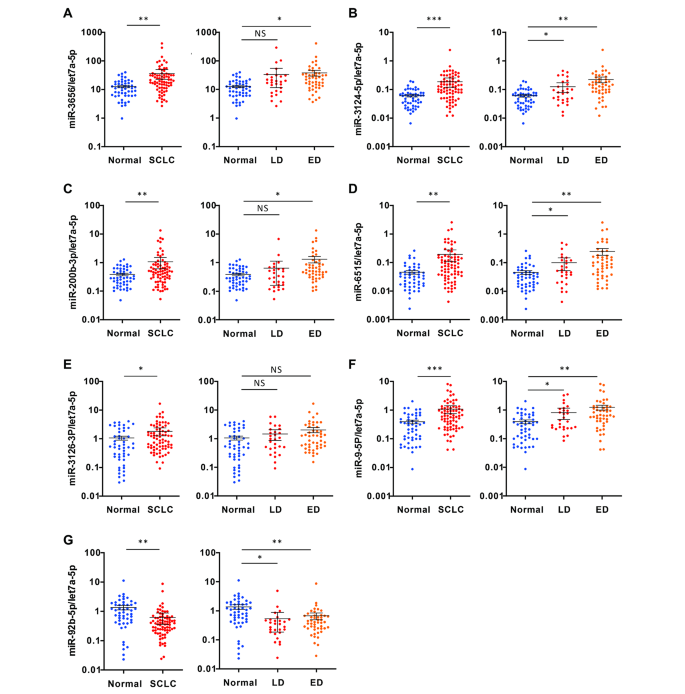
实验目的是验证候选miRNA在大样本中的差异表达。方法细节:从“测试集”样本中提取外泌体RNA,采用qRT-PCR检测25个候选miRNA的表达(以let-7a-5p为内参,样本量n=126)。结果解读:7个miRNA显示显著差异,其中6个(miR-3565、miR-3124-5p、miR-200b-3p、miR-6515、miR-3126-3p、miR-9-5p)上调,1个(miR-92b-5p)下调(图3A-G)。实验所用关键产品:qRT-PCR试剂盒(Applied Biosystems SYBR Green Master Mix)、miRNA引物(miR-3124-5p mimic:MC17992,Applied Biosystems)。
3.5 诊断模型构建与评估
实验目的是构建SCLC诊断的miRNA联合panel并评估其效能。方法细节:采用逻辑回归分析筛选最优miRNA组合,通过ROC曲线计算AUC值评估诊断效能(样本分为训练集n=94、验证集n=32)。结果解读:3个miRNA(miR-200b-3p、miR-3124-5p、miR-92b-5p)的联合panel诊断效能最优,AUC=0.93(p<0.0001),显著高于单个miRNA(如miR-200b-3p的AUC=0.64)(图4A-I);该panel对局限期SCLC的AUC=0.85(p<0.001),广泛期AUC=0.92(p<0.001),显示良好的早期诊断潜力。实验所用关键产品:统计软件R(tidymodels包)。
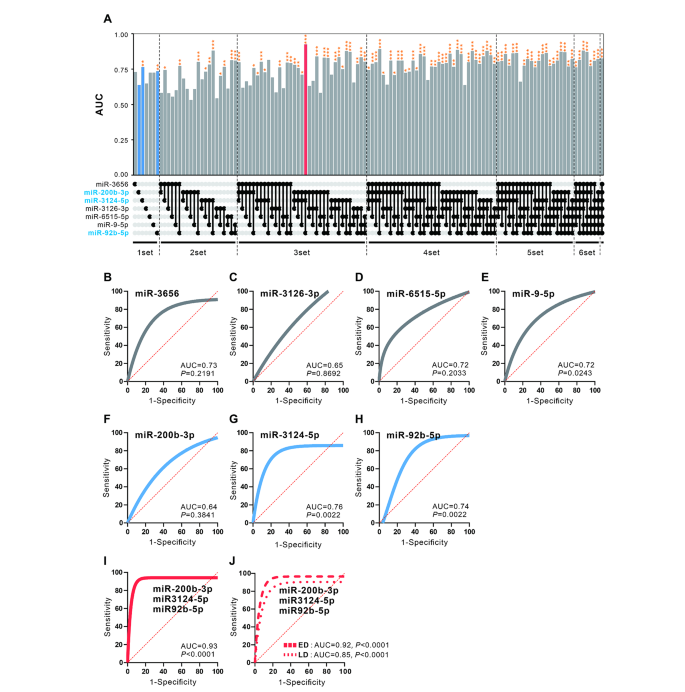
3.6 预后模型构建与功能分析
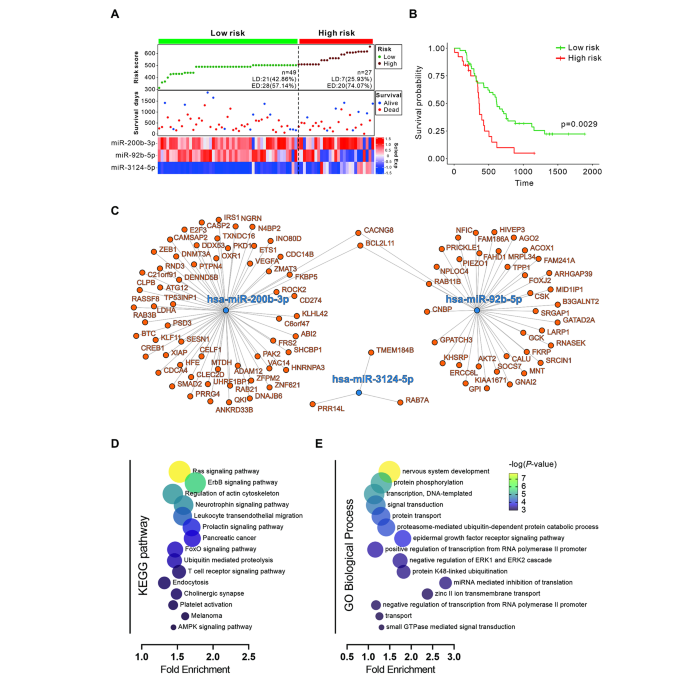
实验目的是评估miRNA panel的预后价值并探索其分子机制。方法细节:通过Cox比例风险模型计算患者风险评分(以3个miRNA的表达水平为变量),将患者分为高风险(n=27)和低风险组(n=49),采用Kaplan-Meier法分析生存差异;通过TargetScan、miRDB、miRWalk预测miRNA靶基因,进行KEGG和GO富集分析。结果解读:高风险组患者的总生存期显著短于低风险组(图5B);靶基因富集分析显示,panel中的miRNA与Ras、ErbB、神经生长因子信号通路及神经系统发育相关(图5D-E)。实验所用关键产品:生物信息学工具(TargetScan8.0、DAVID)。
3.7 细胞功能验证
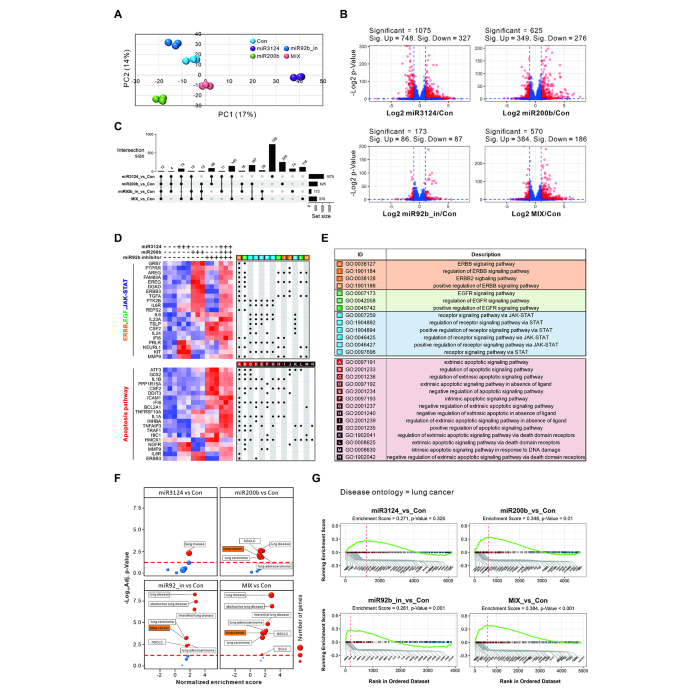
实验目的是验证miRNA panel对正常肺细胞基因表达的影响。方法细节:将miR-3124-5p mimic、miR-200b-3p mimic、miR-92b inhibitor及三者混合物转染BEAS2B细胞(正常支气管上皮细胞),48小时后提取RNA进行mRNA测序;分析差异表达基因(DEGs)及与致癌通路(ERBB、EGF、JAK-STAT、凋亡)的关联。结果解读:转染3个miRNA混合物的细胞中,致癌通路相关基因(如EGFR、ERBB2)的表达显著上调(图6D);疾病本体(DO)分析显示,差异基因主要与肺部疾病相关,其中肺cancer相关通路显著富集(图6F-G)。实验所用关键产品:细胞系(BEAS2B)、转染试剂(Lipofectamine 2000,Invitrogen)、mRNA测序试剂盒(NEBNext Ultra II Directional RNA-Seq Kit)。
4. Biomarker 研究及发现成果解析
Biomarker定位与筛选逻辑
本研究的Biomarker是血清外泌体中的7个差异miRNA(miR-3565、miR-3124-5p、miR-200b-3p、miR-6515、miR-3126-3p、miR-9-5p、miR-92b-5p),其中3个(miR-200b-3p、miR-3124-5p、miR-92b-5p)组成诊断和预后panel。筛选与验证逻辑为:miRNA芯片筛选(分析集n=10)→qRT-PCR验证(分析集n=10)→大样本qRT-PCR确认(测试集n=126)→联合panel构建(ROC分析)→预后验证(生存分析n=76)。
研究过程详述
Biomarker来源:SCLC患者(n=76)和健康对照(n=50)的血清外泌体;验证方法:1)miRNA芯片(筛选差异miRNA);2)qRT-PCR(验证表达水平,样本量n=126);3)ROC分析(评估诊断效能,AUC=0.93,p<0.0001);4)Cox回归(评估预后价值,高风险组生存时间更短)。特异性与敏感性:3个miRNA panel的AUC=0.93(95% CI文献未明确),对局限期SCLC的AUC=0.85(p<0.001),广泛期AUC=0.92(p<0.001);文献未明确报道敏感性和特异性,但ROC曲线显示其诊断效能显著优于单个miRNA。
核心成果提炼
- 诊断价值:3个miRNA panel(miR-200b-3p、miR-3124-5p、miR-92b-5p)对SCLC的诊断AUC=0.93,显著优于单个miRNA(如miR-200b-3p的AUC=0.64),且对局限期SCLC有良好的早期诊断潜力(AUC=0.85)。
- 预后价值:基于panel的风险评分将患者分为高风险组(n=27)和低风险组(n=49),高风险组的总生存期显著短于低风险组(log-rank test,p<0.05)。
- 功能关联:panel中的miRNA靶基因富集于Ras、ErbB等致癌通路,转染后正常肺细胞的致癌通路基因表达上调,提示这些miRNA可能通过调控致癌通路参与SCLC的发生发展。
- 创新性:首次通过大样本验证构建了SCLC血清外泌体miRNA诊断和预后panel,为SCLC的液体活检提供了新的生物标志物组合,解决了现有生物标志物特异性不足的问题。
本研究的局限性在于未探讨miRNA panel与临床治疗响应的关联(如化疗或免疫治疗),未来需进一步验证其在治疗监测中的价值;同时,功能实验仅在细胞水平开展,需动物实验验证miRNA的致癌作用。但总体而言,本研究为SCLC的早期诊断和预后评估提供了重要的生物标志物资源,具有潜在的临床转化价值。
