1. 领域背景与文献引入
文献英文标题:Lipid metabolism in tumor-infiltrating regulatory T cells: perspective to precision immunotherapy;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤免疫治疗中调节性T细胞(Tregs)的脂质代谢机制研究。
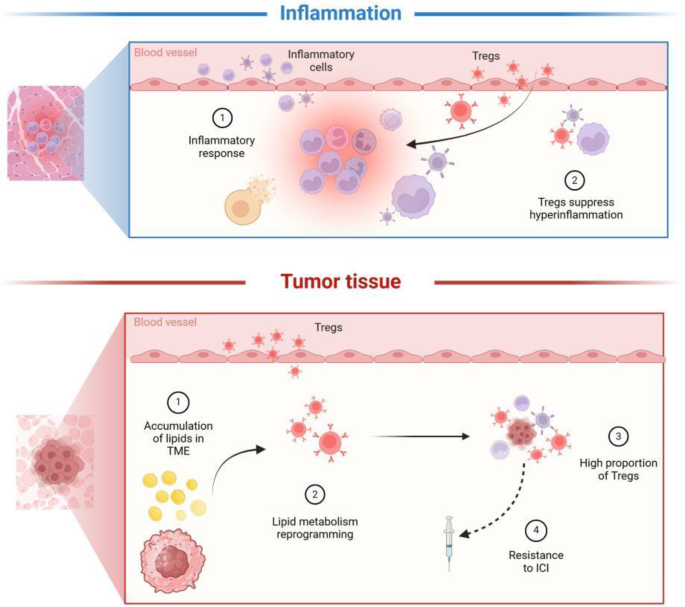
肿瘤免疫治疗(如免疫检查点抑制剂、过继细胞疗法)的问世显著改善了晚期癌症患者的预后,但仅约20%-30%的患者能长期获益,肿瘤浸润调节性T细胞(TI-Tregs)的异常积累是主要障碍之一。TI-Tregs通过高表达CTLA-4、PD-1等免疫检查点分子,分泌IL-10、TGF-β等抑制性细胞因子,以及消耗TME中的IL-2,抑制效应T细胞(Teffs)的活化与增殖,最终导致肿瘤免疫逃逸和治疗耐药。然而,系统性清除Tregs(如抗CD25抗体)会引发严重的自身免疫病(如结肠炎、心肌炎),限制了其临床应用。
近年,免疫代谢学的兴起为解决这一矛盾提供了新方向:免疫细胞的功能状态与其代谢重编程密切相关,而TME的代谢紊乱(如葡萄糖匮乏、脂质积累、乳酸堆积)是调控免疫细胞功能的关键因素。研究发现,TI-Tregs与Teffs相比,具有独特的代谢偏好——更依赖脂质β氧化(FAO)而非糖酵解获取能量,这种代谢模式使其在葡萄糖匮乏的TME中存活并维持抑制功能。此外,TME中普遍存在的脂质积累(如游离脂肪酸、胆固醇、鞘磷脂)不仅为TI-Tregs提供了丰富的代谢底物,还通过激活PPAR-γ、mTOR等通路增强其免疫抑制能力。但目前对于“TI-Tregs如何通过脂质代谢重编程获得代谢优势”“脂质信号如何调控其免疫抑制功能”及“如何靶向这些代谢通路实现精准治疗”等关键问题,仍缺乏系统的总结与机制解析。
本综述围绕“TI-Tregs的脂质代谢特征”“TME脂质微环境的调控作用”“关键代谢调控分子”及“靶向脂质代谢的治疗策略”展开,旨在阐明脂质代谢在TI-Tregs介导免疫抑制中的核心作用,为开发“特异性抑制TI-Tregs、保留外周Tregs功能”的精准免疫治疗方案提供理论依据。
2. 文献综述解析
本综述的核心评述逻辑为“基础代谢特征→TME微环境调控→分子机制→治疗应用”,层层递进解析脂质代谢与TI-Tregs免疫抑制的关联。现有研究的关键结论与局限性如下:
现有研究的核心发现
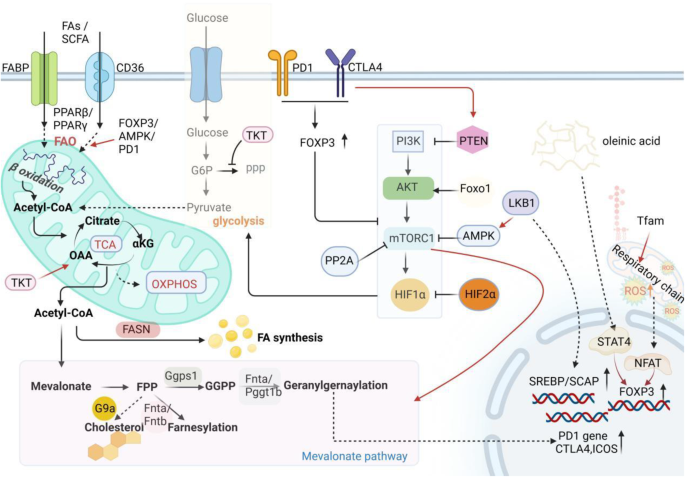
- Tregs的脂质代谢偏好:静息Tregs以糖酵解为主,但激活后的效应Tregs(eTregs)及TI-Tregs会快速转换为FAO依赖的代谢模式。这种转换依赖线粒体功能——线粒体复合物III、线粒体转录因子A(TFAM)通过维持线粒体DNA稳定性,保障FAO关键酶(如肉碱棕榈酰转移酶1a,CPT1a)的表达,进而维持Tregs核心转录因子Foxp3的稳定性。
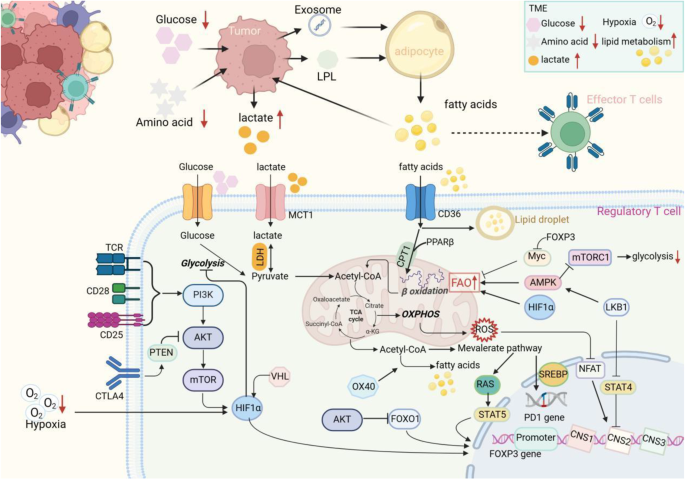
- TME脂质积累与TI-Tregs的相互作用:肿瘤细胞通过PI3K-AKT-mTOR通路增强糖酵解,将代谢产物转化为游离脂肪酸(FFAs)并分泌至TME;肿瘤相关脂肪细胞(TAAs)则通过脂解作用释放FFAs,导致TME中脂质浓度显著升高。TI-Tregs通过高表达CD36(长链脂肪酸转运蛋白)摄取这些脂质,激活PPAR-γ通路促进FAO,从而在葡萄糖匮乏的TME中存活并增殖。
- 代谢调控的分子机制:PPAR-γ、mTOR、AMPK等通路是调控TI-Tregs脂质代谢的核心。PPAR-γ通过促进CD36的表达和FAO相关基因(如ACADL)的转录,增强脂质摄取与代谢;mTORC1通路激活会促进糖酵解、抑制FAO,而PTEN、AMPK等分子通过抑制mTORC1,推动TI-Tregs向脂质代谢转换;Foxp3作为Tregs的“身份分子”,直接抑制糖酵解相关基因(如Glut1)的表达,同时促进FAO基因(如CPT1a)的转录,使TI-Tregs适应TME的代谢压力。
现有研究的局限性与本综述的创新
现有研究虽证实了脂质代谢对TI-Tregs的重要性,但仍存在不足:(1)多数机制研究基于小鼠模型,人类TI-Tregs的脂质代谢特征需进一步验证;(2)脂质代谢与其他代谢通路(如氨基酸代谢、核苷酸代谢)的交互作用尚不明确;(3)缺乏针对脂质代谢靶点的临床转化研究。本综述的创新在于首次系统整合了TI-Tregs的脂质代谢机制与靶向策略,填补了“代谢重编程如何驱动免疫抑制”的细节空白,为精准免疫治疗提供了更明确的靶点方向。
3. 研究思路总结与详细解析
本研究为综述性文章,无独立实验设计,而是通过系统检索2012-2024年Pubmed、Web of Science数据库中“Tregs脂质代谢”“肿瘤浸润Tregs”“TME脂质微环境”相关研究,按以下逻辑组织内容:
3.1 调节性T细胞的脂质代谢特征
静息Tregs(Fr. I)主要依赖糖酵解维持存活,但激活后的效应Tregs(eTregs)及TI-Tregs会快速转换为FAO依赖的代谢模式。这种转换的核心驱动因素是线粒体功能的增强:线粒体复合物III通过维持线粒体DNA稳定性,保障FAO关键酶(如CPT1a)的表达;线粒体转录因子A(TFAM)则通过促进线粒体DNA复制,增强线粒体呼吸链的活性。此外,PPAR-γ作为脂质代谢的核心调控因子,通过结合FAO相关基因的启动子区,促进CD36(脂质转运)、ACADL(长链酰基辅酶A脱氢酶)等基因的转录,最终增强Tregs的脂质代谢能力。例如,PPAR-γ激动剂吡格列酮可上调肥胖小鼠 adipose组织Tregs的数量,缓解炎症反应(现有研究证据)。
3.2 TME脂质积累对肿瘤浸润Tregs的调控
TME中的脂质积累是TI-Tregs代谢适应的关键驱动因素。肿瘤细胞通过PI3K-AKT-mTOR通路增强糖酵解,将葡萄糖转化为丙酮酸后,进一步通过脂肪酸合成酶(FAS)合成游离脂肪酸(FFAs)并分泌至TME;肿瘤相关脂肪细胞(TAAs)则通过脂解作用(激活HSL、ATGL等脂解酶)释放FFAs,使TME中FFAs浓度较正常组织高2-3倍。
TI-Tregs通过高表达CD36(膜表面脂质转运蛋白)摄取这些FFAs,随后激活PPAR-β通路促进FAO:FFAs与PPAR-β结合后,转入细胞核并结合FAO相关基因(如CPT1a、ACADM)的启动子区,促进其转录。这种代谢模式使TI-Tregs在葡萄糖匮乏的TME中存活,而Teffs因依赖糖酵解无法适应,最终导致TI-Tregs占据代谢优势。此外,TME中的胆固醇积累通过抑制mTORC1通路,促进Tregs的分化——胆固醇与mTORC1的调控因子Rheb结合,抑制mTORC1的活性,进而减少糖酵解、增强FAO(现有研究证据)。
3.3 关键代谢调控分子的作用
综述总结了调控TI-Tregs脂质代谢的四大核心分子:
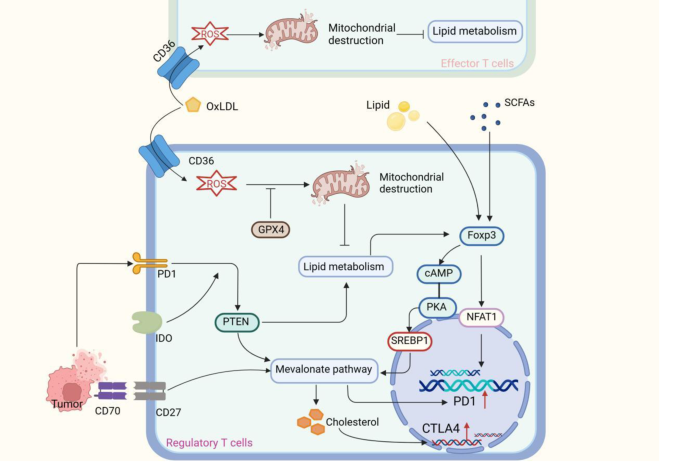
- CD36:介导长链脂肪酸的摄取,其表达受PPAR-γ调控。敲除CD36可显著减少TI-Tregs的脂质摄取,降低FAO活性,最终削弱其抑制功能(现有研究证据)。
- PPAR-γ:脂质代谢的核心转录因子,通过促进CD36、ACADL等基因的表达,增强脂质摄取与FAO。PPAR-γ抑制剂(如GW9662)可抑制TI-Tregs的代谢适应,同时不影响外周Tregs的功能(现有研究证据)。
- mTORC1:抑制FAO的关键通路。mTORC1激活会促进糖酵解相关基因(如Glut1、HK2)的表达,抑制FAO相关基因(如CPT1a)的转录。PTEN、AMPK等分子通过抑制mTORC1,推动TI-Tregs向FAO转换(现有研究证据)。
- Foxp3:Tregs的“身份分子”,通过直接抑制糖酵解基因(如Glut1)的表达,同时促进FAO基因(如CPT1a)的转录,使TI-Tregs适应TME的代谢压力。Foxp3缺陷的Tregs无法维持FAO,最终失去抑制功能(现有研究证据)。
3.4 靶向脂质代谢的治疗策略
综述提出四大靶向脂质代谢的治疗方向,均在小鼠模型中显示出抗肿瘤活性:
- 抑制脂质摄取:CD36阻断剂(如SSO)可减少TI-Tregs的脂质摄取,降低FAO活性,增强Teffs的抗肿瘤功能(现有研究证据)。
- 调控脂质代谢通路:PPAR-γ抑制剂(如GW9662)可抑制TI-Tregs的脂质代谢,同时不影响外周Tregs的功能(现有研究证据)。
- 靶向线粒体功能:线粒体复合物III抑制剂(如抗霉素A)可破坏TI-Tregs的FAO,削弱其抑制功能(现有研究证据)。
- 联合免疫治疗:CD36阻断剂与抗PD-1抗体联合使用,可显著增强Teffs的浸润与活化,同时减少TI-Tregs的数量,在小鼠黑色素瘤模型中使肿瘤生长抑制率从30%提升至70%(现有研究证据)。
4. Biomarker研究及发现成果解析
本综述未报道新的Biomarker,而是总结了现有研究中与TI-Tregs脂质代谢相关的潜在Biomarker,其类型、筛选逻辑及临床意义如下:
4.1 潜在Biomarker的类型与筛选逻辑
潜在Biomarker主要分为三类:
1. 脂质代谢相关分子:CD36(膜蛋白,介导脂质摄取)、PPAR-γ(转录因子,调控脂质代谢)、CPT1a(FAO关键酶)——这些分子在TI-Tregs中的表达显著高于外周血Tregs(CD36表达量高2-3倍,PPAR-γ高1.5-2倍),且其表达水平与患者预后负相关(现有研究证据)。
2. 代谢通路调控分子:mTORC1(抑制FAO)、AMPK(促进FAO)——mTORC1活性在TI-Tregs中显著低于Teffs,而AMPK活性显著高于Teffs,其活性变化可反映TI-Tregs的代谢偏好(现有研究证据)。
3. TME脂质底物:游离脂肪酸(如棕榈酸、油酸)、胆固醇——TME中游离脂肪酸浓度≥0.5mmol/L或胆固醇浓度≥5mmol/L时,TI-Tregs的数量显著增加(现有研究证据)。
筛选逻辑主要基于“肿瘤组织vs正常组织的表达差异”和“代谢通路抑制后的功能变化”:例如,CD36在TI-Tregs中的表达显著高于正常组织Tregs,且敲除CD36后TI-Tregs的抑制功能显著削弱,因此被认为是潜在Biomarker。
4.2 核心成果与临床意义
这些潜在Biomarker的核心价值在于:
- 预测治疗响应:高CD36表达的患者对免疫检查点抑制剂(如抗PD-1抗体)的响应率显著低于低表达患者(15% vs 40%,现有研究证据),可作为预测生物标志物。
- 靶向治疗靶点:CD36、PPAR-γ等Biomarker可作为治疗靶点——CD36阻断剂(如SSO)可特异性抑制TI-Tregs的脂质摄取,增强Teffs的抗肿瘤活性,且无明显自身免疫副作用(现有研究证据)。
- 监测治疗效果:治疗后TME中游离脂肪酸浓度降低或CD36表达减少,提示治疗有效(现有研究证据)。
4.3 局限性与展望
目前这些Biomarker的临床验证仍不足:(1)缺乏大样本临床研究确认其特异性和敏感性;(2)未明确Biomarker的临界值(如CD36的最佳 cutoff值);(3)脂质代谢与其他代谢通路的交互作用(如氨基酸代谢)需进一步解析。未来需开展前瞻性临床研究,验证这些Biomarker的临床价值,同时探索“多Biomarker组合”的预测模型,提高精准治疗的效率。
图片说明