1. 领域背景与文献引入
文献英文标题:Inducible transgene expression in PDX models in vivo identifies KLF4 as a therapeutic target for B-ALL;发表期刊:Biomarker Research;影响因子:4.5(2020年);研究领域:B细胞急性淋巴细胞白血病(B-ALL)治疗靶点功能验证。
B-ALL是儿童最常见的恶性血液肿瘤,初诊患者经常规化疗或CAR-T细胞治疗预后较好,但复发患者的5年生存率不足30%,亟需寻找新的治疗靶点。当前肿瘤研究中,通过RNA测序或蛋白质组学易发现肿瘤细胞的mRNA和蛋白改变,但多数改变的功能尚不明确,难以直接转化为治疗靶点。患者来源异种移植模型(PDX)因能保留原发肿瘤的遗传和表型特征,是更接近临床的预实验模型,但传统PDX模型缺乏可诱导转基因表达系统,无法研究基因在肿瘤维持(如复发或最小残留病,MRD)中的功能。Krüppel样因子4(KLF4)是一种转录因子,参与细胞周期、凋亡和分化调控,在肿瘤中具有抑癌或促癌的双重作用;研究发现KLF4在B-ALL中显著下调,但在复发或MRD阶段的功能尚未明确。
针对“缺乏临床相关模型验证B-ALL潜在靶点功能”的问题,本研究建立了PDX模型的可诱导转基因表达系统,验证KLF4作为B-ALL治疗靶点的作用,并探索其与临床药物的关联,为复发B-ALL的个性化治疗提供依据。
2. 文献综述解析
文献综述的核心评述逻辑:作者先指出“肿瘤分子改变的功能验证缺乏临床相关方法”,再强调“PDX模型是理想预实验模型但缺乏可诱导系统”,最后总结“KLF4在B-ALL中下调但功能不清”的现状。
现有研究的关键结论:① 肿瘤细胞的分子改变需通过临床相关模型验证功能,否则难以转化为治疗靶点;② PDX模型比细胞系更接近临床,但传统PDX无法实现“肿瘤建立后诱导基因表达”;③ KLF4在B-ALL中下调,可能通过抑制细胞周期发挥抑癌作用,但需体内功能验证。现有研究的局限性:① 缺乏PDX模型的可诱导表达系统,无法研究基因在肿瘤维持或MRD阶段的功能;② 未明确KLF4在B-ALL复发中的作用;③ 未探索上调KLF4的临床药物及机制。
本研究的创新价值:① 建立了B-ALL PDX模型的“四环素诱导(tet-on)”转基因系统,首次实现“肿瘤建立后可诱导基因表达”,解决了传统PDX的功能研究局限;② 验证了KLF4在B-ALL肿瘤维持、MRD阶段及化疗敏感性中的抑癌作用;③ 发现临床药物阿扎胞苷可上调KLF4,且其抗B-ALL作用依赖KLF4,为临床转化提供直接依据。
3. 研究思路总结与详细解析
整体框架:研究目标是“建立PDX可诱导系统,验证KLF4作为B-ALL治疗靶点的作用”;核心科学问题是“KLF4在B-ALL维持中的功能及机制,以及阿扎胞苷是否通过KLF4发挥作用”;技术路线为“体外EBV模型验证KLF4抑癌作用→构建PDX可诱导系统→体内验证KLF4对肿瘤生长、MRD及化疗的影响→CRISPR-KO验证阿扎胞苷的KLF4依赖性”。
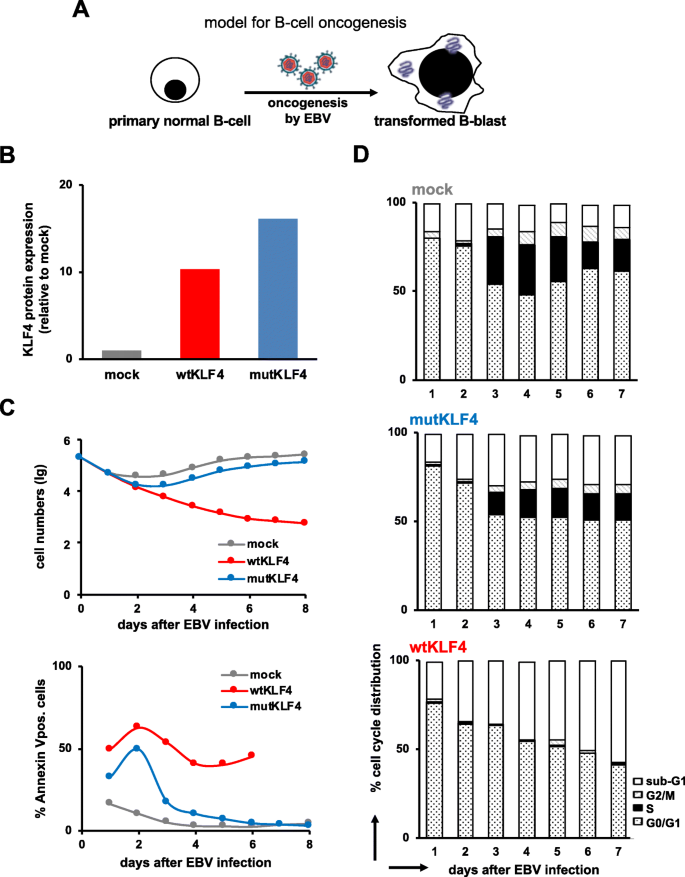
3.1 EBV诱导B细胞转化模型的建立与KLF4功能验证
实验目的:体外验证KLF4对“EBV诱导正常B细胞转化为恶性B-母细胞”的抑制作用。
方法细节:用野生型EBV(mock)、携带野生型KLF4(wtKLF4)或缺失DNA结合域的突变体KLF4(mutKLF4)的重组EBV,感染原代naive B细胞;通过毛细管免疫分析检测KLF4蛋白表达,流式细胞术检测细胞数目和Annexin V阳性凋亡细胞比例,溴脱氧尿苷(BrdU)掺入法分析细胞周期。
结果解读:wtKLF4组KLF4蛋白表达较mock组显著升高(毛细管免疫分析显示折叠变化增加),细胞增殖减少、凋亡比例增加,S期细胞比例降低;mutKLF4组无显著变化(图1)。
实验所用关键产品:毛细管免疫分析系统为ProteinSimple的WES,KLF4抗体为R&D systems的AF3640,β-Actin抗体为Novus biologicals的NB600-501SS,BCA蛋白定量试剂盒为New England Biolabs的7780,Western blot用Cell Signaling Technology的Caspase3(#9662)和PARP(#9542)抗体。
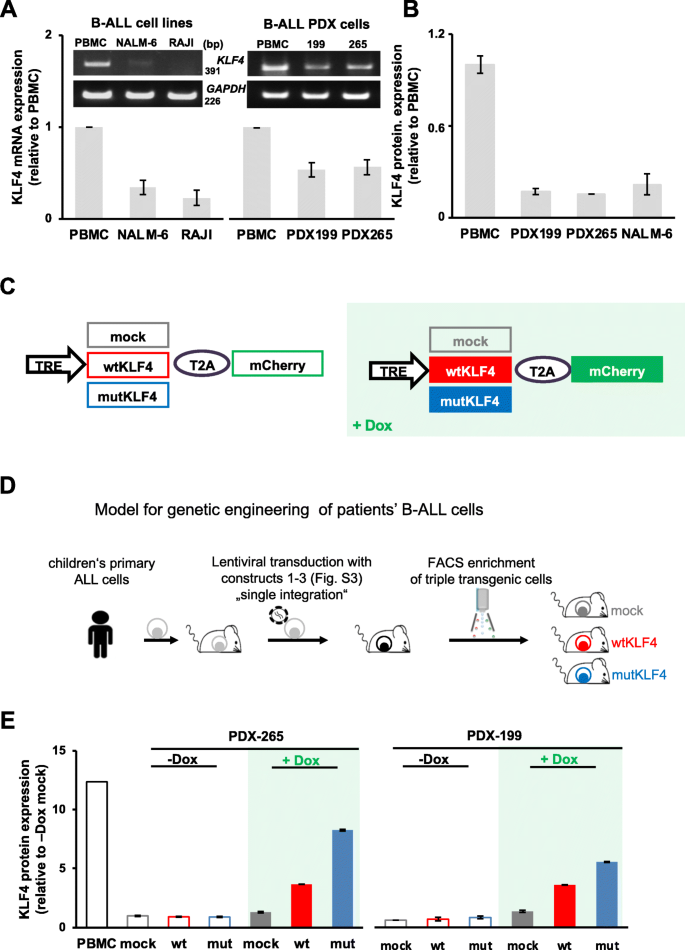
3.2 B-ALL PDX模型的可诱导转基因系统构建
实验目的:构建PDX模型的tet-on系统,实现KLF4的可诱导表达。
方法细节:将B-ALL PDX细胞(来自2例复发儿童患者)依次用3种慢病毒载体转导:① 表达rtTA3(四环素激活剂)和荧光素酶的载体(标记mTaqBFP);② 表达tetR(四环素阻遏剂)的载体(标记iRFP720或T-Sapphire);③ 表达mock、wtKLF4或mutKLF4的载体(受TRE启动子调控,标记mCherry)。转导后通过流式细胞术富集三转基因细胞,体外(DOX处理)和体内(DOX喂养小鼠)验证KLF4表达。
结果解读:体外DOX处理48小时后,wtKLF4组KLF4蛋白表达较mock组升高(折叠变化增加),且表达水平不超过健康人PBMC;体内DOX喂养后,mCherry阳性细胞比例增加,表明KLF4成功诱导表达(图2)。
实验所用关键产品:慢病毒载体构建用常规试剂,荧光蛋白标记包括mTaqBFP、iRFP720、T-Sapphire、mCherry。
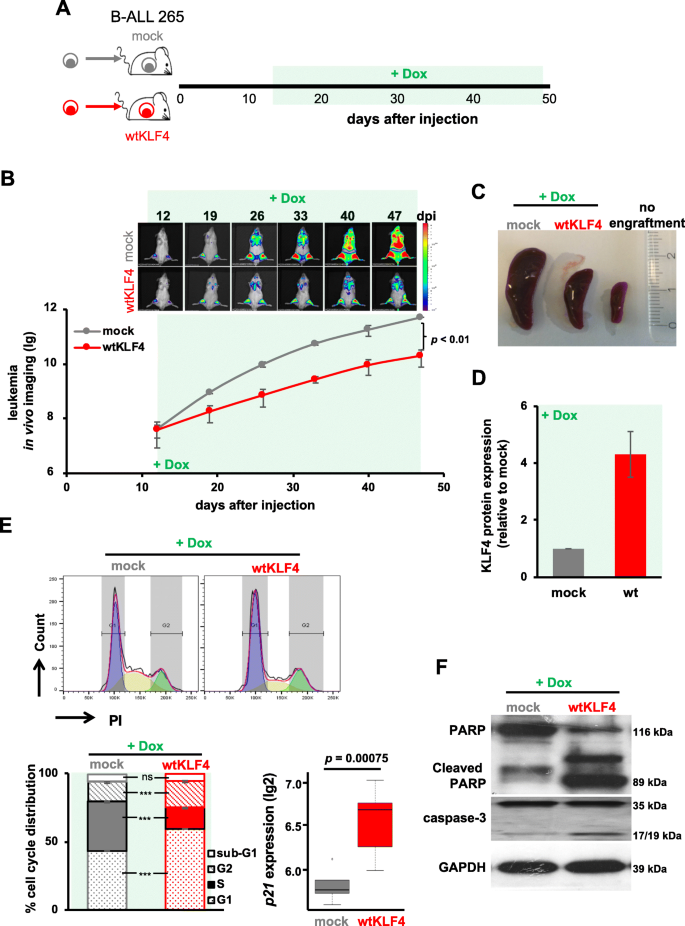
3.3 体内验证KLF4对B-ALL PDX生长的影响
实验目的:检测KLF4在体内对B-ALL PDX肿瘤生长的抑制作用。
方法细节:将mock或wtKLF4的PDX细胞(ALL-265)注射到NSG小鼠尾静脉,12天后用DOX诱导KLF4表达;通过生物发光成像监测肿瘤负荷,47天后取脾脏富集mCherry阳性细胞,检测KLF4表达、细胞周期和凋亡标志物。
结果解读:wtKLF4组的生物发光信号显著低于mock组(p<0.01,n=6),脾肿大减轻;mCherry阳性细胞中KLF4表达升高,S期细胞比例减少(p<0.005,n=3),p21 mRNA上调,PARP和Caspase3切割增加(图3)。
实验所用关键产品:生物发光成像系统为常规设备,流式细胞术用mCherry抗体,Western blot用Cell Signaling的PARP和Caspase3抗体。
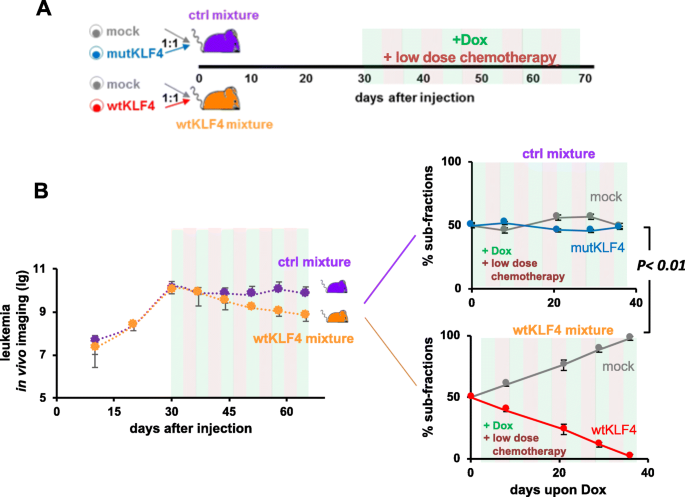
3.4 竞争实验验证KLF4的生长抑制作用
实验目的:通过同体竞争实验减少个体差异,验证KLF4的生长抑制作用。
方法细节:将mock+wtKLF4或mock+mutKLF4的PDX细胞按1:1混合,注射到NSG小鼠,DOX诱导后通过生物发光成像监测肿瘤负荷,每周处死小鼠检测细胞比例。
结果解读:mock+wtKLF4组的肿瘤负荷显著低于mock+mutKLF4组(p<0.01,n=10);wtKLF4细胞比例随时间显著降低,而mutKLF4组比例无变化(图4a、b)。
实验所用关键产品:荧光标记用T-Sapphire(mock)和iRFP720(wtKLF4/mutKLF4),流式细胞术检测比例。
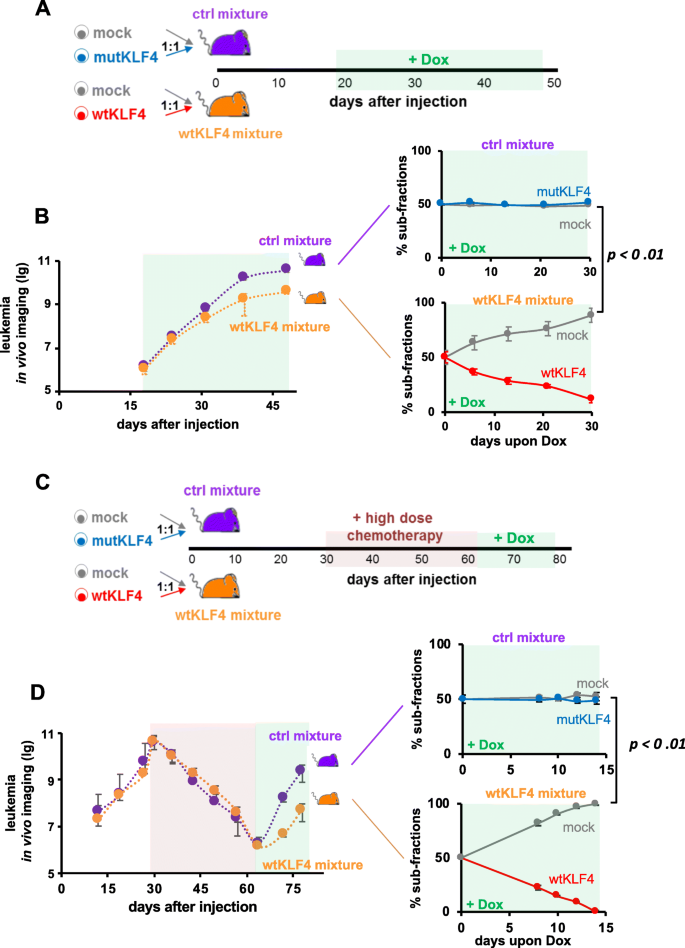
3.5 MRD阶段KLF4的作用验证
实验目的:检测KLF4在MRD阶段对肿瘤复发的抑制作用。
方法细节:用长春新碱(0.25 mg/kg)和环磷酰胺(100 mg/kg)诱导PDX小鼠产生MRD(骨髓白血病细胞<1%),停止化疗后DOX诱导KLF4表达,监测肿瘤复发。
结果解读:MRD阶段诱导KLF4后,肿瘤复发显著延迟;wtKLF4细胞比例在2周内降至不可检测水平,抑制效果较治疗前更显著(图4c、d)。
实验所用关键产品:化疗药物为长春新碱和环磷酰胺,生物发光成像跟踪复发。
3.6 KLF4对化疗敏感性的影响
实验目的:验证KLF4是否增强B-ALL细胞对化疗的敏感性。
方法细节:将mock+wtKLF4的PDX细胞注射到NSG小鼠,肿瘤负荷较高时,DOX与低剂量化疗(长春新碱+环磷酰胺)同时给药,监测肿瘤负荷和细胞比例。
结果解读:化疗联合KLF4诱导组的肿瘤负荷显著低于单独化疗组(p<0.01,n=6);wtKLF4细胞比例随时间显著降低(图5)。
实验所用关键产品:化疗药物同上,生物发光成像和流式分析检测效果。
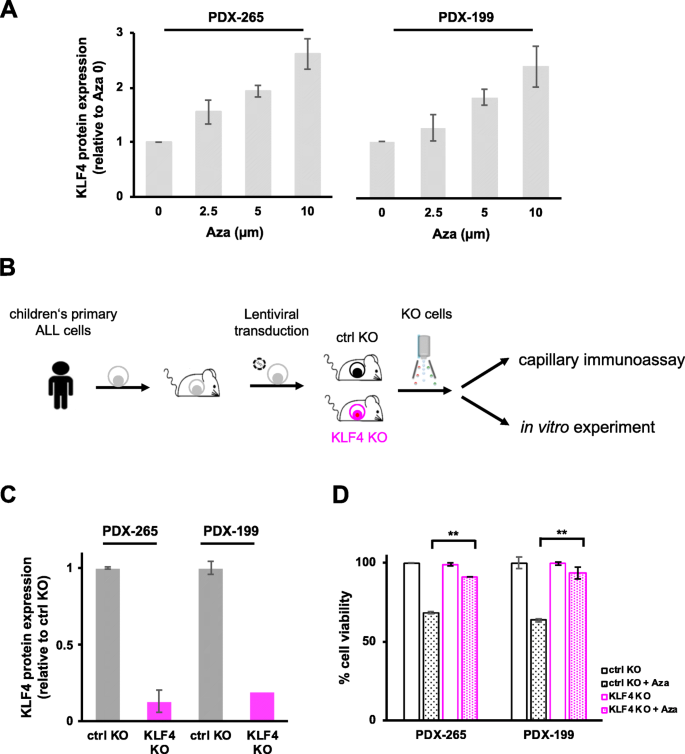
3.7 阿扎胞苷对KLF4的调节及依赖实验
实验目的:寻找上调KLF4的临床药物,并验证其作用依赖KLF4。
方法细节:用不同浓度的阿扎胞苷处理PDX细胞,毛细管免疫分析检测KLF4表达;通过慢病毒转导Cas9和KLF4 sgRNA构建KLF4-KO的PDX细胞,流式细胞术检测阿扎胞苷的细胞毒性。
结果解读:阿扎胞苷处理后,PDX细胞的KLF4蛋白表达随浓度升高而增加(折叠变化增加,n=3);KLF4-KO组的细胞viability较对照组高(p<0.01,n=3),表明阿扎胞苷的毒性依赖KLF4(图6)。
实验所用关键产品:阿扎胞苷为临床药物,CRISPR-Cas9系统用慢病毒转导,sgRNA靶向KLF4,流式细胞术用Annexin V/PI检测细胞viability。
4. Biomarker 研究及发现成果解析
Biomarker定位
本研究涉及的Biomarker为KLF4(转录因子类),筛选逻辑为“文献报道B-ALL中KLF4下调→体外EBV模型验证抑癌作用→PDX可诱导系统体内验证→CRISPR-KO验证药物依赖”;验证逻辑为“蛋白表达检测(毛细管免疫分析、Western blot)→功能验证(肿瘤生长、凋亡、细胞周期)→药物关联(阿扎胞苷调节及依赖)”。
研究过程详述
Biomarker来源:B-ALL患者的PDX细胞和细胞系;验证方法包括:① 毛细管免疫分析和Western blot检测KLF4在PDX细胞中的表达;② 生物发光成像和流式细胞术检测KLF4对肿瘤生长的影响;③ CRISPR-Cas9敲除KLF4后,检测阿扎胞苷的细胞毒性。
特异性与敏感性数据:① PDX模型中,wtKLF4组肿瘤负荷较mock组显著降低(p<0.01,n=6);② MRD阶段诱导KLF4后,肿瘤复发延迟,wtKLF4细胞比例2周内降至不可检测(n=10);③ 阿扎胞苷处理后,KLF4表达升高(折叠变化增加,n=3),KLF4-KO组的细胞viability较对照组高(p<0.01,n=3)。
核心成果提炼
① 功能关联:KLF4是B-ALL的治疗靶点,其下调是肿瘤维持的必要条件;KLF4通过上调p21抑制细胞周期、诱导PARP/Caspase3依赖的凋亡,发挥抑癌作用。
② 创新性:首次在PDX模型中验证“KLF4在MRD阶段的强抑制作用”,提示KLF4靶向治疗可用于MRD巩固,降低复发风险;首次发现“阿扎胞苷通过上调KLF4发挥抗B-ALL作用”,为临床联合用药提供依据。
③ 临床价值:建立的PDX可诱导系统为研究“肿瘤维持靶点”提供了临床相关模型;KLF4可作为B-ALL的“预后标志物”(下调提示复发风险高),阿扎胞苷可作为“KLF4上调药物”用于复发患者。
本研究通过“临床相关模型+可诱导系统+药物关联”的闭环验证,为KLF4作为B-ALL治疗靶点提供了强证据,有望推动复发B-ALL的个性化治疗。
