1. 领域背景与文献引入
文献英文标题:Machine learning-based radiomics model: prognostic prediction and mechanism exploration in patients with endometrial cancer;发表期刊:Biomarker Research;影响因子:未公开;研究领域:子宫内膜癌预后预测与影像组学。
子宫内膜癌是女性生殖系统最常见的恶性肿瘤之一,全球发病率呈逐年上升趋势,早期患者术后5年生存率可达70%-90%,但中晚期及复发患者的生存率骤降至30%左右。传统预后评估主要依赖临床病理指标(如FIGO分期、淋巴结转移、分化程度),但这些指标仅反映肿瘤宏观特征,难以捕捉微观异质性(如肿瘤血管生成、微环境改变),预测准确性有限(约60%-70%)。随着影像组学技术的发展,通过从医学影像中提取高通量定量特征,可非侵入性地反映肿瘤的形态、纹理及病理生理信息,为预后预测提供了新维度。然而,现有研究多聚焦于肿瘤本身的影像特征,忽视了瘤周5mm区域(可能包含亚临床病变、炎症反应及血管生成信息)的互补价值;同时,影像组学模型的生物学机制尚未明确,缺乏与多组学(病理、转录、蛋白)的整合分析。
针对上述空白,本研究旨在探索基于机器学习的肿瘤及瘤周影像组学模型对子宫内膜癌患者术后总生存(OS)的预测价值,分析其与临床指标、多组学的协同作用,并揭示其背后的生物学机制(如血管生成通路),为子宫内膜癌的精准预后评估提供新工具。
2. 文献综述解析
文献综述围绕“子宫内膜癌预后预测的现状与挑战”“影像组学的应用潜力”“多组学整合的价值”三大维度展开评述:
- 传统临床预后因素的局限性:FIGO分期、淋巴结转移等指标是当前临床决策的核心,但受主观判断及信息不全影响,难以精准分层患者风险;
- 影像组学的未被充分挖掘:影像组学作为“虚拟活检”技术,已在肺癌、乳腺癌中证实其预后价值,但子宫内膜癌领域缺乏“肿瘤+瘤周”双区域的特征整合,且机器学习算法选择单一;
- 多组学结合的潜力:病理组学(H&E图像特征)、转录组学(RNA表达)、蛋白质组学(蛋白表达)可提供更全面的肿瘤信息,但影像组学与多组学的协同预后潜力仍待探索。
现有研究的核心局限性在于:缺乏肿瘤与瘤周影像特征的互补分析、机器学习模型的系统筛选,以及影像组学与生物学机制的关联。本研究的创新点则在于:① 首次整合肿瘤及瘤周5mm区域的3D影像组学特征,挖掘两者的互补价值;② 采用10种机器学习算法(如XGBoost、SVM)筛选最优模型,提升预测效能;③ 结合TCGA、CPTAC数据库及细胞实验,揭示影像组学与血管生成通路(尤其是FLT1基因)的关联,填补机制研究空白。
3. 研究思路总结与详细解析
本研究以“数据收集-特征提取-模型构建-价值评估-机制探索”为核心逻辑,通过多中心队列、多组学整合及功能实验,系统验证影像组学模型的预后价值及机制。
3.1 研究队列建立与数据收集
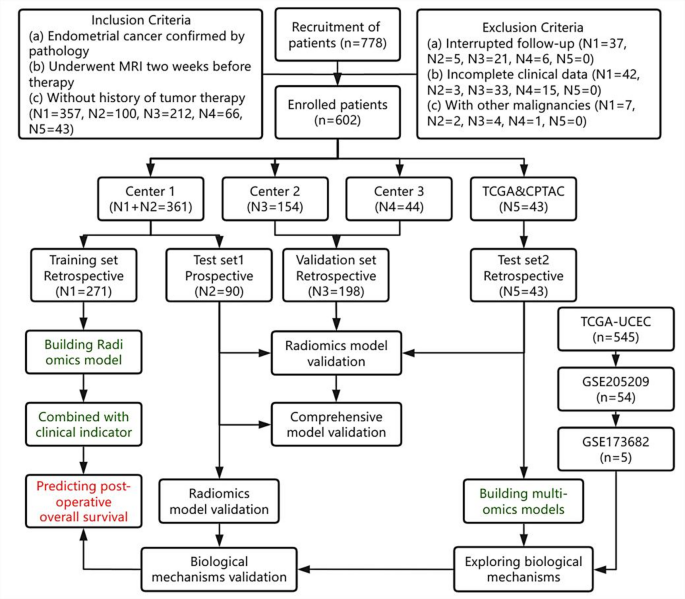
实验目的:构建涵盖回顾性与前瞻性数据的多中心队列,为后续分析提供基础。
方法细节:回顾性收集3个中心(中心1:271例、中心2:154例、中心3:44例)2015-2022年的子宫内膜癌患者数据,前瞻性收集中心1 2020-2024年的90例患者(注册号ChiCTR2100043892),同时纳入TCGA-UCEC(8例)及CPTAC-UCEC(35例)的公共数据,最终纳入602例患者。收集患者的临床信息(年龄、肿瘤最大直径、淋巴结转移、FIGO分期)、手术信息(全子宫切除+附件切除+盆腔淋巴结清扫)及随访数据(术后每3-6个月随访2年,之后每6-12个月随访)。
结果解读:纳入患者中位年龄56岁,192例死亡(31.3%),训练集与验证集的临床特征无显著差异(P>0.05),保证了队列的同质性。
3.2 影像组学特征提取与模型构建
实验目的:提取肿瘤及瘤周的影像组学特征,筛选最优机器学习模型。
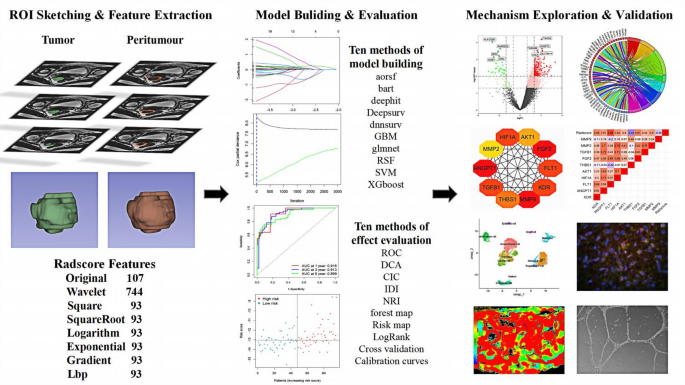
方法细节:由2名放射科医师用3D Slicer勾勒T2WI图像中肿瘤的感兴趣区域(ROI),并扩展5mm获取瘤周ROI,融合为体积感兴趣区域(VOI)后,用PyRadiomics提取3D纹理特征;通过组内相关系数(ICC>0.75)筛选稳健特征,Spearman相关分析去除冗余特征(相关性>0.90),LASSO回归进一步压缩特征维度;采用10种机器学习算法(aorsf、bart、dephit、Deepsurv、dnnsurv、GBM、glmnet、RSF、SVM、XGBoost)构建模型,以C-index和ROC曲线下面积(AUC)评估效能。
结果解读:共提取16个肿瘤特征和12个瘤周特征,XGBoost模型的预测效能最优——联合肿瘤及瘤周特征的模型在验证集的1、3、5年AUC分别为0.862、0.885、0.870,测试集1为0.823、0.869、0.849,测试集2为0.850、0.731、0.800,表明模型具有良好的泛化能力。
实验所用关键产品:3D Slicer(ROI勾勒)、PyRadiomics(特征提取)、R语言(统计分析)。
3.3 影像组学与临床/多组学的结合分析
实验目的:评估影像组学模型对临床指标的增量价值及与多组学的协同作用。
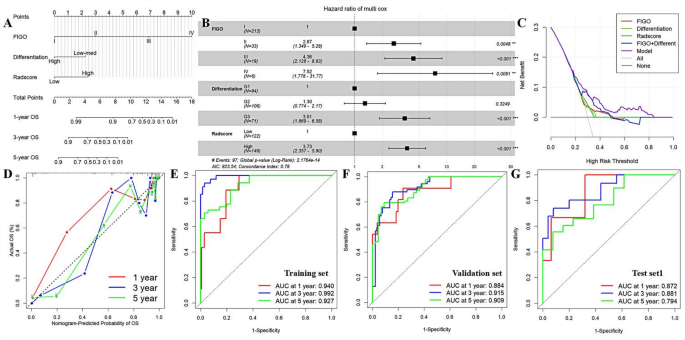
方法细节:用Spearman相关分析排除临床指标(FIGO分期、淋巴结转移、分化程度、临床类型)中的共线性参数,通过多因素Cox回归筛选独立预后因素,构建包含影像组学评分(Radscore)与临床指标的列线图;采用净重新分类指数(NRI)和综合判别改善指数(IDI)评估影像组学的增量价值;收集CPTAC-UCEC患者的病理组学(H&E图像特征)、转录组学(RNA表达)、蛋白质组学(蛋白表达)数据,用LASSO构建各组学模型,联合影像组学模型评估协同预测效能。
结果解读:多因素Cox回归显示,FIGO分期、分化程度及Radscore是独立预后因素(P<0.05);列线图在训练集的1、3、5年AUC分别为0.940、0.992、0.927,验证集为0.884、0.915、0.909,NRI和IDI均显著(P<0.05),表明影像组学显著提升了临床模型的效能;多组学联合模型的1、3、5年AUC达0.989、0.996、1.000,校准曲线显示拟合良好,能精准分层患者预后风险。
3.4 机制探索与功能验证
实验目的:揭示影像组学模型的生物学机制,并通过实验验证。
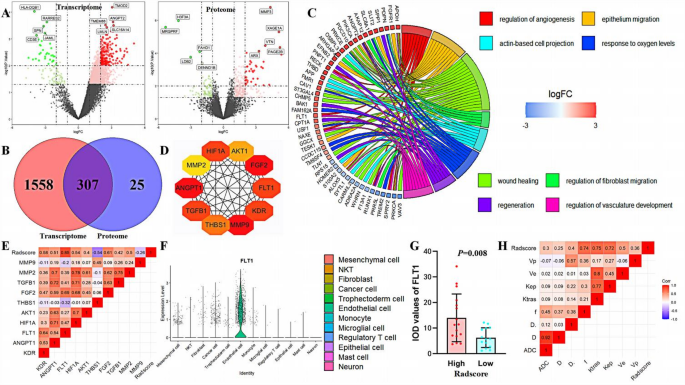
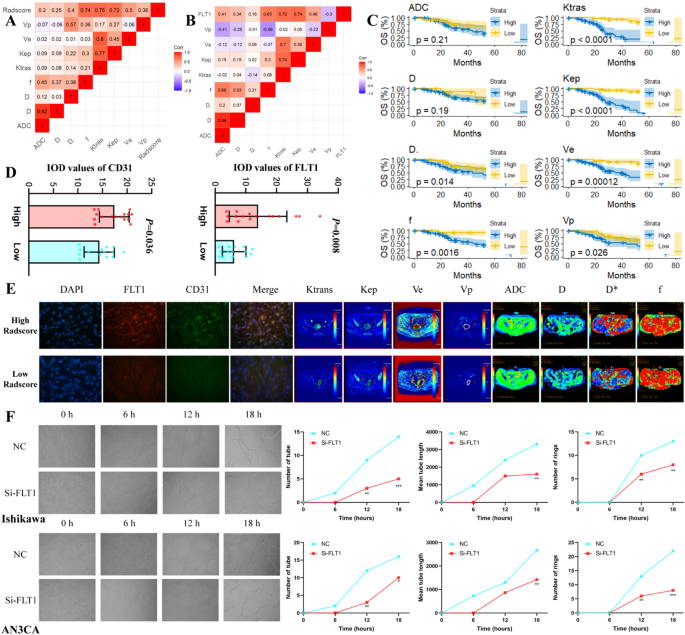
方法细节:根据Radscore cutoff值(1.690)将CPTAC-UCEC患者分为高、低分组,分析转录组与蛋白组的差异基因,通过GO/KEGG富集分析探索通路;用Cytoscape筛选枢纽基因(hub genes),Spearman相关分析枢纽基因与Radscore的相关性;利用TCGA-UCEC、GSE205209、GSE173682数据集验证枢纽基因的表达;通过IVIM-DWI(f值、D值)和DCE-MRI(Ktrans、Kep值)参数评估肿瘤血管生成,分析与Radscore的相关性;用siRNA敲低子宫内膜癌细胞系(Ishikawa、AN3CA)的FLT1表达,通过Transwell、CCK-8、血管生成实验验证其功能。
结果解读:差异基因富集于血管生成及缺氧反应通路*,FLT1是与Radscore相关性最高的枢纽基因(r=0.85,P=0.001);单细胞分析显示FLT1主要表达于内皮细胞及肿瘤细胞,高Radscore患者的FLT1表达显著升高(P<0.05);IVIM-DWI的f值(反映整体血供)、DCE-MRI的Ktrans(反映血管通透性)与Radscore显著正相关(P<0.05),表明高Radscore患者的血管生成更活跃;敲低FLT1后,癌细胞的迁移、侵袭、增殖及血管生成能力显著抑制(P<0.05)。
实验所用关键产品:siRNA(FLT1 knockdown)、Transwell小室、CCK-8试剂盒、血管生成试剂盒。
4. Biomarker研究及发现成果解析
Biomarker定位
本研究的核心Biomarker为影像组学评分(Radscore),类型为基于“肿瘤+瘤周”双区域影像特征的机器学习衍生标志物。筛选逻辑为:从T2WI图像中提取3D纹理特征→ICC>0.75筛选稳健特征→Spearman相关去除冗余→LASSO回归压缩维度→XGBoost模型衍生Radscore。
研究过程详述
Radscore的来源为多中心子宫内膜癌患者的T2WI影像,验证过程涵盖四个维度:
1. 多中心队列验证:在训练集、验证集、测试集1、测试集2中,联合肿瘤及瘤周特征的XGBoost模型AUC达0.800-0.885,表明模型具有稳定的预测效能;
2. 临床增量价值:与FIGO分期、分化程度结合构建的列线图,AUC较临床模型提升10%-15%,NRI和IDI均显著(P<0.05);
3. 多组学协同价值:与病理组学、转录组学、蛋白质组学联合的模型,AUC达0.989-1.000,精准分层患者风险;
4. 机制关联验证:与IVIM-DWI、DCE-MRI血管生成参数显著正相关,且与FLT1表达高度相关(r=0.85,P=0.001)。
核心成果提炼
- 预后价值:Radscore是子宫内膜癌术后OS的独立预后因素(HR=2.31,95%CI 1.56-3.42,P<0.001),高Radscore患者的死亡风险是低分组的2.31倍;
- 机制关联:Radscore通过反映肿瘤血管生成水平发挥预后价值,与FLT1表达高度相关——FLT1高表达提示血管生成活跃,预后更差;
- 临床意义:Radscore可非侵入性评估肿瘤血管生成,为抗血管生成治疗(如FLT1抑制剂)提供潜在靶点,同时多组学联合模型可指导临床精准分层(高风险患者需强化辅助治疗,低风险患者可降级治疗)。
本研究构建的“肿瘤+瘤周”影像组学模型,不仅提升了子宫内膜癌的预后预测效能,更通过多组学整合与功能实验,揭示了影像组学与血管生成的关联,为子宫内膜癌的精准医疗提供了新的理论依据与技术工具。
