1. 领域背景与文献引入
文献英文标题:Deciphering the correlation between metabolic activity through 18F-FDG-PET/CT and immune landscape in soft-tissue sarcomas: an insight from the NEOSARCOMICS study;发表期刊:Biomarker Research;影响因子:未公开;研究领域:软组织肉瘤代谢活性与肿瘤免疫景观的关联研究。
软组织肉瘤(soft-tissue sarcomas, STS)是一类异质性强的恶性肿瘤,18F-氟脱氧葡萄糖正电子发射断层扫描(18F-FDG-PET/CT)作为代谢评估工具,已被传统研究证实与STS的细胞增殖、组织学分级、治疗响应及患者生存密切相关。然而,随着诊断技术的迭代,复杂性指数(complexity index in sarcoma, CINSARC)基因表达签名对经典FNCLCC分级系统形成挑战;同时,免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)虽为STS治疗带来突破,但未筛选人群的响应率仅5%-15%,亟需更精准的患者分层策略——三级淋巴结构(tertiary lymphoid structures, TLS)被证实可预测ICIs获益,但代谢活性与免疫景观的关联在STS中尚未明确。现有研究多聚焦PET/CT的传统预后价值,缺乏其与免疫细胞浸润、TLS状态等免疫微环境特征的系统关联分析,这一空白限制了PET/CT在STS免疫治疗时代的应用潜力。因此,本研究基于NEOSARCOMICS前瞻性队列,旨在通过核成像、转录组学、免疫组化及TLS评估,解析STS代谢活性与免疫景观的相关性,为重新定义PET/CT的临床价值提供依据。
2. 文献综述解析
作者对现有研究的评述逻辑围绕“PET/CT的传统价值-诊断与治疗创新的挑战-跨癌种研究的启示与STS的缺失”展开。现有研究的关键结论包括:①18F-FDG-PET/CT的代谢指标(如标准化摄取值SUV、代谢肿瘤体积MTV)与STS的细胞增殖、高分级及不良生存显著相关,但由于STS的异质性,其作为预后或治疗指导工具的utility仍存争议;②诊断层面,CINSARC基因签名更精准地预测STS复发风险,挑战了传统FNCLCC分级系统;治疗层面,ICIs的低响应率凸显患者分层的必要性,而TLS作为免疫激活的标志,为筛选获益人群提供了新方向;③在肺癌、黑色素瘤等癌种中,PET/CT代谢活性与免疫细胞浸润(如CD8+T细胞)相关,但STS中此类研究缺失,限制了对其免疫微环境调控机制的理解。现有研究的局限性在于未将PET/CT的代谢评估与新兴免疫标志物(如TLS、免疫细胞亚群)结合,难以支撑其在免疫治疗时代的应用。本研究的创新之处在于,首次基于前瞻性STS队列,整合核成像、转录组学与多维度免疫评估,系统解析代谢活性对免疫景观的调控作用,填补了STS代谢-免疫关联的研究空白。
3. 研究思路总结与详细解析
本研究的整体框架为:前瞻性队列招募→PET/CT代谢分组→转录组学解析免疫通路→免疫组化验证蛋白水平→TLS状态关联分析,核心科学问题是“STS的代谢活性如何影响免疫细胞浸润及TLS状态”,最终验证“代谢高活性STS可诱导更强免疫响应”的假设。
3.1 队列招募与代谢分组
实验目的是基于PET/CT指标建立STS的代谢分组。方法细节:纳入NEOSARCOMICS研究中85例成人高等级STS患者(中位年龄62岁,女性占43.5%),提取治疗前18F-FDG-PET/CT的SUVmax/mean/peak、MTV、总病灶糖酵解TLG等指标,通过交叉验证主成分分析(PCA)进行无监督分类——PC1与所有代谢指标强相关,PC2与肿瘤坏死及最长直径相关;将PC1值在随机分布95%范围内的定义为“代谢中间组”(15.3%),PC1值更高的为“代谢高组”(24.7%),PC1值为负的为“代谢低组”(60%)。结果解读:成功构建3个代谢分组,覆盖不同代谢活性的STS人群,为后续关联分析奠定基础。文献未提及具体实验产品,领域常规使用PET/CT扫描仪(如Siemens Biograph系列)、PCA分析软件(如R语言FactoMineR包)。
3.2 转录组学分析免疫通路
实验目的是解析不同代谢组的转录组特征及免疫通路差异。方法细节:对32例患者(代谢高组21.9%、代谢低组62.5%)进行RNA测序,通过差异基因表达(differential gene expression, DGE)分析比较代谢低组与高组的基因表达差异,并对7例极端代谢低组样本(PC1值最低)进行基因集富集分析(GSEA)。结果解读:①代谢低组与高组间存在67个差异基因,代谢高组显著富集CD8+T细胞通路(与ICIs响应密切相关);②极端代谢低组与高组间存在391个差异基因,GSEA显示173条通路显著富集,其中13条免疫相关通路(如ICOS、CD27、IFN-γ通路及CXCL9-10-11/CXCR3轴)在代谢低组中下调,提示其抗肿瘤免疫响应受损。对应文献图1(
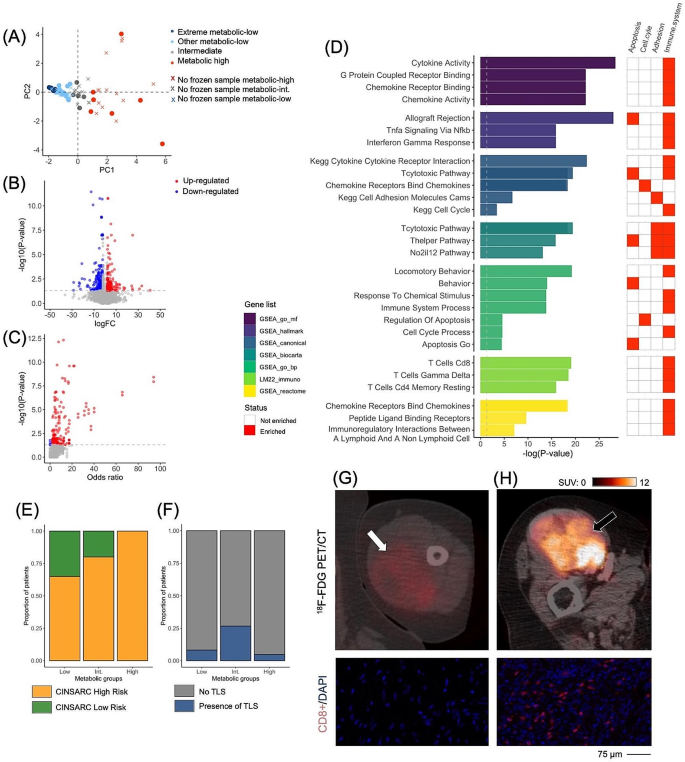
)展示了代谢分组的PCA分布(图1.A)、差异基因火山图(图1.B)及免疫通路富集结果(图1.D)。文献未提及具体实验产品,领域常规使用RNA提取试剂盒(如Qiagen RNeasy Plus)、测序平台(如Illumina NovaSeq)。
3.3 TLS状态关联分析
实验目的是探究代谢分组与TLS状态的相关性。方法细节:对所有85例患者进行TLS评估(基于组织学特征判断成熟/未成熟TLS),分析代谢组(低/中/高)、PC1/PC2及原始PET指标与TLS状态的关联。结果解读:代谢分组(低/中/高)、PC1/PC2及SUV、MTV等指标与TLS状态无显著关联(P>0.05),提示代谢活性与TLS可能独立调控STS的免疫响应。文献未提及具体实验产品,领域常规使用TLS评估的免疫组化抗体(如CD20、CD3抗体标记B/T细胞)。
3.4 免疫组化验证蛋白水平
实验目的是在蛋白水平验证代谢活性与免疫细胞密度的关联。方法细节:对31例患者(代谢高组25.8%、代谢低组58.1%)进行多标记免疫组化(检测c-MAF、CD8、CD14、CD20、CD45、CD68),统计免疫细胞密度并与PC1(代谢活性指标)进行相关性分析。结果解读:CD8+、CD14+、CD45+、CD68+及c-MAF+细胞密度与PC1呈正相关(P值范围0.0247-0.0499);代谢高组的平均细胞密度显著高于代谢低组(如CD8+细胞密度:代谢高组539/mm² vs 代谢低组1/mm²,文献图1.G-H展示典型案例)。文献未提及具体实验产品,领域常规使用免疫组化试剂盒(如Dako EnVision系统)及对应抗体(如CD8抗体克隆SP57)。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本研究涉及两类Biomarker:①代谢相关Biomarker:18F-FDG-PET/CT衍生的SUV、MTV、TLG等指标,通过PCA无监督分类筛选为“代谢低/中/高”分组;②免疫相关Biomarker:CD8+、CD14+、CD45+、CD68+、c-MAF+细胞密度(蛋白水平)及CD8+T细胞通路(转录水平)。筛选验证逻辑为:PET/CT指标→PCA分组→转录组学验证免疫通路→免疫组化验证蛋白水平,形成“影像学-组学-蛋白”的多维度验证链条。
研究过程详述
代谢Biomarker的来源为治疗前18F-FDG-PET/CT成像,通过PCA分析将连续变量转换为分类变量(代谢分组);免疫Biomarker的来源为肿瘤组织样本,通过RNA测序(转录水平)及免疫组化(蛋白水平)验证。验证方法包括:①转录组学层面,DGE分析比较代谢组间的基因表达差异,GSEA富集免疫通路;②蛋白层面,免疫组化计数免疫细胞密度,并通过Spearman相关性分析关联代谢活性(PC1)。特异性与敏感性数据:代谢高组的CD8+细胞密度显著高于低组(P<0.05),且细胞密度与PC1的相关性具有统计学意义(P值范围0.0247-0.0499);但代谢分组与TLS状态无关联(P>0.05)。
核心成果提炼
本研究的核心成果包括:①代谢活性与免疫细胞浸润正相关:代谢高组的CD8+T细胞、巨噬细胞(CD14+、CD68+)等免疫细胞密度显著更高,提示快速增殖的代谢高活性STS可诱导更强的免疫响应,招募免疫细胞浸润;②代谢与TLS独立调控免疫:代谢分组与TLS状态无关联,推测两者通过不同机制影响免疫响应(如代谢调控固有免疫细胞浸润,TLS调控适应性免疫激活);③代谢Biomarker的潜在价值:PET/CT的代谢分组可作为免疫细胞浸润的预测指标,为筛选ICIs潜在获益人群提供参考(如代谢高组可能对ICIs更敏感)。
统计学结果:代谢高组与低组的免疫细胞密度差异均具有统计学意义(P<0.05,样本量n=31);代谢分组与TLS无关联(P>0.05,样本量n=85)。
本研究首次系统解析了STS代谢活性与免疫景观的关联,为PET/CT在免疫治疗时代的应用提供了新证据——代谢高活性STS可能富集免疫细胞,有望成为ICIs的潜在获益人群;而代谢与TLS的独立关系,提示两者联合评估可能提高患者分层的准确性。未来需在不同组织学亚型的STS中验证上述结论,为临床转化提供支撑。
