1. 领域背景与文献引入
文献英文标题:Novel insights into the role of immunomodulatory extracellular vesicles in the pathogenesis of liver fibrosis;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肝纤维化的免疫调节机制与细胞外囊泡(EVs)应用。
肝纤维化是慢性肝病(如病毒性肝炎、酒精性肝病、代谢相关脂肪性肝炎)的终末病理阶段,可进展为肝硬化(全球第11位死亡原因)甚至肝细胞癌。其核心机制是肝星状细胞(HSCs)持续激活与免疫细胞浸润形成的炎症微环境相互作用,导致细胞外基质(ECM)过度沉积。领域发展关键节点包括:1990年代明确HSCs是纤维化的“效应细胞”;2000年代揭示巨噬细胞、中性粒细胞等免疫细胞的调控作用;2010年代以来,EVs作为细胞间通讯的“生物载体”,因能传递脂质、蛋白、核酸等 cargo 调控靶细胞功能,成为研究热点。当前研究热点集中于EVs在肝纤维化炎症微环境中的作用,但未解决的核心问题包括:EVs诊断的特异性与敏感性不足(缺乏标准化分离方法)、治疗性EVs的临床转化障碍(如靶向性差、大规模生产困难)。
现有研究多聚焦于单一细胞来源EVs的 cargo 功能,对其免疫调节的系统机制及临床应用(诊断/治疗)的整合分析不足。本文旨在综述EVs在肝纤维化炎症微环境中的作用,系统关联其诊断潜力与治疗价值,弥补现有研究的“重机制、轻转化”缺陷,为肝纤维化的精准诊疗提供新视角。
2. 文献综述解析
作者对现有研究的分类维度以“细胞来源”(肝细胞、HSCs、巨噬细胞等)和“功能方向”(促纤维化/抗纤维化)为核心,梳理了EVs在肝纤维化中的免疫调节网络:
现有研究关键结论与局限
现有研究明确EVs是细胞间通讯的核心载体:肝细胞来源EVs(如酒精刺激下的miR-122)通过激活单核细胞促进炎症;HSCs来源EVs(如miR-199a-5p)通过靶向CCN2抑制自身激活(抗纤维化);巨噬细胞来源EVs(如酒精诱导的miR-27a)通过自分泌极化M2巨噬细胞(促纤维化)。但研究存在明显局限:EVs分离方法缺乏标准化(超速离心与试剂盒分离的EVs纯度差异大)、临床样本异质性高(年龄、性别会影响EVs cargo 组成)、治疗性EVs的体内靶向性不足(难以精准递送⾄HSCs或免疫细胞)。
本文创新价值
本文首次将EVs的免疫调节机制与临床应用系统关联:不仅总结了不同细胞来源EVs的“cargo-靶细胞-信号通路”轴,还重点分析了EVs作为生物标志物的病因特异性(如miR-122关联酒精性肝病、lncRNA H19关联胆汁淤积性肝病)及治疗载体的转化潜力(如间充质干细胞来源EVs的抗纤维化作用),弥补了现有综述“重机制、轻转化”的不足。
2. 文献综述解析
作者对现有研究的分类维度以“细胞来源”(肝细胞、HSCs、巨噬细胞等)和“功能方向”(促纤维化/抗纤维化)为核心,梳理了EVs在肝纤维化中的免疫调节网络:
现有研究关键结论与局限
现有研究明确EVs是细胞间通讯的核心载体:肝细胞来源EVs(如酒精刺激下的miR-122)通过激活单核细胞促进炎症;HSCs来源EVs(如miR-199a-5p)通过靶向CCN2抑制自身激活(抗纤维化);巨噬细胞来源EVs(如酒精诱导的miR-27a)通过自分泌极化M2巨噬细胞(促纤维化)。但研究存在明显局限:EVs分离方法缺乏标准化(超速离心与试剂盒分离的EVs纯度差异大)、临床样本异质性高(年龄、性别会影响EVs cargo 组成)、治疗性EVs的体内靶向性不足(难以精准递送⾄HSCs或免疫细胞)。
本文创新价值
本文首次将EVs的免疫调节机制与临床应用系统关联:不仅总结了不同细胞来源EVs的“cargo-靶细胞-信号通路”轴,还重点分析了EVs作为生物标志物的病因特异性(如miR-122关联酒精性肝病、lncRNA H19关联胆汁淤积性肝病)及治疗载体的转化潜力(如间充质干细胞来源EVs的抗纤维化作用),弥补了现有综述“重机制、轻转化”的不足。
3. 研究思路总结与详细解析
本文作为系统性综述,以“EVs的生物学基础→肝纤维化炎症微环境→EVs的免疫调节作用→临床应用”为逻辑框架,逐步展开分析:
3.1 EVs的结构与生物发生概述
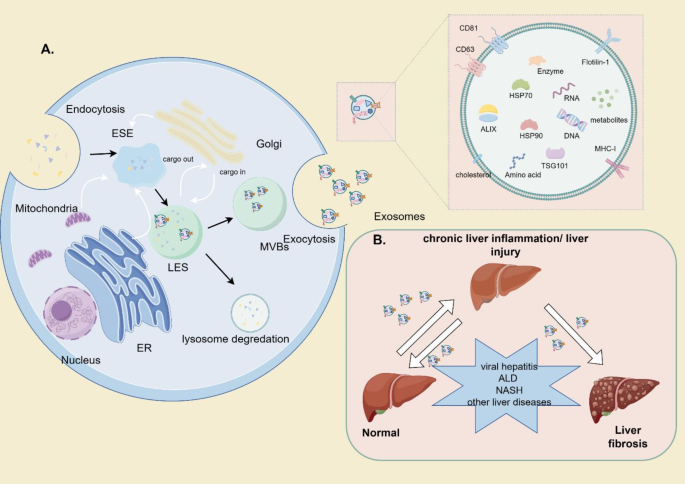
实验目的:明确EVs的分类、结构特征,为后续机制讨论奠定基础。
方法细节:参考MISEV2018指南,将EVs分为小EVs(<200nm,外泌体)与大EVs(>200nm,微囊泡);结构上强调脂质双层膜(保护cargo 免受降解)与表面标志蛋白(如CD63、TSG101,用于EVs鉴定);生物发生途径包括内体途径(早期内体→晚期内体→多泡体→外泌体释放)与质膜出芽(微囊泡直接从细胞膜脱落)。
结果解读:EVs的“异质性”(来源、大小、cargo 组成)决定了其功能多样性——表面蛋白(如CD44)可作为靶向标记,cargo(如miRNA、蛋白)则直接调控靶细胞功能。
3.2 肝纤维化的炎症微环境调控网络
实验目的:阐述肝纤维化的核心驱动机制——“慢性损伤→炎症激活→HSCs激活→ECM沉积”的恶性循环。
方法细节:慢性肝病(如酒精、脂毒性)诱导肝细胞损伤,释放损伤相关分子模式(DAMPs)(如HMGB1)激活Kupffer细胞(肝脏 resident 巨噬细胞),分泌TNF-α、IL-6等促炎因子;这些因子进一步招募单核细胞浸润,分化为单核细胞来源巨噬细胞(MoMFs),持续激活HSCs分泌ECM;同时,激活的HSCs反过来分泌趋化因子(如CCL2)招募更多免疫细胞,形成炎症循环。
结果解读:炎症微环境是肝纤维化的“发动机”,免疫细胞与HSCs的交叉对话是逆转纤维化的关键靶点。

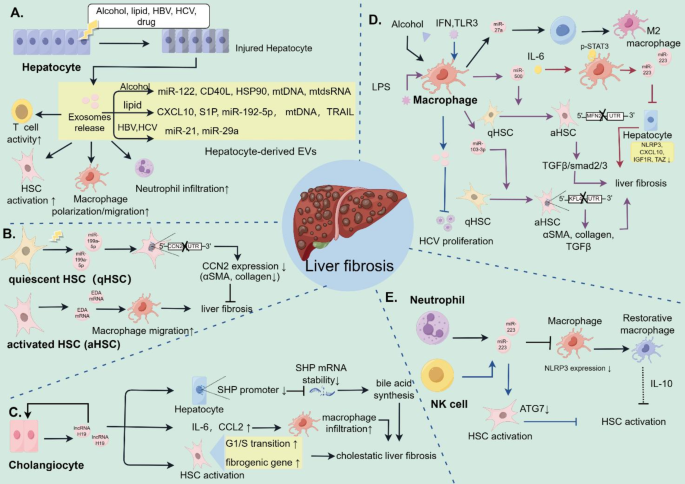
3.3 不同细胞来源EVs的免疫调节作用
实验目的:解析每种细胞来源EVs的“cargo-靶细胞-信号通路”轴,明确其促/抗纤维化功能。
方法细节与结果解读:
- 肝细胞EVs:酒精刺激下分泌miR-122富集的EVs,通过抑制单核细胞的血红素氧合酶1(HO-1)通路,增强其对脂多糖(LPS)的敏感性,促进炎症;脂毒性(如棕榈酸)刺激下分泌miR-192-5p富集的EVs,通过Rictor/Akt/FoxO1通路极化巨噬细胞为促炎M1表型,加速纤维化。
- HSCs EVs:静息HSCs分泌miR-199a-5p富集的EVs,通过靶向结缔组织生长因子(CCN2)抑制自身激活(抗纤维化);但激活的HSCs分泌外异蛋白A(EDA) mRNA富集的EVs,促进巨噬细胞迁移,形成促纤维化正反馈。
- 巨噬细胞EVs:酒精刺激单核细胞分泌miR-27a富集的EVs,通过自分泌作用极化M2巨噬细胞(促纤维化);LPS刺激THP-1巨噬细胞分泌miR-500富集的EVs,通过抑制线粒体融合蛋白2(MFN2)激活HSCs的TGF-β/Smad通路,促进ECM沉积。
- 中性粒细胞EVs:分泌miR-223富集的EVs,通过抑制NOD样受体蛋白3(NLRP3)炎症小体,促进巨噬细胞向修复表型(M2)转化,缓解炎症。
- NK细胞EVs:分泌miR-223富集的EVs,通过抑制自噬相关基因7(ATG7)阻断HSCs自噬,抑制其激活(抗纤维化)。
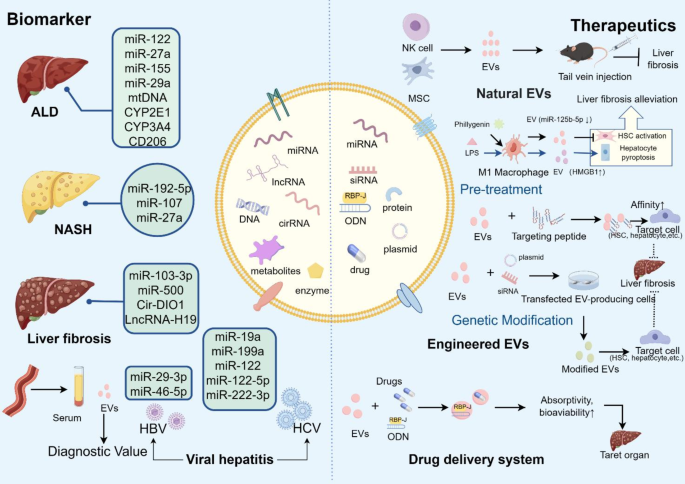
3.4 EVs在肝纤维化中的诊断与治疗应用
实验目的:评估EVs作为生物标志物(诊断)与治疗载体(干预)的临床潜力。
方法细节与结果解读:
- 诊断应用:EVs的“cargo 组成”与肝纤维化的病因特异性和阶段特异性高度相关——miR-122主要关联酒精性肝病(ALD),lncRNA H19关联胆汁淤积性肝病,miR-27a关联乙型肝炎(HBV)相关纤维化;部分cargo(如miR-19a)在丙型肝炎(HCV)相关纤维化中具有诊断价值(与纤维化程度正相关)。
- 治疗应用:①自然EVs:间充质干细胞(MSC)来源EVs通过Wnt/β-catenin通路抑制HSCs激活,缓解小鼠CCl4诱导的纤维化;②修饰EVs:通过基因工程将HSCs靶向肽融合至EVs表面(如Lamp2b-HuR),增强EVs向HSCs的递送效率;③药物负载EVs:将连翘苷A(FA)负载于奶来源EVs(靶向CD44),通过抑制NLRP3炎症小体缓解纤维化(解决FA生物利用度低的问题)。
4. Biomarker 研究及发现成果解析
本文系统总结了EVs作为肝纤维化生物标志物的病因学特征与临床价值,核心成果如下:
Biomarker 定位与筛选逻辑
Biomarker 类型:主要包括EVs中的miRNA(miR-122、miR-192-5p、miR-27a)、长链非编码RNA(lncRNA)(lncRNA H19)、蛋白(细胞色素P450 2E1(CYP2E1)、CD206)。
筛选验证逻辑:基于“临床样本关联分析→细胞/动物模型验证”的流程——例如,miR-122在ALD患者血清EVs中显著升高,且与肝损伤标志物(ALT、AST)正相关;进一步通过细胞实验验证其通过抑制HO-1激活单核细胞的机制。
核心成果与创新性
- 病因特异性 Biomarker:miR-122主要关联酒精性肝病(ALD),其水平与酒精摄入剂量正相关;lncRNA H19主要关联胆汁淤积性肝病,通过调控鞘氨醇-1-磷酸受体2(S1PR2)/鞘氨醇激酶2(SphK2)通路促进胆管细胞增殖;miR-27a主要关联HBV相关纤维化,与HSCs激活程度正相关。
- 阶段特异性 Biomarker:miR-192-5p在代谢相关脂肪性肝炎(MASH)早期即升高,通过极化巨噬细胞加速纤维化进展;miR-19a在HCV相关纤维化中升高,与纤维化分期(S1-S4)正相关(文献未明确AUC值,但提到其诊断价值优于传统标志物如APRI)。
- 创新性:首次系统总结了EVs Biomarker的“病因-功能”对应关系,为肝纤维化的精准诊断提供了依据——例如,检测血清EVs中的miR-122可快速识别ALD患者,而lncRNA H19可用于胆汁淤积性肝病的早期筛查。
局限性与展望
现有EVs Biomarker的敏感性与特异性仍需提升(如miR-122在非酒精性肝病中也会轻度升高),且缺乏大样本多中心验证。未来需建立“标准化EVs分离方法+多组学联合检测”的体系,提高Biomarker的临床实用性。
总结
本文系统梳理了EVs在肝纤维化炎症微环境中的免疫调节机制,明确了其作为生物标志物的病因特异性与治疗载体的转化潜力。尽管EVs的临床应用仍面临标准化分离、靶向递送等挑战,但本文为肝纤维化的精准诊疗提供了新的研究方向——未来通过优化EVs的分离与修饰技术,有望实现“EVs-based 液体活检”与“EVs靶向治疗”的临床转化。
