1. 领域背景与文献引入
文献英文标题:Combining BTK inhibitors with BCL2 inhibitors for treating chronic lymphocytic leukemia and mantle cell lymphoma;发表期刊:Biomarker Research;影响因子:未公开;研究领域:慢性淋巴细胞白血病与套细胞淋巴瘤的靶向联合治疗。
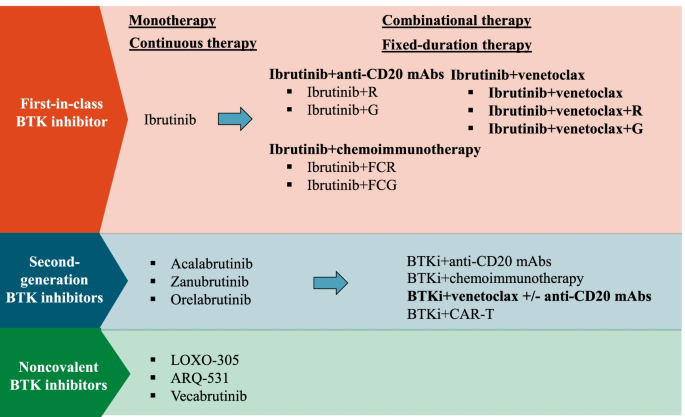
慢性淋巴细胞白血病(CLL)与套细胞淋巴瘤(MCL)是常见的B细胞恶性肿瘤,传统化疗免疫治疗存在响应率低、毒性大、易复发等问题。BTK(布鲁顿酪氨酸激酶)抑制剂的出现彻底改变了这类疾病的治疗格局——伊布替尼作为首个BTK抑制剂,在CLL/MCL的初治和复发难治(R/R)患者中显著延长无进展生存期(PFS),但单药治疗仍面临挑战:约1/3 R/R MCL患者无响应,CLL患者单药治疗多为部分缓解(PR),完全缓解(CR)率低,且长期使用可能出现BTK/PLCG2突变耐药及心血管副作用(如房颤)。BCL2抑制剂(如维奈克拉)通过选择性拮抗抗凋亡蛋白BCL2诱导肿瘤细胞凋亡,但其耐药常与MCL1、BCLX_L上调相关。鉴于BTK抑制剂与BCL2抑制剂在机制上的互补性——前者抑制肿瘤细胞迁移、增殖及NF-κB介导的BCL2上调,后者直接诱导凋亡并逆转BTK抑制剂耐药,联合使用有望提高疗效、克服耐药。在此背景下,本文系统综述了BTK抑制剂联合BCL2抑制剂治疗CLL/MCL的理论依据、临床研究数据及未来方向,为解决单药治疗的局限性提供了关键参考。
2. 文献综述解析
作者对现有研究的分类维度围绕“单药治疗的挑战→联合治疗的机制协同→临床研究证据(双药/三药联合)”展开。现有研究的关键结论包括:①BTK抑制剂单药在CLL/MCL中有效,但R/R MCL响应率不足(约68%)、缓解持续时间短(中位<2年),CLL患者CR率低且长期使用有耐药风险;②BCL2抑制剂单药治疗的耐药机制主要为MCL1、BCLX_L上调,而BTK抑制剂可通过下调这些蛋白增强维奈克拉的敏感性;③联合治疗在细胞系和动物模型中显示出协同效应——如伊布替尼联合维奈克拉可更有效降低BTK/AKT磷酸化水平、诱导线粒体膜电位下降及凋亡相关蛋白(如PARP)裂解;④临床研究中,双药联合(伊布替尼+维奈克拉)在R/R CLL(CLARITY研究ORR 89%,CR 51%)和R/R MCL(AIM研究CR率42%)中显著提高响应率,三药联合(加抗CD20单抗如奥妥珠单抗)进一步提升微小残留病(MRD)阴性率,但部分研究为单臂设计,缺乏头对头比较数据。现有研究的局限性包括:多数临床研究样本量较小、随访时间有限,长期安全性(如心血管毒性)及耐药机制需进一步明确;抗CD20单抗与BTK抑制剂的联合价值仍存在争议(如伊布替尼可能拮抗利妥昔单抗的NK细胞介导的细胞毒性)。
本文的创新价值在于:首次系统整合了BTK+BCL2联合治疗的基础机制与临床证据,重点梳理了双药与三药联合的最新临床试验结果(如CAPTIVATE、SYMPATICO研究),并提出“MRD驱动的固定疗程治疗”这一未来方向,为临床决策提供了更全面的证据支持。
3. 研究思路总结与详细解析
作为一篇综述性研究,本文的核心目标是系统评估BTK抑制剂联合BCL2抑制剂治疗CLL/MCL的有效性与安全性,核心科学问题包括:①联合治疗的机制协同性如何?②双药/三药联合的临床疗效与安全性如何?③未来的研究方向是什么?技术路线遵循“机制探讨→临床证据总结→未来展望”的逻辑闭环。
3.1 联合治疗的机制研究
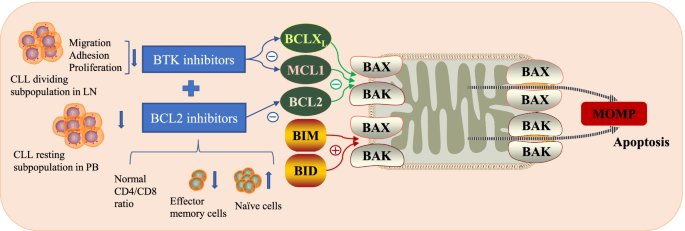
实验目的:阐明BTK抑制剂与BCL2抑制剂在CLL/MCL中的协同作用机制。方法细节:通过CLL/MCL细胞系(如MCL细胞系)、动物模型(如TCL1小鼠模型)及分子生物学技术(Western blot检测BTK/AKT磷酸化水平、基因表达谱分析、蛋白质相互作用网络分析)开展研究。结果解读:在CLL中,伊布替尼通过抑制BTK通路减少MCL1、BCLX_L表达,增强维奈克拉对BCL2的抑制作用,协同诱导线粒体outer membrane permeabilization(MOMP)及凋亡;在MCL中,联合治疗可更有效下调BCL2家族抗凋亡蛋白,激活p53/BIM介导的凋亡通路,且BTK表达与BCL2表达正相关——BTK通过NF-κB通路转录上调BCL2,维奈克拉可逆转伊布替尼耐药。实验所用关键产品:文献未提及具体实验产品,领域常规使用BTK抑制剂(如伊布替尼)、BCL2抑制剂(如维奈克拉)、Western blot试剂(如抗BTK、抗BCL2抗体)等。
3.2 双药联合的临床研究
实验目的:评估BTK抑制剂(伊布替尼/阿卡布替尼/泽布替尼)联合BCL2抑制剂(维奈克拉)在CLL/MCL中的疗效与安全性。方法细节:纳入多项phase 2/3临床试验,如CLL的CLARITY(R/R CLL,单臂)、CAPTIVATE(初治CLL,随机)研究,MCL的AIM(R/R MCL,单臂)、SYMPATICO(R/R MCL,随机)研究;治疗方案为“伊布替尼单药导入→联合维奈克拉”或“同步联合”,疗效终点包括总响应率(ORR)、完全缓解率(CR)、微小残留病(MRD)阴性率及PFS。结果解读:CLARITY研究中,R/R CLL患者联合治疗后ORR达89%,CR率51%,12个月时53%患者外周血MRD阴性,36%骨髓MRD阴性;AIM研究中,R/R MCL患者联合治疗16周CR率达42%(显著高于伊布替尼单药的9%),67%患者骨髓MRD清除。实验所用关键产品:文献未提及具体实验产品,领域常规使用BTK抑制剂、BCL2抑制剂等。
3.3 三药联合的临床研究
实验目的:评估BTK抑制剂+BCL2抑制剂+抗CD20单抗(如奥妥珠单抗)的疗效与安全性。方法细节:纳入CLL/MCL的phase 2研究,如CLL的“奥妥珠单抗+伊布替尼+维奈克拉”研究、MCL的“伊布替尼+奥妥珠单抗+维奈克拉”研究;治疗方案为抗CD20单抗短疗程(如6个周期)联合BTK+BCL2抑制剂,疗效终点同双药联合。结果解读:在CLL中,三药联合的MRD阴性率达78%(骨髓),对TP53突变患者有效;在MCL中,三药联合的CR率达67%(R/R患者)及86.6%(初治患者),且MRD清除率高。实验所用关键产品:文献未提及具体实验产品,领域常规使用抗CD20单抗、BTK抑制剂、BCL2抑制剂等。
4. Biomarker研究及发现成果解析
Biomarker定位:本文重点关注的Biomarker为微小残留病(MRD),类型为“循环/骨髓中的微小残留病”,筛选/验证逻辑遵循“临床试验中作为疗效终点→通过流式细胞术/PCR检测→与临床结局(如PFS)关联”的完整链条。
研究过程详述:MRD的来源为CLL/MCL患者的外周血(PB)或骨髓(BM)样本;验证方法采用多色流式细胞术(检测肿瘤细胞表面标志物,如CD5+CD19+)或定量PCR(检测肿瘤特异性基因,如IGHV突变);特异性与敏感性数据:如CLARITY研究中,联合治疗12个月后53%患者外周血MRD阴性(敏感性高,可检测低水平残留病灶),36%骨髓MRD阴性(特异性高,反映深层缓解);AIM研究中67% R/R MCL患者骨髓MRD清除(临床相关性显著,与PFS延长关联)。
核心成果提炼:MRD阴性是联合治疗的关键疗效指标——MRD阴性患者的PFS显著长于MRD阳性患者(如CAPTIVATE研究中,MRD阴性患者2年无病生存率达95%);创新性在于提出“MRD驱动的固定疗程治疗”——即MRD阴性后可停止治疗,避免长期用药的副作用;统计学结果:如CLARITY研究中,23例MRD阴性患者停药后38个月仍维持缓解(n=23,文献未明确P值);AIM研究中,MRD阴性且PET-CT CR的患者停药后无进展(文献未明确样本量,P值未公开)。
综上,本文系统总结了BTK抑制剂联合BCL2抑制剂治疗CLL/MCL的机制与临床证据,MRD作为关键Biomarker为个性化治疗提供了依据,未来需更多随机试验验证联合治疗的长期疗效与安全性。