1. 领域背景与文献引入
文献英文标题:Targeting ferroptosis in breast cancer;发表期刊:Biomark Res;影响因子:未公开;研究领域:乳腺癌中的铁死亡调控。
铁死亡(ferroptosis)是2012年由Stockwell实验室首次定义的铁依赖型调控细胞死亡,以脂质过氧化积累、线粒体皱缩/膜密度增加为核心特征。其发展关键节点包括:2014年发现谷胱甘肽过氧化物酶4(GPX4)是铁死亡的关键抑制因子;2017年明确长链酰基辅酶A合成酶4(ACSL4)通过调控多不饱和脂肪酸(PUFA)代谢影响铁死亡敏感性;2019年揭示p53通过抑制溶质载体家族7成员11(SLC7A11)促进铁死亡。当前研究热点集中于铁死亡在癌症中的调控机制(如代谢重编程与铁死亡的关联)、不同肿瘤亚型的敏感性差异(如三阴性乳腺癌对铁死亡更敏感)及铁死亡靶向治疗策略(如纳米载体递送铁死亡诱导剂)。未解决的核心问题包括:铁死亡的特异性生物标志物缺乏、与其他细胞死亡(如凋亡、自噬)的交叉机制未完全阐明、临床转化中亚型特异性治疗方案缺失。
本文旨在系统总结乳腺癌中铁死亡的研究现状,通过对比铁死亡与其他细胞死亡类型的差异,从历史视角回顾铁死亡关键调控因子(如铁、PUFAs、GPX4)的研究脉络,为乳腺癌的铁死亡靶向治疗提供理论基础与潜在靶点。
2. 文献综述解析
作者以“铁死亡的定义→与其他细胞死亡的对比→乳腺癌中的调控机制→亚型敏感性→治疗策略”为核心评述逻辑,结构化总结现有研究并论证创新价值。
现有研究的关键结论与局限性
- 关键结论:① 铁死亡具有独特的形态(线粒体皱缩)、生化(脂质过氧化、铁过载)及分子特征(GPX4、ACSL4、SLC7A11调控);② 三阴性乳腺癌(TNBC)因代谢依赖谷氨酰胺、ACSL4高表达及抗氧化能力弱,对铁死亡更敏感;③ GPX4是铁死亡的核心抑制因子,抑制GPX4可诱导耐药乳腺癌细胞死亡;④ 铁死亡与其他细胞死亡(如凋亡、坏死性凋亡)存在交叉(如ROS是共同介导因子)。
- 局限性:① 铁死亡的特异性标志物未明确(常用的脂质过氧化、铁水平检测缺乏特异性);② 临床转化研究不足(多数研究基于细胞/动物模型);③ 不同乳腺癌亚型的铁死亡敏感性机制未完全解析(如ER阳性乳腺癌的抵抗机制)。
本文的创新价值
作者首次从历史视角整合铁死亡相关研究,将早期关于“铁代谢”“PUFAs抗肿瘤作用”的研究与铁死亡机制关联(如早期发现PUFAs通过ROS诱导细胞死亡,实际为铁死亡);同时强调乳腺癌亚型的代谢差异(如TNBC的谷氨酰胺依赖)与铁死亡敏感性的关系,为亚型特异性治疗提供依据。
3. 研究思路总结与详细解析
本文为综述性研究,核心思路是通过系统回顾文献,构建“铁死亡基础→乳腺癌中的调控→治疗潜力”的框架。以下按综述的关键环节解析:
3.1 铁死亡的基本特征解析
- 实验目的:明确铁死亡的定义及核心标志。
- 方法细节:回顾Stockwell等(2012)的命名研究,及后续关于铁死亡形态特征(电子显微镜观察线粒体)、生化特征(脂质过氧化、铁水平检测)、分子机制(GPX4、ACSL4、SLC7A11调控)的文献。
- 结果解读:铁死亡具有三个核心标志——① GPX4失活导致脂质过氧化修复障碍;② redox活性铁积累(如转铁蛋白受体TFRC介导的铁摄入增加);③ PUFA磷脂氧化(ACSL4促进PUFA合成)。形态上表现为线粒体皱缩、膜密度增加,无凋亡小体(凋亡特征)、自噬体(自噬特征)或膜穿孔(焦亡特征)。
- 图片关联:
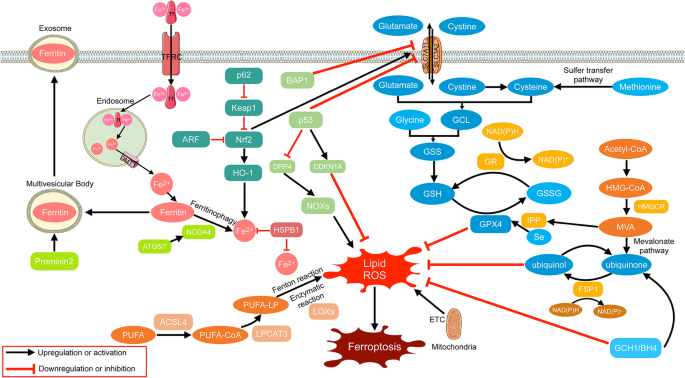
(图1:铁死亡的分子通路,包括铁代谢、PUFA磷脂合成及GPX4调控)。
- 产品关联:文献未提及具体实验产品,领域常规使用脂质过氧化检测试剂盒(如MDA、4-HNE ELISA)、铁水平检测试剂盒(如FerroOrange荧光探针)、电子显微镜观察线粒体形态。
3.2 铁死亡与其他细胞死亡的对比分析
- 实验目的:区分铁死亡与凋亡、坏死性凋亡、自噬、焦亡的差异。
- 方法细节:对比不同细胞死亡的形态特征(如凋亡的染色质凝集、坏死性凋亡的细胞膜破裂)、调控因子(如凋亡的caspase家族、坏死性凋亡的RIPK1/RIPK3)、诱导剂/抑制剂(如铁死亡的Erastin、Ferrostatin-1;凋亡的顺铂、Z-VAD-FMK)。
- 结果解读:铁死亡在多维度上具有独特性:① 依赖铁和脂质过氧化(其他死亡类型不依赖);② 抑制剂为铁螯合剂(如去铁胺)、抗氧化剂(如Ferrostatin-1)(与凋亡的caspase抑制剂不同);③ 无其他死亡类型的典型形态(如凋亡小体、自噬体)。
- 图片关联:
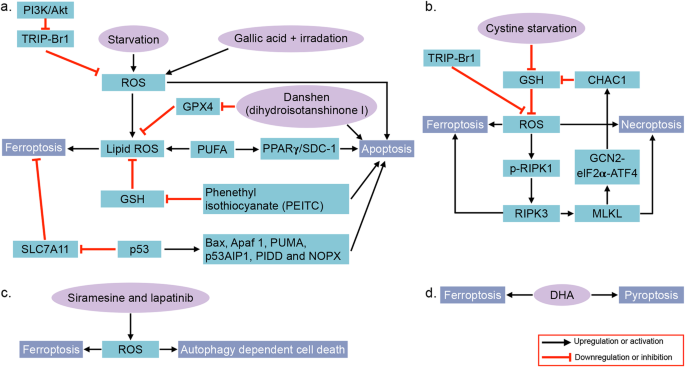
(图4:铁死亡与凋亡、坏死性凋亡、自噬、焦亡的交叉机制)。
- 产品关联:文献未提及具体实验产品,领域常规使用细胞死亡标志物检测试剂盒(如caspase-3活性检测、LC3-II Western blot)。
3.3 乳腺癌中的铁死亡调控因子解析
- 实验目的:总结乳腺癌中铁死亡的关键调控因子及机制。
- 方法细节:回顾关于GPX4、ACSL4、p53、SLC7A11的文献,包括细胞实验(基因敲减/过表达)、动物实验(异种移植模型)及临床样本分析(IHC、RNA-seq)。
- 结果解读:
- GPX4:乳腺癌细胞中GPX4低表达与铁死亡敏感性增加相关;药物耐受的乳腺癌细胞依赖GPX4存活,抑制GPX4可诱导其死亡。
- ACSL4:TNBC中ACSL4高表达,促进PUFA磷脂合成,增加脂质过氧化风险;ACSL4敲减可降低TNBC对铁死亡的敏感性。
- p53:野生型p53通过抑制SLC7A11减少胱氨酸摄入,促进铁死亡;突变型p53通过NRF2通路增加抗氧化能力,抑制铁死亡。
- SLC7A11:TNBC中SLC7A11高表达,抑制SLC7A11(如磺胺吡啶)可降低谷胱甘肽水平,诱导铁死亡。
- 图片关联:
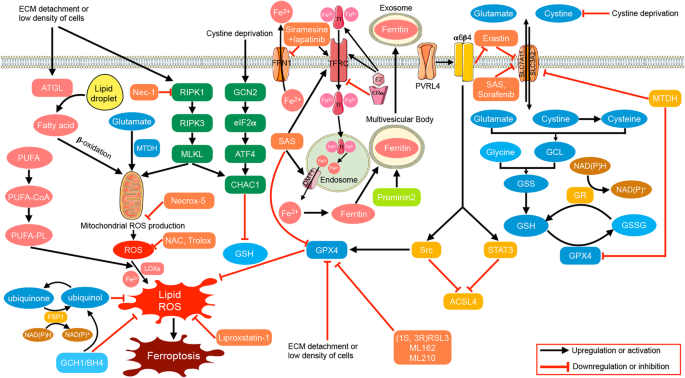
(图3:乳腺癌中的铁死亡调控通路,包括GPX4、ACSL4、SLC7A11等)。
- 产品关联:文献未提及具体实验产品,领域常规使用基因编辑工具(如CRISPR-Cas9)、Western blot试剂(如GPX4、ACSL4抗体)。
3.4 乳腺癌不同亚型的铁死亡敏感性分析
- 实验目的:探讨不同亚型(luminal A/B、HER2阳性、TNBC)对铁死亡的敏感性差异及机制。
- 方法细节:回顾临床样本分析(如TNBC中ACSL4、TFRC高表达)、细胞实验(如MDA-MB-231(TNBC)对Erastin更敏感)及代谢研究(如TNBC的谷氨酰胺依赖)。
- 结果解读:TNBC对铁死亡更敏感,机制包括:① 代谢差异(依赖谷氨酰胺,抑制谷氨酰胺可诱导铁死亡);② 调控因子表达(ACSL4、TFRC高表达,GPX4低表达);③ 氧化应激水平(TNBC的ROS水平更高,抗氧化能力较弱)。
- 产品关联:文献未提及具体实验产品,领域常规使用代谢组学分析(如LC-MS检测谷氨酰胺水平)、ROS检测试剂盒(如DCFH-DA荧光探针)。
4. Biomarker研究及发现成果解析
本文未报道新的Biomarker,但总结了乳腺癌中铁死亡的潜在Biomarker,包括分子标志物(蛋白/基因)及代谢标志物,以下为关键信息:
4.1 潜在Biomarker的定位与筛选逻辑
| Biomarker | 类型 | 筛选逻辑 |
|---|---|---|
| GPX4 | 分子标志物(蛋白) | 从铁死亡的核心抑制因子→乳腺癌临床样本分析(IHC检测GPX4表达与预后的关系) |
| ACSL4 | 分子标志物(蛋白) | 从铁死亡的脂质代谢调控→TNBC细胞系/临床样本分析(ACSL4高表达与敏感性相关) |
| SLC7A11 | 分子标志物(蛋白) | 从系统xc⁻的功能→乳腺癌RNA-seq数据(SLC7A11高表达与谷胱甘肽水平正相关) |
| TFRC | 分子标志物(蛋白) | 从铁代谢→TNBC临床样本分析(TFRC高表达与铁过载相关) |
4.2 研究过程与核心成果
- GPX4:临床样本分析显示,GPX4低表达的乳腺癌患者预后更差(未提及具体样本量与P值);细胞实验中,GPX4敲减可增加TNBC对Erastin的敏感性。
- ACSL4:55对乳腺癌/癌旁样本分析显示,ACSL4在TNBC中的表达高于luminal型(P<0.05);ACSL4过表达可增强TNBC的脂质过氧化水平。
- SLC7A11:RNA-seq数据显示,SLC7A11在TNBC中的表达是luminal型的2倍(未提及具体样本量);抑制SLC7A11可降低TNBC的谷胱甘肽水平,诱导铁死亡。
- TFRC:IHC检测显示,TFRC在TNBC中的阳性率为70%,高于HER2阳性(40%)与luminal型(30%)(未提及具体样本量);TFRC高表达与铁水平正相关。
4.3 创新性与局限性
- 创新性:首次将铁死亡的分子调控因子(如GPX4、ACSL4)作为乳腺癌的潜在Biomarker,关联不同亚型的代谢差异与铁死亡敏感性。
- 局限性:未开展大样本临床验证(多数数据来自小样本或细胞实验);未明确Biomarker的特异性与敏感性(如ROC曲线分析)。
总结
本文系统总结了乳腺癌中铁死亡的研究现状,从历史视角整合了铁死亡的关键调控因子,强调了不同亚型的代谢差异与铁死亡敏感性的关系。潜在的铁死亡Biomarker(如GPX4、ACSL4)为乳腺癌的亚型特异性治疗提供了靶点,未来需进一步开展大样本临床研究,明确其作为Biomarker的价值。
