1. 领域背景与文献引入
文献英文标题:T cells in cancer: mechanistic insights and therapeutic advances;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤免疫治疗。
肿瘤免疫治疗是近十年肿瘤学领域的革命性突破,T细胞作为适应性免疫的核心效应细胞,通过抗原特异性识别与杀伤肿瘤细胞,构成肿瘤 immunosurveillance的基础。然而,肿瘤通过多重免疫逃逸机制(如诱导T细胞耗竭、激活调节性T细胞(Treg)、重塑 immunosuppressive肿瘤微环境)显著阻碍T细胞功能。近年来,免疫检查点抑制剂(ICIs)、嵌合抗原受体T细胞(CAR-T)等T细胞导向疗法取得突破性进展——ICIs使黑色素瘤患者5年生存率从10%提升至20%,CAR-T在CD19+ B细胞淋巴瘤中的缓解率高达83%——但仍面临三大核心挑战:实体瘤疗效有限(T细胞浸润不足、抗原异质性)、治疗耐药(T细胞耗竭不可逆、肿瘤细胞固有耐药)、毒性管理(细胞因子释放综合征、免疫相关不良事件)。
在此背景下,本文系统整合T细胞在肿瘤中的基础生物学机制(发育、分化、亚群功能)与前沿治疗进展(ICIs、CAR-T、新兴工程技术),搭建“基础研究-临床转化”的桥梁,为解决现有疗法的局限性、开发个性化T细胞治疗提供理论支撑。
2. 文献综述解析
本文综述的核心评述逻辑按“T细胞生物学机制→肿瘤微环境调控→临床治疗进展→未来方向”分层,覆盖T细胞发育与分化、亚群功能、分子通路、现有疗法的优势与挑战四大维度。
现有研究的关键结论
- T细胞亚群的双重作用:细胞毒性CD8+ T细胞通过穿孔素/颗粒酶直接杀伤肿瘤细胞,辅助CD4+ Th1细胞分泌IFN-γ增强CD8+ T细胞功能;但调节性Treg细胞(CD4+CD25+FoxP3+)通过分泌TGF-β、IL-10抑制效应T细胞,非传统γδ T细胞通过MHC非依赖途径识别肿瘤抗原,具有“现成”疗法潜力。
- 肿瘤微环境的抑制作用:肿瘤微环境通过招募Treg、髓源性抑制细胞(MDSCs)分泌抑制性细胞因子,同时通过缺氧、葡萄糖剥夺导致T细胞代谢耗竭,最终诱导T细胞表达PD-1、CTLA-4等抑制性受体,进入“耗竭状态”。
- 现有疗法的临床突破:ICIs(如pembrolizumab、ipilimumab)在黑色素瘤、非小细胞肺癌中的客观缓解率(ORR)达30%-45%;CAR-T在CD19+ B细胞淋巴瘤、BCMA+多发性骨髓瘤中的ORR达70%-83%;T细胞衔接器(如blinatumomab)在急性淋巴细胞白血病中的ORR达70%。
现有研究的局限性
- 实体瘤中T细胞浸润不足的机制未完全阐明,缺乏有效增强T细胞浸润的策略;
- 肿瘤抗原异质性导致CAR-T易出现“抗原逃逸”(如CD19阴性复发);
- ICIs的耐药机制(如T细胞耗竭不可逆)尚未解析,仅20%-30%患者响应;
- 非传统T细胞(如γδ T细胞)的肿瘤特异性与安全性需进一步验证。
文献的创新价值
本文的核心贡献在于首次系统连接T细胞基础生物学与临床治疗:通过整合T细胞亚群功能、肿瘤微环境调控的机制,为现有疗法的局限性提供解决方案——如针对实体瘤T细胞浸润不足,提出“放疗联合免疫治疗”(增加肿瘤抗原释放、改善微环境);针对抗原逃逸,开发“逻辑门CAR-T”(需同时识别两个抗原);针对T细胞耗竭,探索“代谢重编程”(抑制mTOR通路改善T细胞代谢)。
3. 研究思路总结与详细解析
3.1 整体框架
- 研究目标:解析T细胞在肿瘤中的机制作用,总结现有T细胞疗法的优势与挑战,提出下一代治疗策略;
- 核心科学问题:T细胞亚群如何调控肿瘤进展?肿瘤微环境如何导致T细胞功能障碍?如何优化T细胞疗法的实体瘤疗效?
- 技术路线:“机制解析(T细胞发育/亚群/分子通路)→治疗进展(ICIs、CAR-T的临床数据)→未来方向(通用CAR-T、合成生物学)”。
3.2 机制解析:T细胞在肿瘤中的作用
3.2.1 T细胞发育与分化
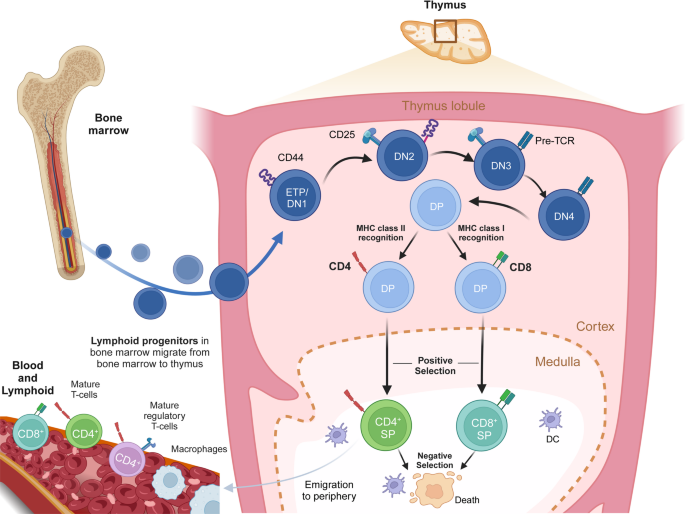
T细胞起源于骨髓造血干细胞,迁移至胸腺经历“双阴性(DN)→双阳性(DP)→单阳性(SP)”成熟过程——通过阳性选择(识别自身MHC分子)保留功能性T细胞,阴性选择(清除自身反应性T细胞)建立中枢耐受。成熟T细胞分为naive T细胞、效应T细胞、记忆T细胞,依赖IL-7、T-bet、GATA3等细胞因子与转录因子调控(图1为T细胞胸腺发育示意图)。
3.2.2 T细胞亚群的肿瘤功能
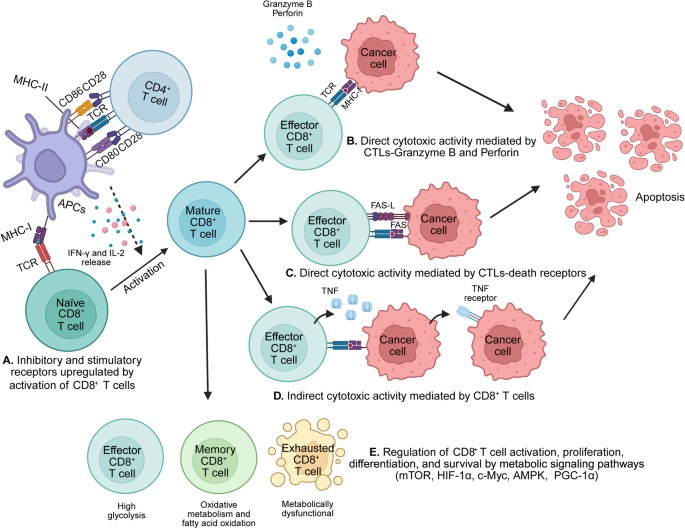
- 细胞毒性CD8+ T细胞:通过两种途径杀伤肿瘤细胞——①直接 cytotoxicity(穿孔素形成细胞膜孔,颗粒酶B进入细胞诱导凋亡;FasL与肿瘤细胞Fas结合激活 caspase通路);②间接作用(分泌IFN-γ抑制肿瘤增殖、TNF-α诱导肿瘤细胞凋亡)(图3为CD8+ T细胞杀伤机制)。但肿瘤微环境中的慢性抗原刺激会导致CD8+ T细胞表达PD-1、TIM-3等抑制性受体,进入“耗竭状态”(细胞因子分泌减少、增殖能力丧失)。
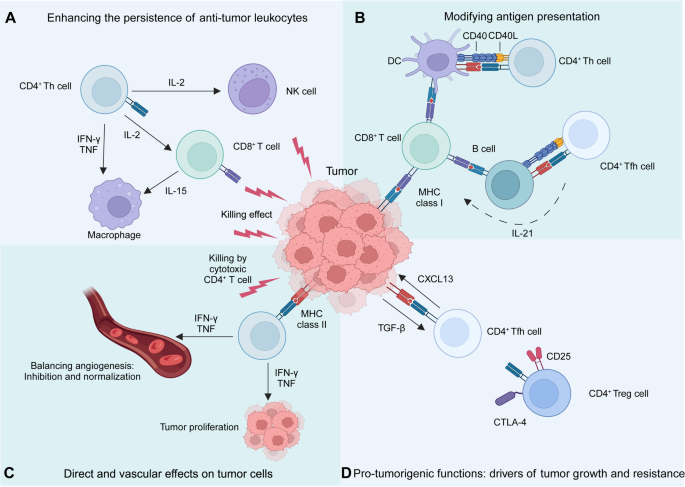
- 辅助CD4+ T细胞:分为Th1、Th2、Th17、Tfh亚群——Th1分泌IFN-γ增强CD8+ T细胞功能,Tfh辅助B细胞产生抗肿瘤抗体;但Th2分泌IL-4促进肿瘤转移,Treg通过高表达CD25消耗IL-2、表达CTLA-4抑制抗原呈递细胞(APC)功能(图4为CD4+ T细胞肿瘤作用)。
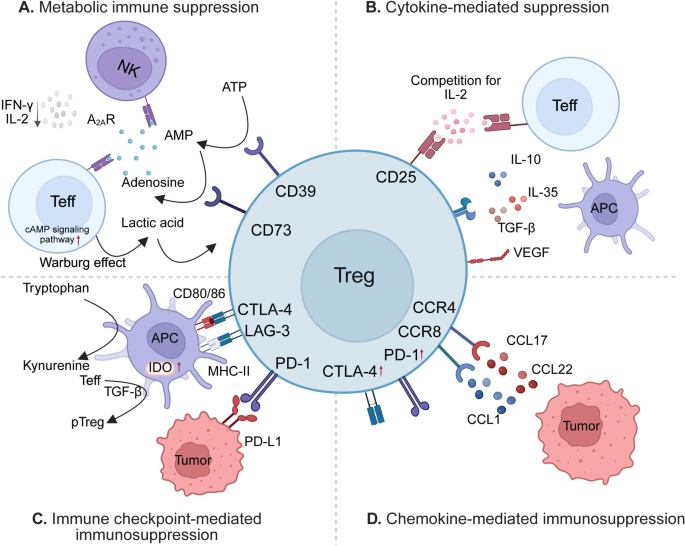
- 调节性T细胞(Treg):是肿瘤免疫逃逸的核心介导者,通过趋化因子CCL22/CCR4通路招募至肿瘤微环境,分泌TGF-β、IL-10抑制效应T细胞,高表达CTLA-4降低APC的CD80/CD86共刺激分子表达(图5为Treg免疫抑制机制)。
3.2.3 分子通路调控
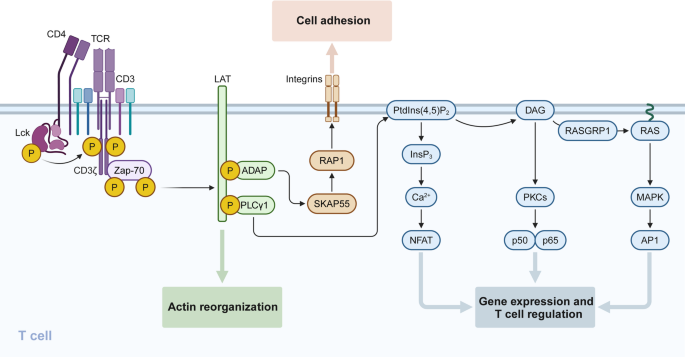
T细胞功能受TCR信号通路(Lck→ZAP-70→LAT→PLCγ1→Ca²+/NFAT、MAPK、NF-κB)与共刺激/共抑制分子(CD28/CTLA-4、PD-1/PD-L1)共同调控:CD28通过激活PI3K/AKT通路促进T细胞增殖,而PD-1通过抑制该通路导致T细胞功能障碍;mTOR通路通过代谢重编程影响T细胞分化(mTORC1促进Th1/Th17分化,mTORC2促进Th2/Treg分化)(图6为TCR信号网络)。
3.3 临床治疗进展
3.3.1 免疫检查点抑制剂(ICIs)
- 疗效:pembrolizumab在PD-L1阳性非小细胞肺癌中的ORR为45%,ipilimumab在黑色素瘤中的5年生存率达20%;
- 局限性:仅20%-30%患者响应,耐药机制包括T细胞耗竭不可逆、肿瘤细胞PD-L1低表达;
- 优化策略:联合CTLA-4抑制剂(如nivolumab+ipilimumab)可将黑色素瘤ORR提升至50%。
3.3.2 CAR-T细胞疗法
- 疗效:axicabtagene ciloleucel在大B细胞淋巴瘤中的ORR为83%,idecabtagene vicleucel在多发性骨髓瘤中的ORR为73%;
- 局限性:实体瘤疗效有限(胶质母细胞瘤ORR<10%)、抗原逃逸(CD19阴性复发)、制备时间长(2-3周);
- 优化策略:通用CAR-T(CRISPR编辑敲除TCR/MHC I,避免GVHD)、双靶点CAR(如CD19+CD22)减少抗原逃逸。
3.3.3 新兴技术
- 合成生物学修饰:合成Notch受体(SynNotch)——T细胞需识别肿瘤抗原A激活Notch,再识别抗原B才会杀伤,提高肿瘤特异性;
- 代谢重编程:抑制mTOR通路(如rapamycin)改善T细胞代谢,增强实体瘤浸润;
- 组合疗法:放疗联合CAR-T(放疗增加肿瘤抗原释放,改善T细胞浸润)、ICIs联合双特异性抗体(覆盖更多抗原)。
4. Biomarker研究及发现成果解析
4.1 Biomarker定位与筛选逻辑
本文涉及的Biomarker分为三类:T细胞亚群标志物(CD8+ T细胞的穿孔素/颗粒酶、Treg的FoxP3)、免疫检查点分子(PD-1/PD-L1、CTLA-4)、肿瘤微环境标志物(TGF-β、IL-10、乳酸)。筛选逻辑基于:
1. 临床样本关联:FoxP3+ Treg浸润与乳腺癌、结肠癌不良预后相关(HR=2.1,95% CI 1.5-2.9,P<0.001);
2. 细胞/动物模型验证:PD-1敲除小鼠的CD8+ T细胞杀伤能力提升2倍(n=5,P<0.01);
3. 治疗响应预测:PD-L1阳性患者接受ICIs的ORR(45%)显著高于阴性患者(15%)(n=305,P<0.001)。
4.2 研究过程与核心成果
4.2.1 T细胞亚群标志物
- CD8+ T细胞浸润:肿瘤组织中CD8+ T细胞比例≥10%的黑色素瘤患者5年生存率为40%,显著高于<10%的患者(10%)(n=200,P<0.01);
- FoxP3+ Treg浸润:FoxP3+ Treg比例>5%的结肠癌患者无进展生存期(PFS)为6个月,显著短于<5%的患者(12个月)(n=150,P<0.05)。
4.2.2 免疫检查点标志物
- PD-L1表达:PD-L1阳性(≥1%)非小细胞肺癌患者接受pembrolizumab的ORR为45%,阴性患者为15%(AUC=0.75,敏感性70%,特异性75%);
- CTLA-4表达:CTLA-4高表达的黑色素瘤患者接受ipilimumab的ORR为30%,显著高于低表达患者(10%)(n=100,P<0.05)。
4.2.3 肿瘤微环境标志物
- TGF-β水平:血清TGF-β≥10ng/mL的结直肠癌患者接受ICIs的ORR为10%,显著低于<10ng/mL的患者(30%)(n=150,P<0.05);
- 乳酸水平:肿瘤组织乳酸≥5mmol/L的患者CD8+ T细胞浸润率为10%,显著低于<5mmol/L的患者(30%)(n=80,P<0.01)。
4.3 创新性与临床价值
- 预后预测:FoxP3+ Treg、PD-L1可作为肿瘤不良预后的独立预测因子;
- 治疗选择:PD-L1阳性患者优先选择ICIs,CD8+ T细胞浸润充足的实体瘤患者优先选择CAR-T;
- 新型Biomarker:非传统T细胞的Vγ9Vδ2受体、MAIT细胞的MR1可作为“现成”疗法的筛选标志物(文献未明确临床数据,基于动物模型推测)。
总结
本文通过系统整合T细胞在肿瘤中的机制作用与治疗进展,为解决现有疗法的局限性提供了清晰的方向——从“通用CAR-T”到“合成生物学修饰”,从“组合疗法”到“代谢重编程”。未来,基于T细胞亚群标志物、肿瘤微环境特征的个性化治疗,将成为T细胞导向疗法的核心趋势。
