1. 领域背景与文献引入
文献英文标题:Extracellular vesicle-based liquid biopsy biomarkers and their application in precision immuno-oncology;发表期刊:Biomarker Research;影响因子:5.8(2022年);研究领域:肿瘤免疫学、液体活检、细胞外囊泡(EVs)。
肿瘤免疫治疗(如免疫检查点抑制剂,ICI)已成为多种癌症的标准治疗,但原发性/适应性耐药仍是临床挑战——约60%患者对ICI无响应,响应者中约30%会出现获得性耐药。耐药的核心原因是肿瘤微环境(TME)的动态异质性:肿瘤细胞通过与基质细胞、免疫细胞的通讯重塑TME,诱导免疫逃逸。传统组织活检因侵入性、静态性无法实时反映TME变化,而液体活检(如循环肿瘤DNA、循环肿瘤细胞)因微创、实时的优势成为研究热点。其中,细胞外囊泡(EVs)作为细胞间通讯的关键介质,携带 parental细胞的蛋白质、RNA、代谢物等“ cargo ”,能全面反映TME的动态变化,是极具潜力的液体活检生物标志物。
尽管EVs的研究已取得进展,但仍存在分离与分析标准化不足、TME调控机制未完全阐明、临床转化证据分散等问题。本综述系统总结了EVs的生物学特性、分离分析技术、TME中的免疫调控机制,以及作为ICI响应生物标志物的临床证据,为EVs在精准免疫肿瘤学中的应用提供了全景式框架。
2. 文献综述解析
作者以“EVs从基础到临床的转化”为核心逻辑,将现有研究分为四大模块:EVs的生物学特性(亚型、生物发生、 cargo)、分离与分析技术、TME中的免疫调控机制、作为ICI生物标志物的临床研究。
2.1 现有研究的关键结论与局限
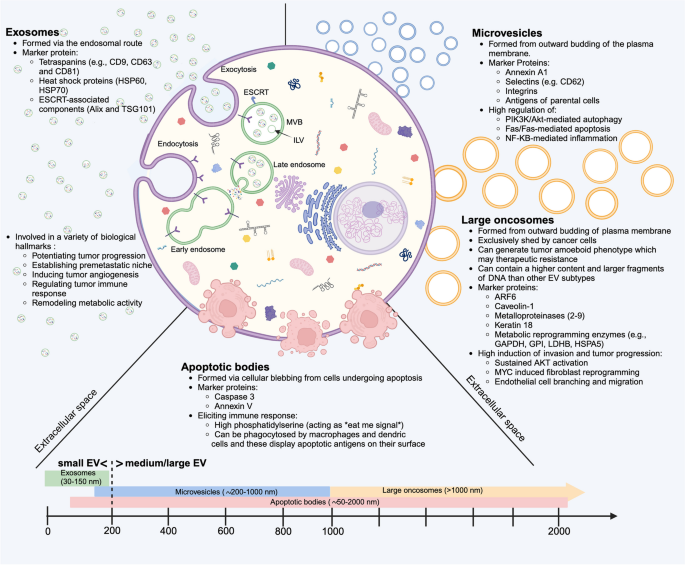
- EVs的生物学特性:EVs包括外泌体(30-150nm,内体途径,标志物CD9/CD63/CD81)、微囊泡(200-1000nm,质膜出芽,标志物Annexin V)、凋亡小体(50-2000nm,凋亡细胞碎片,标志物PS)、大肿瘤小体(>1000nm,癌细胞特有的,标志物TGF-β)。不同亚型的cargo和功能差异显著,如外泌体主要传递miRNAs调控基因表达,大肿瘤小体传递DNA反映肿瘤基因组特征。
- 分离与分析技术:传统方法(超速离心、尺寸排阻色谱)存在纯度低、EVs损伤的问题;新型技术(微流控、磁珠免疫捕获)通过靶向EVs表面标志物(如CD63、EpCAM)提高了分离效率(如微流控芯片捕获效率>90%)。分析技术方面,single EV分析(纳米流式细胞术)解决了EVs异质性问题,多组学整合(蛋白质组+转录组+机器学习)能挖掘高特异性生物标志物签名(如NSCLC中miR-200c-3p+miR-21-5p+miR-28-5p组合预测ICI响应的AUC=0.85)。
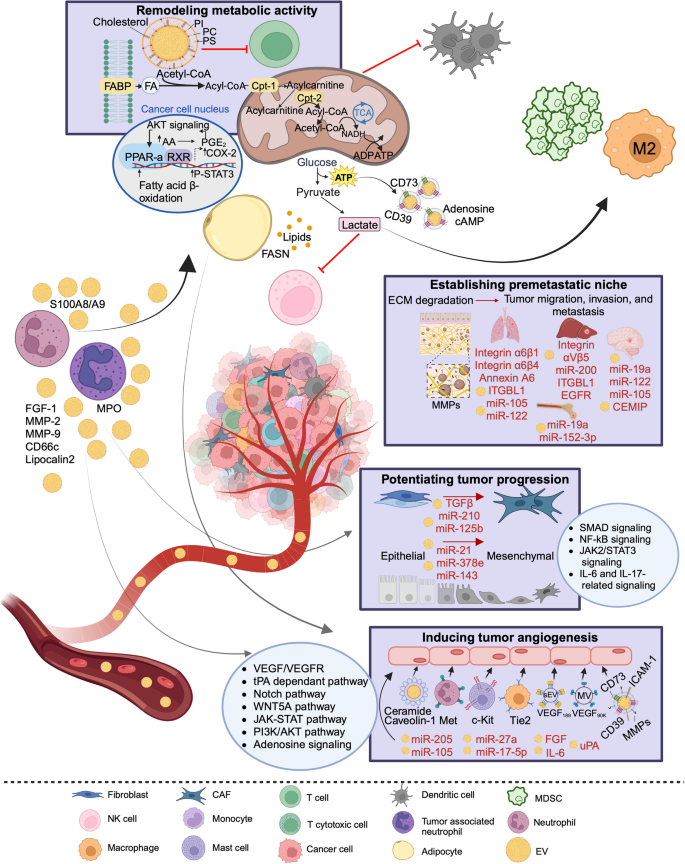
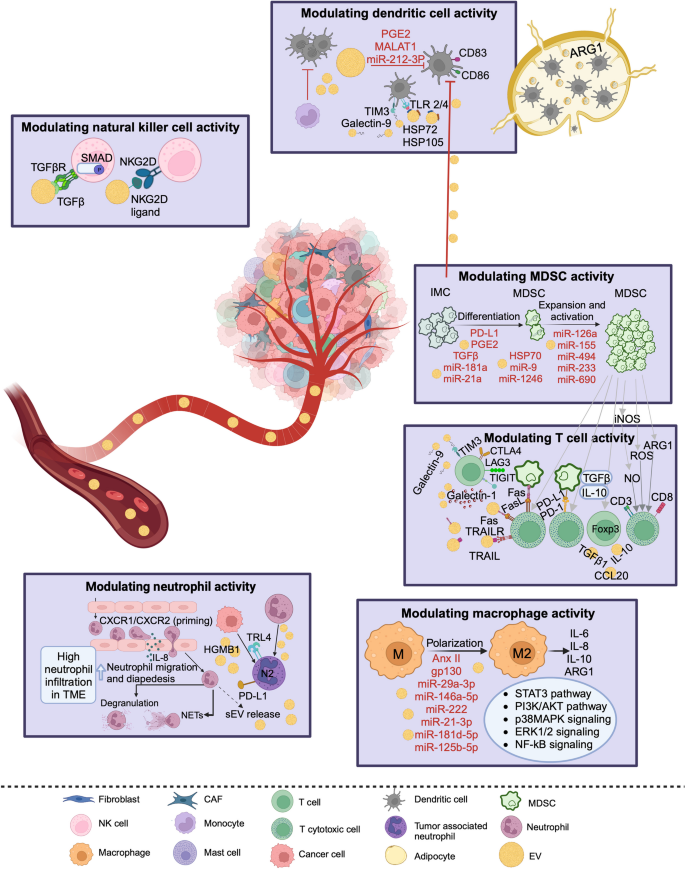
- TME中的免疫调控:EVs通过传递cargo调控免疫细胞功能:① 诱导巨噬细胞M2极化(如肿瘤来源EVs的miR-21激活STAT3通路);② 扩张髓源性抑制细胞(MDSCs,通过PD-L1、TGF-β);③ 抑制T细胞增殖(通过PD-L1直接结合T细胞PD-1);④ 下调NK细胞活性(通过NKG2D配体)。这些机制共同诱导免疫逃逸,促进肿瘤进展。
- 临床研究证据:EVs-PD-L1、miRNAs等生物标志物的动态变化与ICI响应密切相关:NSCLC患者治疗后EVs-PD-L1下降≥50%的客观缓解率(ORR)为60%,而无下降者仅20%;黑色素瘤患者基线EVs-PD-L1>100pg/mL的无进展生存期(PFS)更短(中位数3.5个月vs 12个月)。
现有研究的局限:① EVs分离与分析的标准化不足,不同研究结果可比性差;② single EV分析技术仍在发展,无法解析所有亚型的功能;③ 临床研究样本量小(多为单中心、n<100),缺乏多中心验证。
2.2 本综述的创新价值
本综述的核心创新在于“系统整合基础研究与临床证据”:① 首次从“精准免疫肿瘤学”视角,梳理EVs从生物学特性到临床应用的全链条;② 强调多组学结合机器学习在生物标志物发现中的作用(如通过机器学习整合EVs蛋白质组与转录组数据,筛选出预测ICI响应的miRNAs组合);③ 聚焦EVs的动态变化(如治疗前后EVs-PD-L1的波动),为临床实时监测提供依据。
3. 研究思路总结与详细解析
本综述以“EVs的基础研究→技术进展→机制研究→临床应用”为闭环逻辑,分四部分展开:
3.1 EVs的生物学特性解析
- 实验目的:阐明EVs的亚型、生物发生及cargo功能。
- 方法细节:基于国际细胞外囊泡学会(ISEV)的分类标准,综述了外泌体(内体途径:早期内体→多泡体→外泌体释放)、微囊泡(质膜出芽)、凋亡小体(凋亡细胞碎片)、大肿瘤小体(癌细胞特有的质膜出芽)的生物发生过程,以及各亚型的标志性蛋白质(如外泌体的tetraspanins家族、微囊泡的Annexin V)。
- 结果解读:不同EVs亚型的cargo和功能差异显著:① 外泌体富含miRNAs(如miR-21、miR-146a),主要调控基因表达;② 微囊泡携带蛋白质(如TGF-β),调控细胞信号通路;③ 大肿瘤小体携带DNA(如突变的KRAS),反映肿瘤基因组特征。
- 产品关联:文献提及外泌体分离常用ExoQuick(聚合物沉淀),微流控芯片(如ExoChip)用于高纯度分离。
3.2 EVs分离与分析技术的进展
- 实验目的:比较传统与新型技术的优缺点,推动技术标准化。
- 方法细节:① 分离技术:传统方法(超速离心)产量低(<30%)、易污染;新型方法(微流控、磁珠免疫捕获)通过靶向EVs表面标志物提高纯度(如磁珠捕获CD63+外泌体的纯度>95%)。② 分析技术:single EV分析(纳米流式细胞术,NanoFCM)能解析EVs的异质性(如不同亚型的蛋白质表达差异);多组学整合(蛋白质组+转录组)结合机器学习(如随机森林算法)能挖掘生物标志物签名。
- 结果解读:新型技术解决了传统方法的局限,如微流控芯片的分离时间从24小时缩短至1小时,且EVs完整性保留率>90%;single EV分析发现,NSCLC患者的外泌体中CD63+CD9+亚型占比(35%)显著高于健康人(15%),该亚型与ICI耐药相关。
- 产品关联:提到的分析技术包括NanoFCM(纳米流式细胞术)、Olink proximity extension assay(PEA,多蛋白检测)。
3.3 EVs在TME中的免疫调控机制
- 实验目的:阐明EVs如何介导TME中的细胞间通讯,诱导免疫逃逸。
- 方法细节:综述了EVs对不同免疫细胞的调控:① 巨噬细胞:肿瘤来源EVs的miR-21激活STAT3通路,诱导M2极化,分泌IL-10抑制T细胞;② MDSCs:EVs-PD-L1结合MDSCs的PD-1,诱导其扩张并分泌ARG1消耗L-精氨酸,抑制T细胞增殖;③ T细胞:EVs-PD-L1直接结合T细胞的PD-1,抑制其分泌IFN-γ和颗粒酶B;④ NK细胞:EVs携带的NKG2D配体下调NK细胞的NKG2D受体,降低细胞毒性。
- 结果解读:EVs通过“多免疫细胞调控网络”重塑TME:M2巨噬细胞与MDSCs协同抑制T细胞,NK细胞活性下降进一步削弱抗肿瘤免疫,最终诱导ICI耐药。例如,黑色素瘤患者的EVs-miR-125b能诱导Treg分化,Treg占比>10%的患者对ICI无响应。
- 产品关联:实验模型包括小鼠黑色素瘤B16异种移植模型(验证EVs对巨噬细胞的调控)、人外周血T细胞与癌细胞共培养模型(验证EVs-PD-L1对T细胞的抑制)。
3.4 EVs作为ICI生物标志物的临床研究
- 实验目的:总结EVs生物标志物与ICI响应的临床相关性。
- 方法细节:重点分析了NSCLC和黑色素瘤的临床研究:① NSCLC:治疗前EVs-miR-200c-3p/miR-21-5p高表达与耐药相关(ORR=15%),治疗后EVs-PD-L1下降≥50%的患者ORR=60%;② 黑色素瘤:基线EVs-PD-L1>100pg/mL的患者PFS更短(中位数3.5个月vs 12个月),治疗后EVs-PD-L1升高与响应相关(可能与T细胞再激活有关);③ EVs-CD73:黑色素瘤患者中,EVs-CD73高表达与ICI耐药相关(通过产生腺苷抑制T细胞)。
- 结果解读:EVs生物标志物的动态变化比静态指标(如组织PD-L1 IHC)更能反映TME的免疫状态。例如,NSCLC患者中,EVs-miRNAs组合(miR-200c-3p+miR-21-5p+miR-28-5p)预测ICI响应的AUC=0.85,显著高于组织PD-L1 IHC的AUC=0.72。
- 产品关联:临床检测常用ELISA(EVs-PD-L1)、qPCR(EVs-miRNAs)、流式细胞术(EVs-CD73)。
4. Biomarker研究及发现成果解析
4.1 Biomarker定位与筛选逻辑
本综述涉及的Biomarker主要为EVs携带的蛋白质、RNA,包括:
- 蛋白质:PD-L1(免疫检查点分子)、CD73(腺苷代谢酶);
- RNA:miR-200c-3p、miR-21-5p、miR-28-5p(调控免疫细胞功能的miRNAs)、PD-L1 mRNA。
筛选/验证逻辑:① 从临床样本(血浆/血清)中分离EVs;② 通过组学技术(蛋白质组学、转录组学)筛选差异表达的cargo;③ 功能实验验证其调控免疫细胞的机制(如EVs-PD-L1抑制T细胞增殖);④ 临床队列验证与ICI响应的相关性(如NSCLC患者的队列研究,n=100)。
4.2 研究过程与核心成果
- EVs-PD-L1:① 来源:血浆EVs;② 验证方法:ELISA定量检测;③ 临床数据:NSCLC患者治疗后EVs-PD-L1下降≥50%的ORR=60%(n=80,P<0.01),黑色素瘤患者基线EVs-PD-L1>100pg/mL的PFS中位数=3.5个月(n=60,P<0.05);④ 功能关联:EVs-PD-L1直接结合T细胞的PD-1,抑制其功能,是ICI耐药的关键介质。
- EVs-miRNAs组合:① 来源:血浆EVs;② 验证方法:qPCR检测;③ 临床数据:miR-200c-3p+miR-21-5p+miR-28-5p组合预测NSCLC患者ICI响应的AUC=0.85(95% CI 0.78-0.92),敏感性82%,特异性80%(n=100);④ 功能关联:这些miRNAs通过调控STAT3、JAK2通路,诱导巨噬细胞M2极化和MDSCs扩张。
- EVs-CD73:① 来源:血清EVs;② 验证方法:流式细胞术;③ 临床数据:黑色素瘤患者中,EVs-CD73高表达与ICI耐药相关(ORR=10% vs 50%,n=50,P<0.05);④ 功能关联:CD73催化AMP生成腺苷,抑制T细胞增殖。
4.3 创新性与临床价值
本综述的Biomarker研究突破了传统静态标志物的局限,强调动态变化的临床价值(如治疗前后EVs-PD-L1的波动),为临床实时监测ICI响应提供了依据。其中,EVs-miRNAs组合的预测准确性(AUC=0.85)显著高于组织PD-L1 IHC(AUC=0.72),有望成为临床实用的生物标志物。
总结
本综述系统总结了EVs在精准免疫肿瘤学中的应用,从基础研究(生物学特性、TME机制)到技术进展(分离分析),再到临床证据(ICI响应生物标志物),为EVs的临床转化提供了清晰框架。未来需要解决技术标准化、大样本多中心验证等问题,推动EVs成为精准免疫肿瘤学的“新一代液体活检生物标志物”。