1. 领域背景与文献引入
文献英文标题:Development and validation of a short-term breast health measure as a supplement to screening mammography;发表期刊:Biomarker Research;影响因子:未公开;研究领域:乳腺肿瘤学(乳腺癌筛查与生物标志物研究)。
乳腺癌是女性最常见的恶性肿瘤,占全球女性癌症诊断的31%,2022年美国预计有43250人死于乳腺癌。早期检测是降低乳腺癌死亡率的核心策略——筛查性乳房X线摄影自20世纪80年代引入后,使乳腺癌死亡率降低了20%,但仍存在显著局限性:其一,“间隔癌”(筛查阴性但后续短期内确诊的癌症)发生率未降低,假阳性率高导致不必要的随访;其二,年轻女性(<50岁)筛查依从性低(仅31%-70%),而该群体乳腺癌诊断更具侵袭性、死亡率更高;其三,乳腺密度(如BI-RADS 4类“极度致密”)会掩盖肿瘤,显著降低筛查灵敏度。
现有研究聚焦于开发非侵入性、易获取的生物标志物以补充筛查,但传统生物流体(如血液)存在样本采集不便、标志物浓度低等问题。泪液作为富含 proteomic 和 genomic 信息的动态生物流体,具有样本易收集、处理简单、标志物浓度高的优势,前期小规模研究发现泪液中的S100A8、S100A9、半乳糖凝集素-3结合蛋白(LG3BP)与乳腺癌相关,但未在大样本中验证,也未构建整合临床协变量的评估模型。
本研究旨在填补这一空白:通过大样本泪液样本,整合蛋白标志物与临床变量(年龄、乳腺密度等)构建短期乳腺健康评估工具,作为筛查性乳房X线摄影的补充,解决现有筛查的局限性(如年轻女性依从性低、乳腺密度影响准确性),为乳腺癌早期检测提供新途径。
2. 文献综述解析
文献综述以“现有筛查的局限性→泪液生物流体的潜力→前期标志物研究基础”为核心逻辑,系统评述领域研究现状。
现有研究关键结论:① 筛查性乳房X线摄影是降低乳腺癌死亡率的核心手段,但存在间隔癌、假阳性、依从性差异等问题;② 泪液作为非侵入性生物流体,可反映全身疾病的系统性影响,其蛋白谱具有疾病诊断潜力;③ 前期研究证实S100A8、S100A9(在乳腺癌血清/组织中升高,与BRAC1突变、转移相关)、LG3BP(与转移和生存不良相关)是潜在乳腺癌标志物,但样本量小(未超过200例),未整合临床协变量。
现有研究优势:泪液样本采集无创、易操作,无需专业设备;局限性:前期研究未验证标志物在大样本中的有效性,也未构建可用于临床的评估模型。
本研究创新价值:① 首次采用大样本(847例)临床泪液样本,验证前期发现的蛋白标志物;② 整合蛋白浓度与临床协变量(年龄、乳腺密度等),构建3种逻辑回归模型,系统评估其区分乳腺癌与健康/召回人群的性能;③ 提出“短期乳腺健康评估工具”的概念,直接关联临床应用(补充筛查性乳房X线摄影),解决现有筛查的实际问题。
3. 研究思路总结与详细解析
3.1 研究人群招募与样本收集
实验目的:获取覆盖乳腺健康 continuum(健康、召回、乳腺癌)的人群样本,为后续标志物检测和模型构建提供基础。
方法细节:经阿肯色大学伦理委员会批准(IRB#13-11-289),2017年10月至2019年6月从阿肯色州2家乳腺中心招募18岁以上女性,采用便利抽样法,纳入标准覆盖“筛查无异常”“筛查召回但无活检”“病理确诊乳腺癌”三类人群;通过Schirmer滤纸条法收集泪液样本,同时记录临床协变量(年龄、BMI、乳腺密度、激素治疗史、肿瘤家族史等)。
结果解读:共纳入847例样本,分为2个队列:队列1(391例,含87例乳腺癌、204例健康、100例召回)、队列2(456例,含21例乳腺癌、121例良性活检、86例BI-RADS 3);样本年龄分布22-84岁(平均55.81岁),涵盖浸润性导管癌(IDC)、导管原位癌(DCIS)等亚型。
实验所用关键产品:泪液蛋白检测采用R&D Systems的DuoSets ELISA试剂盒(检测S100A8、S100A9、LG3BP)。
3.2 泪液蛋白浓度检测与数据预处理
实验目的:定量检测泪液中目标蛋白浓度,处理非正态分布数据以满足统计分析要求。
方法细节:采用标准夹心ELISA技术检测S100A8、S100A9、LG3BP浓度;因3种蛋白浓度均呈非正态分布,将浓度转换为对数(log)值;对于浓度低于检测下限(0 pg/ml)的样本,重新编码为1 pg/ml(避免log计算时出现缺失值)。
结果解读:成功获取847例样本的蛋白浓度数据,处理后的数据符合逻辑回归分析的正态性要求。
3.3 逻辑回归模型构建与验证
实验目的:整合蛋白标志物与临床协变量,构建区分乳腺癌与对照人群的评估模型,并评估其性能。
方法细节:① 协变量筛选:从28个初始协变量(3种蛋白+年龄、BMI、乳腺密度、激素治疗史等)中,排除共线性变量(如“家族癌症史”与“家族乳腺癌史”),保留11个潜在协变量;② 模型构建:采用向前逐步逻辑回归,构建3种模型——Model 1(健康vs乳腺癌)、Model 2(召回vs乳腺癌)、Model 3(健康+召回vs乳腺癌);③ 性能评估:通过受试者工作特征曲线(ROC)计算曲线下面积(AUC),评估模型区分能力;设置2种诊断阈值(场景1:平衡灵敏度与特异度;场景2:优先灵敏度),计算灵敏度(真阳性率)与特异度(真阴性率)。
结果解读:
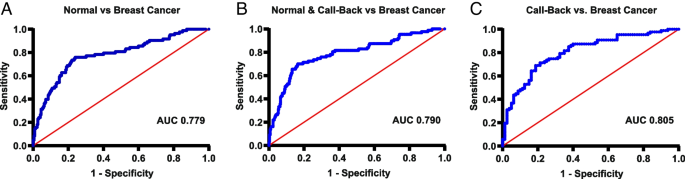
- Model 1(纳入S100A8、S100A9、乳腺密度):AUC=0.779,场景1(cut-off=-0.8565)灵敏度76%、特异度76%;
- Model 2(纳入S100A8、S100A9、年龄):AUC=0.805,场景1(cut-off=0.2018)灵敏度70%、特异度81%;
- Model 3(仅纳入S100A8、S100A9):AUC=0.790,场景1(cut-off=-0.9487)灵敏度70%、特异度84%;场景2(优先灵敏度,cut-off=-2.3226)灵敏度86%、特异度38%。
进一步将模型应用于“以筛查为入口的乳腺健康 continuum”人群(即因筛查进入流程的女性),Model 3场景1的准确率达76%(灵敏度59%、特异度79%),显示其作为“预筛查工具”的潜力。
4. Biomarker 研究及发现成果解析
Biomarker 定位
本研究涉及的Biomarker为泪液中的蛋白标志物(S100A8、S100A9、LG3BP),筛选/验证逻辑为“前期小样本发现→大样本泪液ELISA检测→整合临床协变量的逻辑回归验证→ROC曲线性能评估”,形成完整的“发现-验证-应用”链条。
研究过程详述
Biomarker来源:临床泪液样本(通过Schirmer滤纸条法收集,无创、易操作);
验证方法:① 定量检测:ELISA技术检测蛋白浓度;② 模型整合:向前逐步逻辑回归整合蛋白浓度与临床协变量;③ 性能评估:ROC曲线计算AUC、灵敏度、特异度;
特异性与敏感性数据:Model 3(S100A8+S100A9)场景1(平衡阈值)的AUC=0.790(95% CI 未明确),灵敏度70%、特异度84%(n=847);场景2(优先灵敏度)的灵敏度86%、特异度38%(n=847);应用于“筛查入口人群”时,Model 3场景1的特异度达79%(健康人群)、79%(召回人群)。
核心成果提炼
- 功能关联:S100A8、S100A9与乳腺癌诊断显著相关(模型中系数为正,即浓度越高,乳腺癌诊断可能性越大);Model 3(仅S100A8+S100A9)可有效区分乳腺癌与健康/召回人群(AUC=0.790),提示这两个蛋白是泪液中最核心的乳腺癌生物标志物。
- 创新性:① 首次在大样本(847例)中验证泪液S100A8、S100A9作为乳腺癌标志物的有效性;② 构建整合临床协变量的评估模型,解决了“仅靠蛋白浓度无法区分召回与乳腺癌”的问题(Model 2纳入年龄后,AUC提升至0.805);③ 提出“短期乳腺健康评估工具”的概念,直接关联临床应用(补充筛查性乳房X线摄影)。
- 临床价值:场景1(平衡阈值)适用于“常规预筛查”(灵敏度70%、特异度84%,减少假阳性);场景2(优先灵敏度)适用于“高风险人群筛查”(灵敏度86%,降低假阴性);Model 3应用于筛查入口人群的准确率达76%,可作为年轻女性、高乳腺密度人群的补充筛查工具。
本研究证实泪液中的S100A8、S100A9是有效的乳腺癌生物标志物,整合它们的评估模型可作为筛查性乳房X线摄影的补充,为乳腺癌早期检测提供了无创、便捷的新方法。未来需进一步扩大样本量(纳入不同种族、地域人群),并结合机器学习优化模型,提升特异度(当前场景2特异度较低),推动其临床转化。
