1. 领域背景与文献引入
文献英文标题:Co-expression and clinical utility of AR-FL and AR splice variants AR-V3, AR-V7 and AR-V9 in prostate cancer;发表期刊:Biomarker Research;影响因子:未公开;研究领域:前列腺癌生物标志物。
前列腺癌是男性最常见的恶性肿瘤之一,雄激素受体(AR)是其发生发展的核心驱动因子。随着阿比特龙、恩扎卢胺等新型AR靶向药物(ARTA)的应用,转移性去势抵抗性前列腺癌(mCRPC)患者的生存期显著延长,但仍有20%~40%的患者对ARTA无响应,且缺乏有效的生物标志物预测治疗结局。AR剪接变体(AR-Vs)因缺乏配体结合域(LBD)、可 constitutively激活AR信号通路,被认为是ARTA耐药的关键机制之一。然而,现有研究对AR-Vs的临床价值存在争议:部分研究发现AR-V7阳性患者对ARTA无响应,另一部分研究则观察到此类患者仍有显著临床获益。此外,AR全长(AR-FL)与AR-Vs均源于同一AR前体mRNA(pre-mRNA),但两者的表达依赖关系及在不同疾病阶段的动态变化尚未完全阐明。
针对上述空白,本研究聚焦以下核心问题:①AR-FL与AR-V3、AR-V7、AR-V9的表达是否依赖AR pre-mRNA水平?②不同疾病阶段(原发、转移、mCRPC)中,AR-FL与AR-Vs的表达特征如何?③AR-FL与AR-Vs对mCRPC患者ARTA治疗的预测及预后价值如何?研究结果为理解AR-FL与AR-Vs的生物学关系及临床应用提供了关键证据。
2. 文献综述解析
现有研究围绕AR-Vs作为前列腺癌生物标志物展开,但存在三大局限:其一,多数研究仅关注单一AR-V(如AR-V7),未综合分析多种AR-Vs的协同作用;其二,对AR-FL与AR-Vs的表达依赖关系研究不足,缺乏细胞系与临床样本的联合验证;其三,临床队列样本量小,且未区分不同疾病阶段的表达差异。例如,部分研究仅在小样本mCRPC患者中分析AR-V7的预测价值,未纳入原发或转移组织样本;另有研究未考虑AR-FL水平对AR-Vs的影响,导致结果解读偏差。
本研究的创新点在于:①首次在细胞系与临床样本中系统验证AR-FL与AR-Vs的表达依赖关系——AR pre-mRNA水平升高时,AR-FL与AR-Vs的表达均显著增加;②综合分析AR-V3、AR-V7、AR-V9三种变体在原发肿瘤、转移组织及循环肿瘤细胞(CTC)中的表达特征,揭示疾病进展中两者的动态变化;③利用大样本mCRPC队列(n=65),明确AR-FL与AR-Vs的预后价值(AR-FL水平高提示总生存期短),但否定其预测价值(AR-Vs阳性患者仍对ARTA有响应)。
3. 研究思路总结与详细解析
3.1 细胞系中AR-FL与AR-Vs的表达依赖关系验证
实验目的:探究AR pre-mRNA水平升高对AR-FL与AR-Vs表达的影响。
方法细节:选取5种前列腺(癌)细胞系(健康上皮细胞RWPE-1、激素敏感型LNCaP、去势抵抗型22Rv1、神经内分泌分化型PC-3)及非前列腺细胞HEK293-T,通过两种方式升高AR pre-mRNA:①恩扎卢胺处理(10μM,最长14天);②CRISPR/dCas9系统激活AR基因(转染AR启动子特异性gRNA或对照质粒)。提取总RNA后,用实时荧光定量PCR(qPCR)检测AR-FL(TaqMan assay:Hs00171172_m1)与AR-V3、V7、V9(定制TaqMan assay)的表达水平,以RPL37A和HPRT1为内参基因。
结果解读:恩扎卢胺处理后,LNCaP细胞的AR-FL水平显著升高(P<0.0001),同时AR-V3表达增加(P<0.001),AR-V7、V9轻微升高;22Rv1细胞(ARTA耐药)的AR-FL与AR-Vs无显著变化。CRISPR激活AR后,HEK293-T细胞的AR-FL水平升高,AR-V7、V9出现或增加(P<0.05);PC-3与RWPE-1细胞(原本AR阴性)中,AR-FL与AR-Vs均首次检测到表达。结果表明,AR pre-mRNA水平是AR-FL与AR-Vs表达的共同驱动因素。
产品关联:实验所用关键产品包括Qiagen的RNeasy Mini Kit(RNA提取)、Takara的Primescript Reverse Transcription Kit(反转录)、Thermo Fisher的TaqMan PCR assay(基因检测)、Luna Mastermix(qPCR反应)及QuantStudio 3 qPCR仪(检测平台)。
3.2 临床组织样本中AR-FL与AR-Vs的表达分析
实验目的:分析原发与转移前列腺癌组织中AR-FL与AR-Vs的表达特征。
方法细节:收集10例原发前列腺癌组织与20例转移组织(淋巴结或骨转移),提取RNA后用qPCR检测AR-FL与AR-Vs的表达,以KLK3-PSA(前列腺特异性抗原)确认肿瘤细胞存在。
结果解读:AR-FL在所有组织样本中均阳性(100%)。原发组织中,AR-V7阳性率最高(95%),AR-V3(55%)、AR-V9(70%)次之;转移组织中,三种AR-Vs均100%阳性,且AR-FL与AR-Vs的表达水平显著高于原发组织(P<0.01)。结果提示,疾病进展中AR-FL与AR-Vs的表达同步升高。
产品关联:RNA提取使用Qiagen的RNeasy Mini Kit,反转录使用Qiagen的Quantitect Reverse Transcription Kit,qPCR试剂为Thermo Fisher的Luna Mastermix。
3.3 液体活检样本中AR-FL与AR-Vs的表达特征
实验目的:分析循环肿瘤细胞中AR-FL与AR-Vs的表达及与疾病进展的关系。
方法细节:纳入422例前列腺癌患者的外周血样本,用Dynabeads Epithelial Enrich Kit富集循环肿瘤细胞(CTC),提取mRNA后用qPCR检测KLK3-PSA(确认CTC阳性),再检测AR-FL与AR-Vs的表达。进一步分析96例mCRPC患者(不同治疗线)的CTC样本。
结果解读:73.7%的患者为CTC阳性,其中65.6%的CTC+样本同时表达AR-FL与AR-Vs。AR-Vs阳性样本的AR-FL水平显著高于AR-Vs阴性样本(P<0.0001),且AR-Vs数量越多(1种→3种),AR-FL水平越高(P<0.01)。随着治疗线数增加(一线→三线及以上),AR-FL与AR-Vs的阳性率从40%升至75%。结果表明,AR-Vs的表达依赖高AR-FL水平,且疾病进展中两者的表达同步增加。
产品关联:CTC富集使用Thermo Fisher的Dynabeads Epithelial Enrich Kit,mRNA提取使用Dynabeads mRNA DIRECT Purification Kit,反转录使用Thermo Fisher的SuperScript IV VILO Master Mix。
3.4 mCRPC患者ARTA治疗的临床结局分析
实验目的:分析AR-FL与AR-Vs对mCRPC患者ARTA治疗的预测及预后价值。
方法细节:纳入65例接受ARTA治疗(阿比特龙46例,恩扎卢胺19例)的mCRPC患者,检测基线CTC样本的AR-FL与AR-Vs表达,随访中位数14个月,分析与PSA响应(下降≥50%)、无进展生存期(PFS)、总生存期(OS)的关系。
结果解读:47.7%的患者出现PSA响应,其中CTC阴性患者的响应率最高(72.7%),CTC+AR-Vs阴性患者为52.6%,CTC+AR-Vs阳性患者为37.1%。AR-FL水平高的患者OS显著缩短(P<0.01),但AR-Vs阳性患者的PFS与AR-Vs数量无关(1种→3种的PFS均为5~6个月,P=0.96)。多因素分析显示,AR-FL与AR-Vs均无独立预测价值(P>0.05)。结果提示,AR-FL有预后价值,但AR-Vs无法预测ARTA响应。
产品关联:qPCR检测使用Thermo Fisher的TaqMan Fast Advanced Mastermix,其余试剂同前。
4. Biomarker研究及发现成果解析
Biomarker定位:本研究的生物标志物为AR-FL(雄激素受体全长)与AR-V3、AR-V7、AR-V9(雄激素受体剪接变体)。筛选逻辑为“细胞系验证表达依赖关系→组织样本验证疾病阶段特征→液体活检大样本验证→临床队列验证预后价值”,验证方法为qPCR(组织与液体活检样本)与CRISPR/dCas9(细胞系)。
研究过程详述:生物标志物的来源包括细胞系、原发/转移组织样本及外周血CTC。验证方法中,细胞系实验通过调控AR pre-mRNA水平,明确AR-FL与AR-Vs的表达依赖关系;组织样本与CTC样本通过qPCR检测,验证不同疾病阶段的表达特征。特异性方面,AR-Vs阳性样本均伴随高AR-FL水平,无单独AR-Vs阳性的样本;敏感性方面,AR-FL在CTC+样本中的阳性率高达92.9%(289/311)。
核心成果:①生物学关系:AR-FL与AR-Vs的表达依赖AR pre-mRNA水平,疾病进展中两者的表达同步增加;②临床特征:AR-Vs的表达总是伴随高AR-FL水平,无单独阳性样本;③预后价值:AR-FL水平高的mCRPC患者总生存期更短(P<0.01);④预测价值:AR-Vs阳性患者仍对ARTA有响应(37.1%的PSA响应率),无独立预测价值。
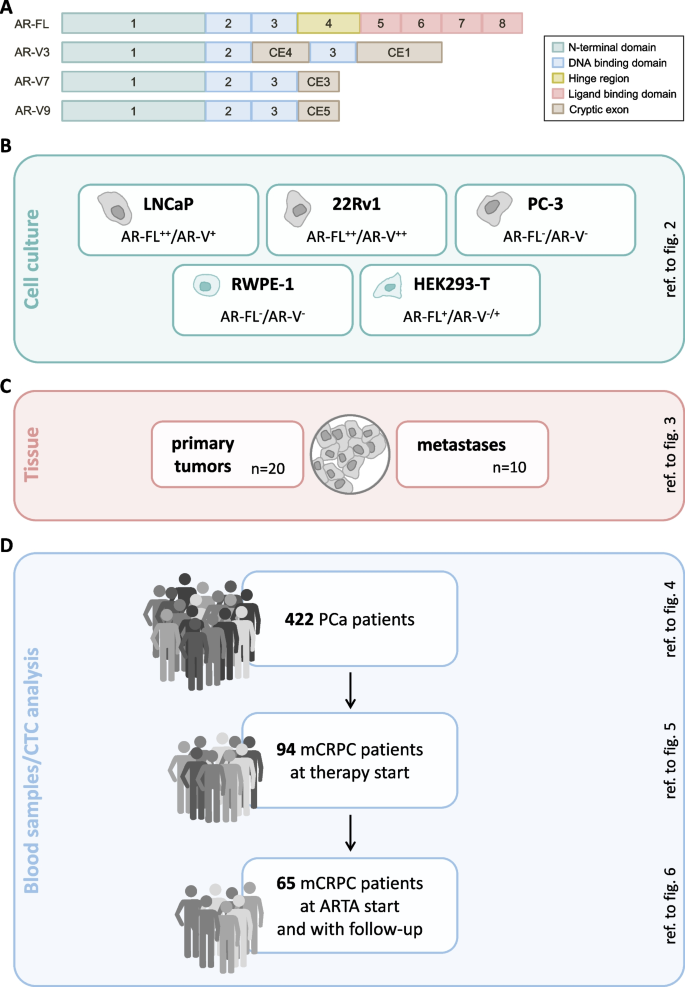
(图1:AR-FL与AR-Vs的结构及实验设计。A:AR-FL(外显子1-8)与AR-V3、V7、V9的编码序列;B:实验设计概述,涵盖细胞系、组织样本与CTC分析)
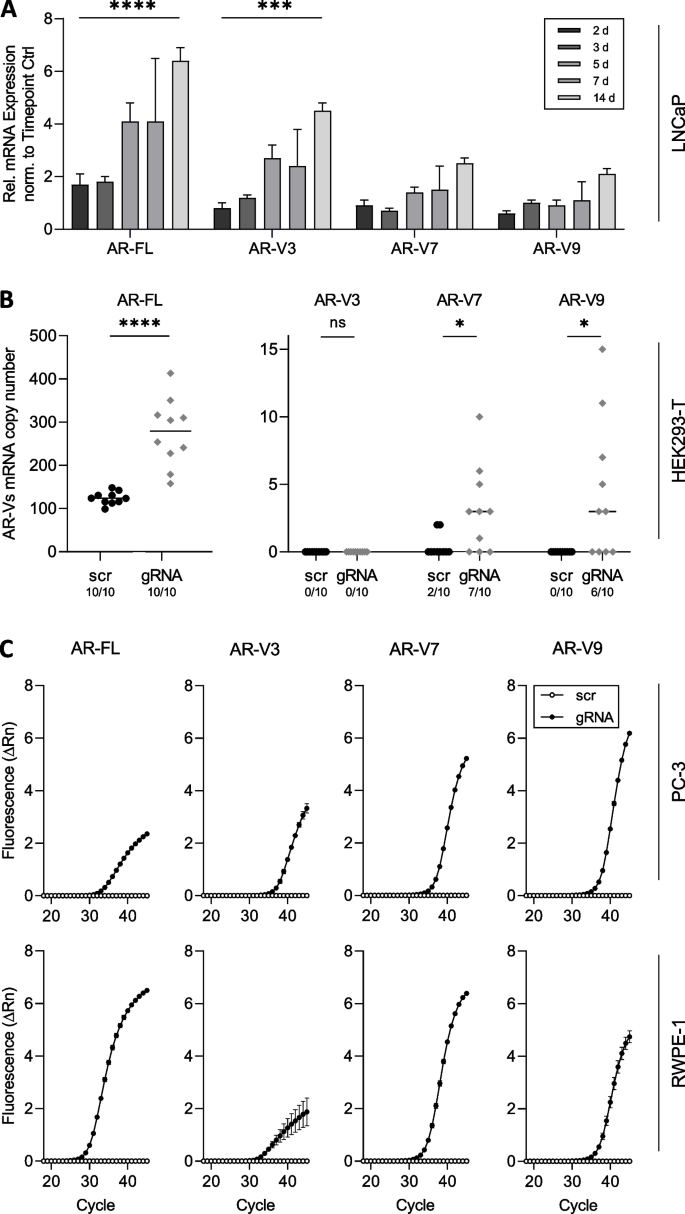
(图2:细胞系中AR-FL与AR-Vs的表达依赖关系。A:恩扎卢胺处理LNCaP细胞后,AR-FL与AR-V3水平显著升高;B:CRISPR激活AR后,HEK293-T细胞的AR-V7、V9表达增加;C:PC-3与RWPE-1细胞激活AR后,AR-FL与AR-Vs首次检测到表达)
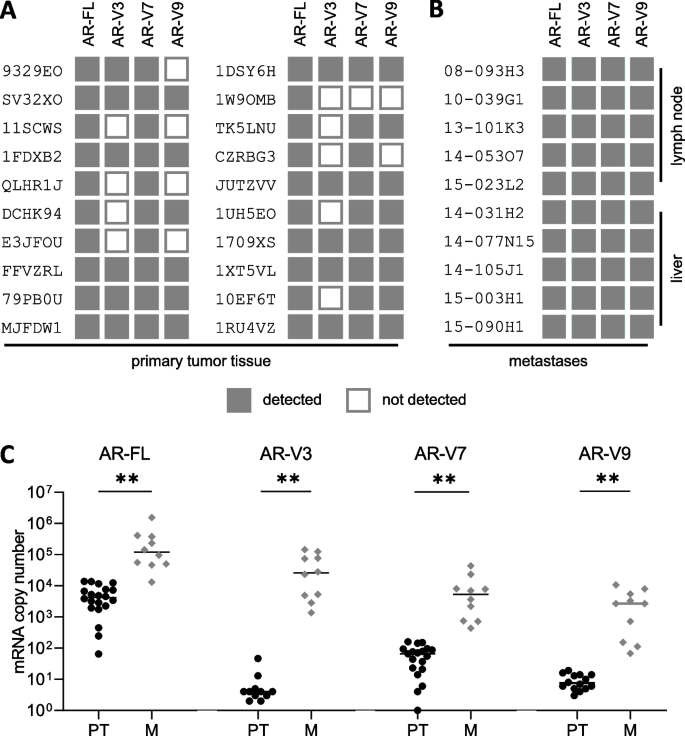
(图3:组织样本中AR-FL与AR-Vs的表达。A:原发组织中AR-V7阳性率最高;B:转移组织中三种AR-Vs均100%阳性;C:转移组织的AR-FL与AR-Vs水平显著高于原发组织)
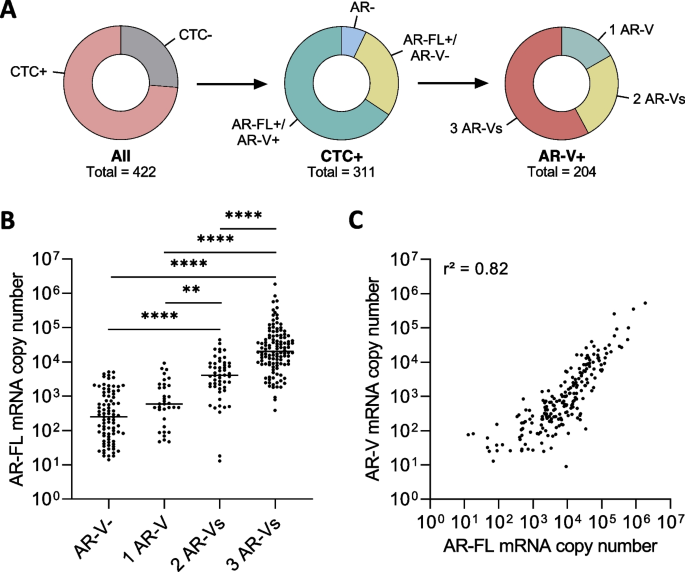
(图4:CTC样本中AR-FL与AR-Vs的表达。A:CTC+样本中65.6%同时表达AR-FL与AR-Vs;B:AR-Vs数量越多,AR-FL水平越高;C:AR-FL与AR-Vs水平呈强正相关)
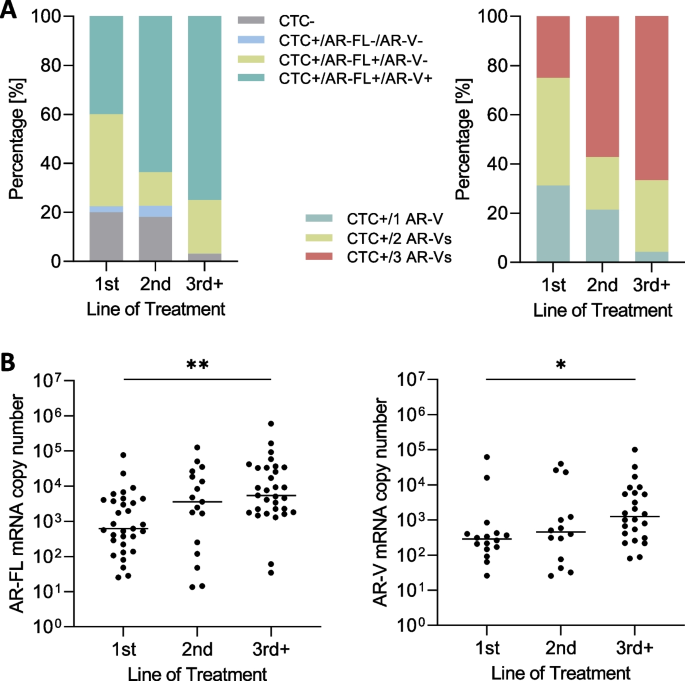
(图5:不同治疗线的AR-FL与AR-Vs表达。随着治疗线数增加,AR-FL与AR-Vs的阳性率从40%升至75%)
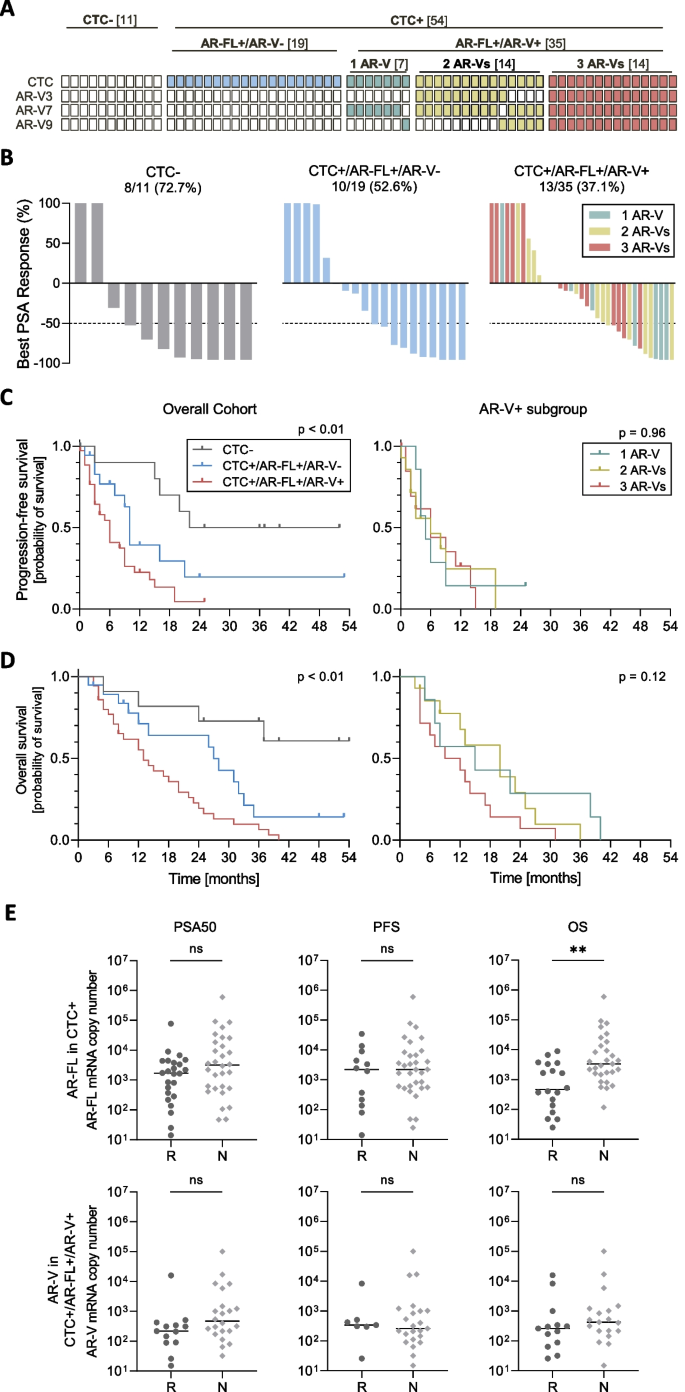
(图6:AR-FL与AR-Vs对临床结局的影响。A:54%的患者为CTC+AR-Vs阳性;B:AR-Vs阳性患者仍有37.1%的PSA响应;C:AR-Vs数量不影响无进展生存期;D:AR-FL水平高的患者总生存期更短)
