1. 领域背景与文献引入
文献英文标题:Emerging precision neoadjuvant systemic therapy for patients with resectable non-small cell lung cancer: current status and perspectives;发表期刊:Biomarker Research;影响因子:未公开;研究领域:可切除非小细胞肺癌精准新辅助治疗
肺癌是全球及美国癌症相关死亡的首要原因,其中非小细胞肺癌(NSCLC)占所有肺癌的80%-85%。过去30年,NSCLC治疗经历了从化疗到靶向治疗、免疫治疗的关键突破,晚期患者的生存获益显著提升,但可切除NSCLC患者术后仍有高达50%的复发率,传统新辅助化疗的病理完全缓解率仅5%-10%,难以满足临床需求。2022年美国FDA批准纳武利尤单抗联合化疗用于IB-IIIA期可切除NSCLC,标志着精准新辅助治疗正式进入早期NSCLC领域,但临床实施仍面临生物标志物检测范式转变、多学科协作机制不完善、疗效评价指标不统一等核心问题。本文旨在系统梳理可切除NSCLC精准新辅助治疗的现状、进展、挑战及展望,为临床实施提供系统性指导框架。
2. 文献综述解析
本文以可切除NSCLC精准新辅助治疗的全流程管理为核心评述逻辑,按治疗类型(非驱动基因NSCLC的免疫联合化疗、驱动基因NSCLC的靶向治疗)、诊疗环节(术前评估、疗效评价、生物标志物研究)及研究阶段(已获批方案、在研临床试验)进行分类整合,系统覆盖了领域内已发表的临床试验数据、回顾性研究及指南建议。
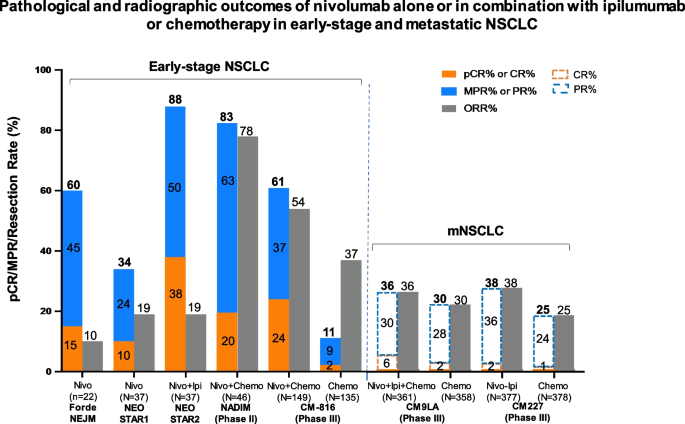
现有研究已证实,非驱动基因NSCLC领域中,CheckMate 816试验显示纳武利尤单抗联合化疗的病理完全缓解率(pCR)达24%,显著高于单纯化疗的2.2%(P<0.0001),中位无事件生存期(EFS)延长至31.6个月;NADIM试验的3年总生存期(OS)达81.9%,进一步验证了该联合方案的长期获益。驱动基因NSCLC领域中,ADAURA试验证实奥希替尼辅助治疗可显著延长EGFR敏感突变患者的无病生存期,但新辅助靶向治疗仍处于临床试验阶段,如LCMC4/LEADER伞式试验正在探索不同驱动基因对应的新辅助靶向方案。现有研究的优势在于突破了传统化疗的疗效瓶颈,显著提高了病理缓解率和长期生存,局限性包括生物标志物(如PD-L1、肿瘤突变负荷TMB)的预测价值仍存在争议,新辅助与辅助治疗的直接对比数据不足,不同种族患者的治疗差异未得到充分关注,且术前多学科评估的标准化流程尚未统一。
针对现有研究中精准新辅助治疗实施路径不清晰、生物标志物应用不规范、多学科协作机制不完善等空白,本文首次全面整合了术前评估体系、疗效评价指标、生物标志物研究进展及多学科协作框架,为临床实施精准新辅助治疗提供了系统性的指导方案,填补了领域内对精准新辅助治疗全流程管理综述的空白。
3. 研究思路总结与详细解析
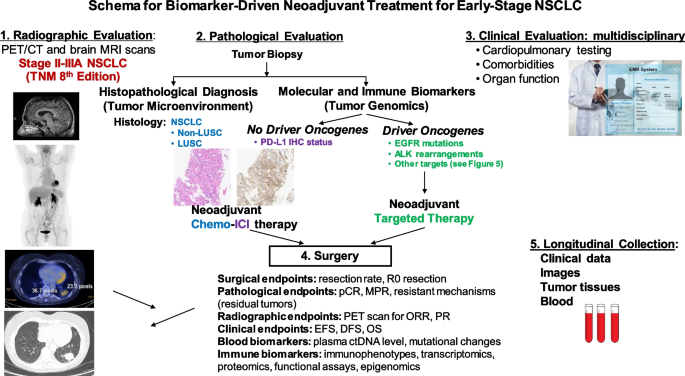
本文作为系统性综述,研究目标是为可切除NSCLC精准新辅助治疗的临床实施提供全面的现状梳理、挑战分析及未来展望;核心科学问题包括如何优化生物标志物检测以指导治疗选择、如何建立标准化的术前多学科评估体系、如何确定精准新辅助治疗的疗效评价指标;技术路线遵循“领域发展历程→现有治疗格局→术前评估体系→疗效评价与生物标志物→未来展望”的逻辑闭环,通过整合已发表的临床试验、回顾性研究及指南内容,形成系统性的综述结论。
3.1 非小细胞肺癌治疗发展历程梳理
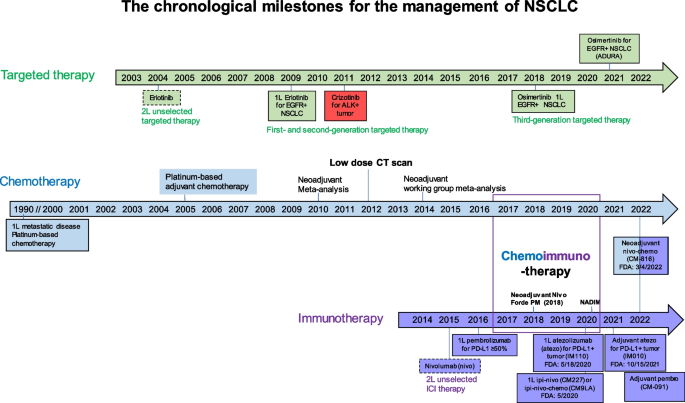
本环节的核心目标是明确精准新辅助治疗的发展背景与定位,方法是通过时间线整合领域内的关键里程碑事件,梳理从化疗时代到靶向、免疫治疗时代的转变,以及新辅助治疗从化疗到精准治疗的演进过程。结果显示,1990年代化疗成为NSCLC的基础治疗,2004年EGFR酪氨酸激酶抑制剂(TKI)开启靶向治疗时代,2015年免疫检查点抑制剂(ICI)获批用于晚期NSCLC,2022年纳武利尤单抗联合化疗获批成为可切除NSCLC的新辅助标准治疗,体现了精准治疗向早期NSCLC的延伸趋势。文献未提及具体实验产品,领域常规使用下一代测序(NGS)检测试剂盒、免疫组化(IHC)检测试剂等。
3.2 精准新辅助治疗临床研究数据整合
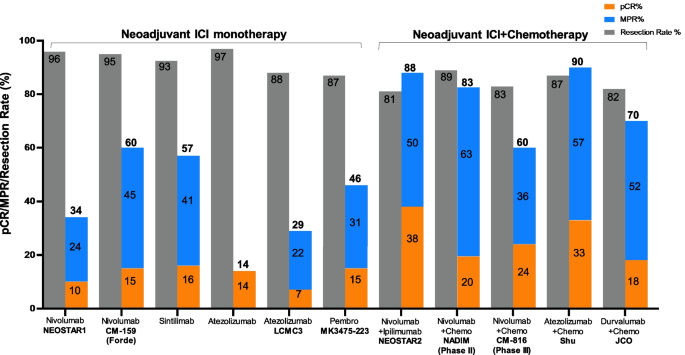
本环节的核心目标是系统总结不同类型可切除NSCLC的精准新辅助治疗疗效,方法是分类整合已获批及在研临床试验的核心数据,包括非驱动基因NSCLC的免疫联合化疗、驱动基因NSCLC的靶向治疗。结果显示,非驱动基因NSCLC中,NEOSTAR试验显示纳武利尤单抗联合伊匹木单抗的pCR率达38%,高于纳武利尤单抗单药的10%;驱动基因NSCLC中,EMERGING-CTONG 1103试验显示厄洛替尼对比化疗的主要病理缓解(MPR)率更高,但仍需III期试验验证长期获益。文献未提及具体实验产品,领域常规使用PD-1/PD-L1抑制剂(如纳武利尤单抗、帕博利珠单抗)、EGFR TKI(如奥希替尼、厄洛替尼)等治疗药物。
3.3 术前多学科评估体系解析
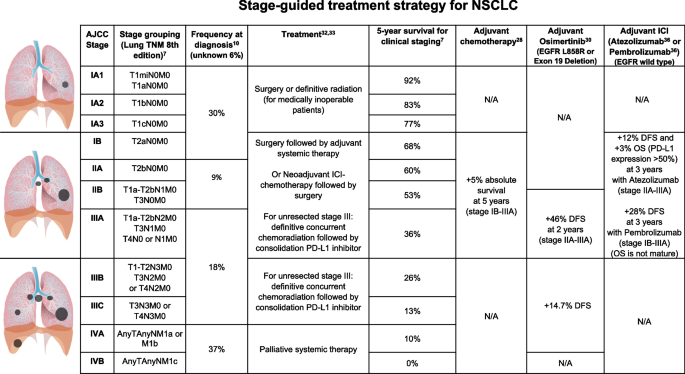
本环节的核心目标是明确精准新辅助治疗的术前评估标准,方法是整合影像学评估、组织活检、心肺功能检测等多学科评估内容。结果显示,生物标志物驱动的新辅助治疗需依托多学科协作框架,包括影像学分期(PET/CT)、组织活检(EBUS-TBNA)、心肺功能检测(心肺运动试验CPET、6分钟步行试验)及分子/免疫生物标志物检测(NGS、PD-L1 IHC),其中多学科协作是实施精准新辅助治疗的关键保障。文献未提及具体实验产品,领域常规使用PET/CT扫描仪、EBUS-TBNA设备、心肺功能检测仪器等。
3.4 疗效评价与生物标志物研究总结
本环节的核心目标是分析精准新辅助治疗的疗效评价指标及生物标志物的预测价值,方法是整合已发表研究中关于手术可行性、病理缓解、生存结局及生物标志物的相关数据。结果显示,手术可行性方面超过80%的患者在新辅助治疗后可完成完全切除;病理缓解指标中,pCR和MPR是重要的替代终点,免疫联合化疗的MPR率可达46.8%;生物标志物方面,循环肿瘤DNA(ctDNA)清除与更长的EFS和更高的pCR率相关,PD-L1≥1%、高TMB与更高的病理缓解率相关,但仍需统一的 cutoff 值。文献未提及具体实验产品,领域常规使用ctDNA检测试剂盒、TMB检测分析平台等。
4. Biomarker研究及发现成果解析
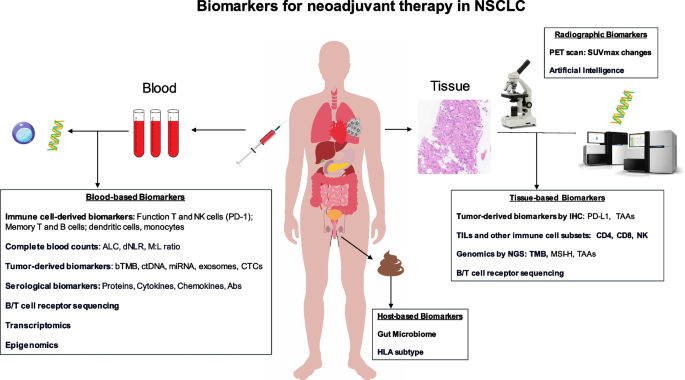
本文涉及的Biomarker涵盖组织生物标志物(PD-L1、肿瘤突变负荷TMB、干扰素γ基因表达谱GEP、同源重组缺陷HRD)和血液生物标志物(循环肿瘤DNA ctDNA、绝对淋巴细胞计数ALCs、中性粒细胞-淋巴细胞比值dNLR),筛选与验证逻辑基于已发表临床试验的荟萃分析、回顾性研究及相关性分析,系统总结了各类Biomarker在可切除NSCLC精准新辅助治疗中的预测价值。
组织生物标志物中,PD-L1通过免疫组化(IHC)检测,纳入10项研究、461例患者的荟萃分析显示,PD-L1≥1%与更高的MPR和pCR率相关,以50%为 cutoff 值时预测MPR的效能优于1%;TMB通过NGS检测,高TMB与更高的病理缓解率相关;GEP和HRD分别通过基因表达谱分析和全外显子组分析检测,与免疫治疗的病理缓解相关。血液生物标志物中,ctDNA通过液体活检检测,CheckMate 816试验显示纳武利尤单抗联合化疗组的ctDNA清除率为56%,高于化疗组的35%,ctDNA清除患者的EFS更长(HR=0.6,文献未明确样本量),pCR率更高(HR=0.13,文献未明确样本量);ALCs通过血常规检测,基线ALCs降低与免疫治疗的不良预后相关,治疗后ALCs的动态变化也与临床疗效相关;dNLR通过血常规计算,高dNLR与免疫治疗的不良预后相关。
核心成果方面,ctDNA在疗效预测中的优势超过影像学评估,其清除状态可作为预测EFS和OS的重要指标;PD-L1和TMB虽具有一定的预测价值,但仍需前瞻性研究验证统一的 cutoff 值;ALCs和dNLR可作为便捷的预后生物标志物。本文的创新性在于首次全面整合了组织与血液Biomarker在精准新辅助治疗中的应用现状,指出了现有Biomarker的局限性及未来研究方向,如探索多组学Biomarker组合、动态Biomarker监测等。