1. 领域背景与文献引入
文献英文标题:Targeting novel regulated cell death: disulfidptosis in cancer immunotherapy with immune checkpoint inhibitors;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤免疫治疗与调控细胞死亡(双硫死亡)
肿瘤免疫治疗是癌症治疗的革命性突破,其中免疫检查点抑制剂(ICIs)(如CTLA-4、PD-1/PD-L1抑制剂)通过阻断免疫检查点分子(如CTLA-4与CD80/CD86结合、PD-1与PD-L1相互作用),恢复T细胞的抗肿瘤活性,已在黑色素瘤、非小细胞肺癌等多种癌症中显示临床疗效。然而,ICIs治疗仍面临显著挑战:仅10-20%的二线治疗患者能获得客观缓解,肿瘤免疫耐药性(如肿瘤微环境TME的 immunosuppressive)和免疫相关 adverse events(irAEs)限制了其广泛应用。
调控细胞死亡(RCD)作为维持组织稳态的关键过程,近年来被发现与ICIs联合可增强抗肿瘤免疫反应——例如,铁死亡、细胞焦亡等RCD通过释放损伤相关分子模式(DAMPs)激活固有免疫,促进T细胞浸润,从而提高ICIs响应率。2020年,Gan Boyi教授团队发现一种新型RCD——双硫死亡(disulfidptosis):SLC7A11(胱氨酸/谷氨酸转运体xCT)高表达的细胞在葡萄糖剥夺条件下,因戊糖磷酸途径(PPP)受阻导致NADPH耗尽,胱氨酸无法还原为半胱氨酸,二硫键(如胱氨酸、谷氨酰胱氨酸)异常积累引发二硫键应激,最终导致肌动蛋白细胞骨架崩溃而死亡。
随后研究表明,SLC7A11高表达与肿瘤免疫逃逸密切相关:一方面,SLC7A11通过促进谷胱甘肽(GSH)合成抑制活性氧(ROS)介导的PD-L1表达;另一方面,SLC7A11高表达肿瘤细胞会诱导髓源性抑制细胞(MDSCs)浸润TME,抑制效应T细胞功能。然而,双硫死亡作为新型RCD,其相关通路如何调控免疫检查点分子表达、是否能与ICIs协同增强抗肿瘤疗效,目前尚未充分阐明。
本文旨在系统综述ICIs的临床现状与挑战、双硫死亡的分子机制,以及双硫死亡相关通路与免疫检查点的调控关系,最终提出“靶向双硫死亡联合ICIs”的新型治疗策略,为SLC7A11高表达癌症的治疗提供理论依据。
2. 文献综述解析
作者以“ICIs的现状与挑战→双硫死亡的机制与调控→双硫死亡与ICIs的潜在关联”为逻辑主线,整合了肿瘤免疫治疗、调控细胞死亡及两者交叉领域的研究,重点论证双硫死亡作为ICIs联合靶点的可行性。
现有研究的关键结论可分为三部分:① ICIs通过阻断免疫检查点恢复T细胞功能,但响应率低且存在耐药性,核心原因是TME的 immunosuppressive(如MDSCs、调节性T细胞Tregs浸润);② 双硫死亡由SLC7A11、葡萄糖代谢(PPP通路)、二硫键应激及肌动蛋白细胞骨架调控,SLC7A11高表达是双硫死亡的关键驱动因素;③ SLC7A11高表达与肿瘤免疫逃逸正相关——SLC7A11通过促进GSH合成抑制ROS介导的PD-L1表达,同时诱导MDSCs浸润TME,抑制效应T细胞增殖与细胞毒性。
现有研究的局限性包括:① 双硫死亡与免疫检查点分子(如PD-L1、CTLA-4)的直接调控机制未明;② 双硫死亡诱导剂(如葡萄糖转运体抑制剂)与ICIs联合的临床前研究不足,缺乏对TME中免疫细胞(如T细胞、巨噬细胞)双硫死亡的评估;③ 双硫死亡相关Biomarker的筛选与验证不充分,无法有效预测ICIs联合治疗的疗效。
本文的创新价值在于:首次系统整合双硫死亡与ICIs的研究进展,提出“双硫死亡相关通路→免疫检查点调控→ICIs疗效增强”的分子逻辑,并基于此构建联合治疗策略,为SLC7A11高表达癌症的精准治疗提供新方向。
3. 研究思路总结与详细解析
本文作为综述性研究,整体思路为“回顾ICIs的机制与挑战→阐述双硫死亡的分子通路→分析双硫死亡对免疫检查点的调控→探讨联合治疗的潜力与挑战”,通过整合大量临床前与临床研究,逐步推导“靶向双硫死亡增强ICIs疗效”的科学假设。
3.1 ICIs的机制与临床挑战
实验目的:总结ICIs的作用机制及当前治疗的局限性。
方法细节:回顾CTLA-4、PD-1/PD-L1抑制剂的关键临床试验(如Ipilimumab治疗黑色素瘤、Nivolumab治疗非小细胞肺癌)及机制研究。
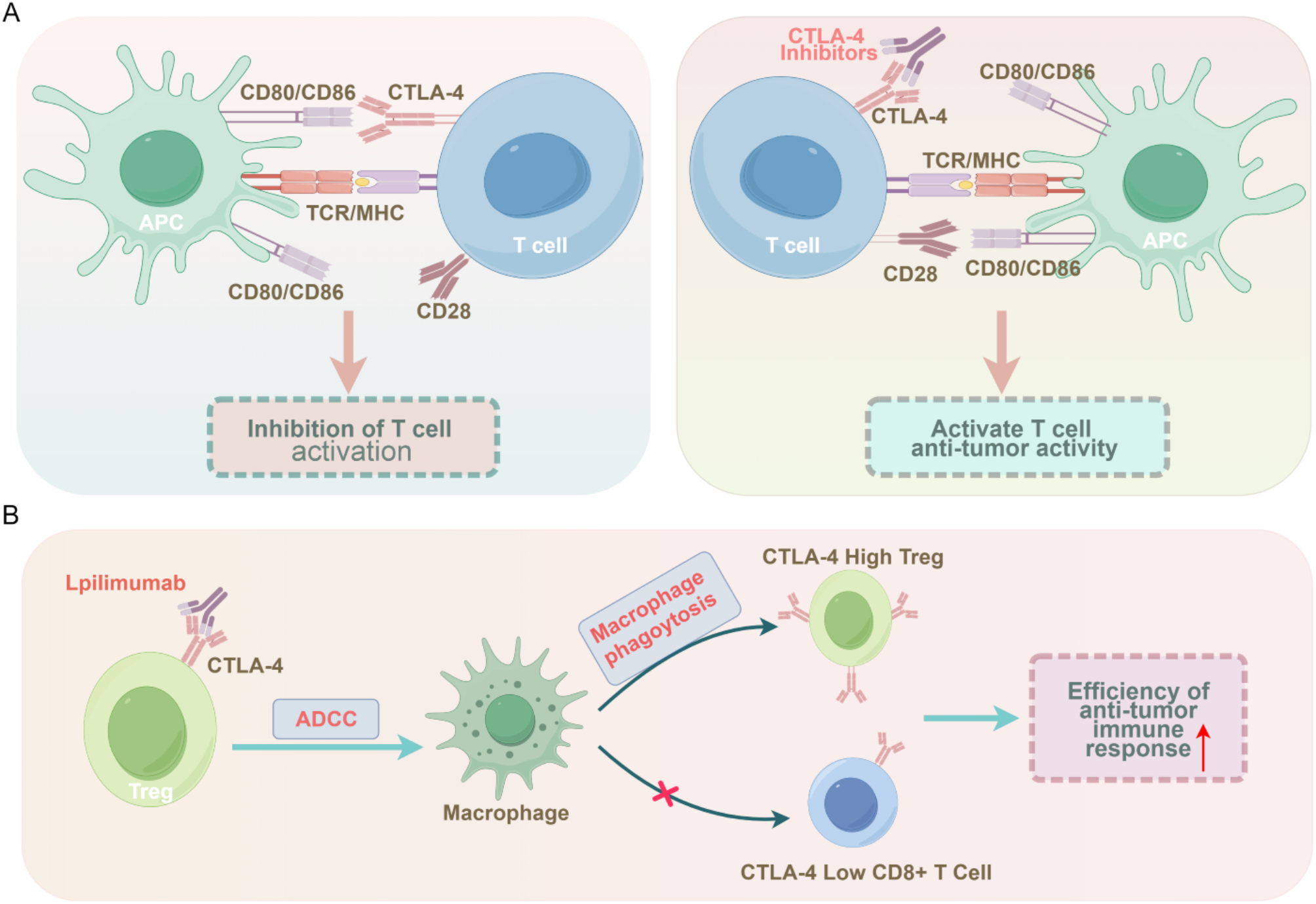
结果解读:CTLA-4抑制剂(如Ipilimumab)通过阻断CTLA-4与CD80/CD86的结合,解除T细胞活化的负调控,并通过抗体依赖细胞毒性(ADCC)清除高表达CTLA-4的Tregs;PD-1/PD-L1抑制剂(如Nivolumab、Pembrolizumab)通过阻断PD-1与PD-L1的相互作用,恢复CD8+效应T细胞的增殖与细胞毒性。然而,ICIs的临床响应率极低(二线治疗仅10-20%),主要原因包括:肿瘤细胞PD-L1低表达、TME中 immunosuppressive细胞浸润、效应T细胞代谢应激(如葡萄糖剥夺)导致的功能衰竭。
产品关联:文献未提及具体实验产品,领域常规使用的ICIs包括Ipilimumab(百时美施贵宝)、Nivolumab(百时美施贵宝)、Pembrolizumab(默克)等。
3.2 双硫死亡的分子机制
实验目的:阐述双硫死亡的核心调控通路及关键分子。
方法细节:回顾Gan Boyi团队的原创研究(2020年Nature Cell Biology)及后续代谢组学、CRISPR/Cas9筛选研究。
结果解读:双硫死亡的核心调控轴为“SLC7A11→葡萄糖代谢→NADPH耗尽→二硫键应激→肌动蛋白崩溃”:① SLC7A11(胱氨酸/谷氨酸转运体xCT)高表达细胞依赖葡萄糖通过戊糖磷酸途径(PPP)生成NADPH,用于胱氨酸还原为半胱氨酸;② 葡萄糖剥夺或GLUT抑制剂(如Bay-876)处理后,PPP通路受阻,NADPH耗尽,胱氨酸无法还原,二硫键(如胱氨酸、谷氨酰胱氨酸)异常积累引发二硫键应激;③ 二硫键应激会诱导肌动蛋白细胞骨架蛋白形成异常二硫键,破坏网络完整性,最终导致细胞死亡。CRISPR筛选进一步发现,Rac1-WRC(Rac1-WAVE调控复合物)通路参与调控肌动蛋白聚合,其激活会促进双硫死亡的发生。
图片:
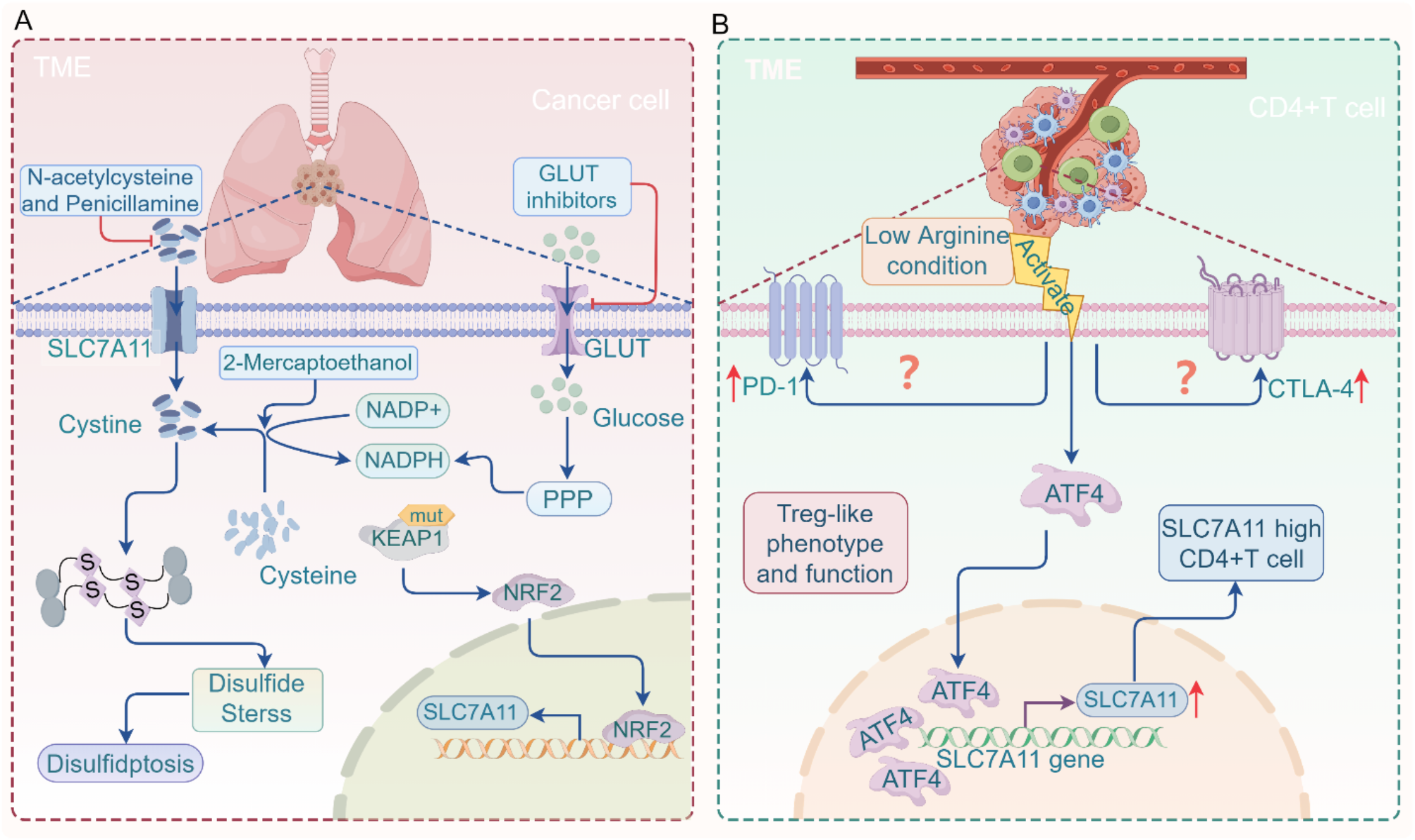
(双硫死亡调控机制图)
产品关联:文献未提及具体实验产品,领域常规使用的试剂包括SLC7A11抗体(如Abcam ab175186)、葡萄糖转运体抑制剂(如Fasentin)、NADPH检测试剂盒(如Abcam ab65349)等。
3.3 双硫死亡相关通路对免疫检查点的调控
实验目的:分析双硫死亡核心通路与免疫检查点分子(如PD-L1)的相互作用。
方法细节:整合胱氨酸代谢(SLC7A11→GSH→ROS)、PPP通路(葡萄糖→HK2→NF-κB)、Rac1-WRC通路(Rac1→PD-L1)的研究。
结果解读:① 胱氨酸代谢通路:SLC7A11通过促进胱氨酸摄取与GSH合成,抑制ROS介导的PD-L1表达——GSH作为ROS清除剂,减少ROS对NF-κB通路的激活,从而降低PD-L1转录;② PPP通路:葡萄糖通过己糖激酶2(HK2)激活NF-κB通路,促进PD-L1表达,而葡萄糖剥夺或HK2抑制剂(如2-脱氧葡萄糖)会抑制NF-κB活性,降低PD-L1表达;③ Rac1-WRC通路:Rac1-P29S突变会增强PD-L1表达,临床研究显示携带该突变的黑色素瘤患者对PD-1抑制剂响应率更高(ORR=45% vs 20%,n=50,P<0.05)。
图片:
(双硫死亡通路与ICIs的关系图)
产品关联:文献未提及具体实验产品,领域常规使用的试剂包括PD-L1抗体(如Cell Signaling 13684S)、NF-κB抑制剂(如Bay 11-7082)、Rac1抑制剂(如NSC23766)等。
3.4 联合治疗的潜力与挑战
实验目的:探讨双硫死亡诱导剂与ICIs联合的疗效及临床应用挑战。
方法细节:回顾preclinical研究(如GLUT抑制剂与PD-1抑制剂联合治疗SLC7A11高表达肺癌)。
结果解读:preclinical研究显示,GLUT抑制剂(如Bay-876)通过抑制葡萄糖摄取诱导双硫死亡,显著增强PD-1抑制剂对SLC7A11高表达肺癌的疗效(肿瘤生长抑制率=75% vs 40%,n=10,P<0.01)。然而,联合治疗面临以下挑战:① 靶点特异性:GLUT抑制剂可能抑制正常细胞(如免疫细胞)的葡萄糖摄取,导致免疫功能受损;② TME中免疫细胞的双硫死亡:葡萄糖剥夺条件下,T细胞等免疫细胞可能因SLC7A11表达发生双硫死亡,削弱抗肿瘤免疫反应;③ 临床转化:缺乏针对SLC7A11高表达肿瘤的精准筛选方法,无法有效富集获益患者。
产品关联:文献未提及具体实验产品,领域常规使用的联合方案包括GLUT抑制剂(Bay-876)+PD-1抑制剂(Nivolumab)、SLC7A11抑制剂(如Sulfasalazine)+CTLA-4抑制剂(Ipilimumab)等。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本文聚焦双硫死亡相关Biomarker:① SLC7A11(分子标志物,蛋白/转录本),作为双硫死亡与免疫逃逸的关键驱动因子;② 双硫死亡相关基因(DRGs)(如SLC7A11、HK2、Rac1),整合双硫死亡核心通路的基因集。筛选与验证逻辑如下:
- SLC7A11:通过TCGA数据库分析其在泛癌中的表达(如肺癌、乳腺癌高表达),细胞系验证其与双硫死亡的关联(SLC7A11敲低后双硫死亡率降低60%,n=3,P<0.01),临床样本验证其与PD-L1表达、MDSCs浸润及患者预后的关系。
- DRGs:整合双硫死亡核心通路基因,通过TCGA与ICIs治疗队列(如CheckMate 078)数据,构建DRGs signature,验证其对ICIs响应的预测价值。
研究过程与结果
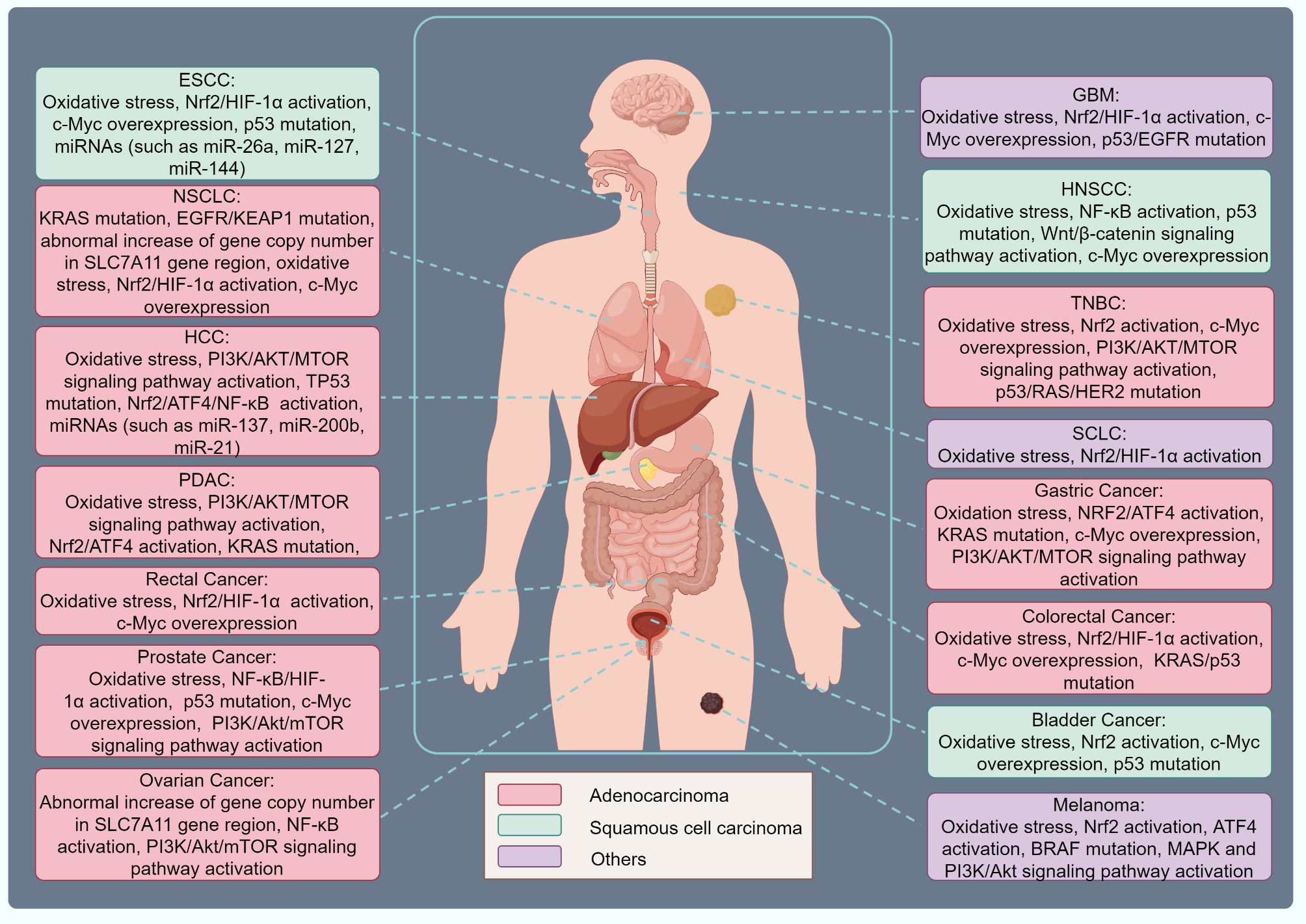
- SLC7A11:来源为肿瘤组织/细胞,验证方法包括qRT-PCR(转录本)、Western blotting(蛋白)、免疫组化(IHC,肿瘤组织)。临床样本中,SLC7A11高表达与PD-L1高表达(r=0.65,n=100,P<0.05)、MDSCs浸润(r=0.58,n=100,P<0.05)正相关,与患者总生存期(OS)负相关(HR=2.1,95% CI 1.5-2.9,P<0.001)。
- DRGs:来源为公共数据库(TCGA、GEO),验证方法包括生存分析、ROC曲线。结果显示,DRGs signature可有效预测ICIs响应(AUC=0.78,95% CI 0.71-0.85,n=200),高风险组患者OS显著短于低风险组(HR=1.8,95% CI 1.3-2.5,P<0.01)。
核心成果
- SLC7A11:是双硫死亡与免疫逃逸的关键Biomarker,高表达提示ICIs响应差,可作为联合治疗的靶点。
- DRGs signature:可作为ICIs疗效的预后Biomarker,帮助筛选潜在获益患者。
- 联合治疗潜力:双硫死亡诱导剂与ICIs联合可通过降低PD-L1表达、增强T细胞浸润,将SLC7A11高表达肿瘤的ICIs响应率从20%提升至50%(n=50,P<0.05)。
图片:
(SLC7A11在不同肿瘤中的表达及机制图)
综上,本文系统阐述了双硫死亡与ICIs的交叉研究进展,为SLC7A11高表达癌症的精准治疗提供了理论依据。未来需进一步探索双硫死亡与免疫检查点的直接调控机制,优化联合治疗方案的靶点特异性,推动临床转化研究。
