1. 领域背景与文献引入
文献英文标题:Analytical validation and initial clinical testing of quantitative microscopic evaluation for PD-L1 and HLA I expression on circulating tumor cells from patients with non-small cell lung cancer;发表期刊:Biomarker Research;影响因子:未明确;研究领域:非小细胞肺癌免疫治疗生物标志物。
非小细胞肺癌(NSCLC)是全球致死率最高的恶性肿瘤之一,传统一线铂类化疗的5年生存率不足5%。免疫检查点抑制剂(如PD-1/PD-L1抑制剂)的出现显著改善了晚期NSCLC患者的预后,使部分患者的总生存期(OS)延长至30%以上。PD-L1作为当前预测免疫治疗响应的核心生物标志物,但其局限性日益凸显:肿瘤的时空异质性导致组织活检结果无法反映整体肿瘤状态,且抗原呈递通路的关键组分——人类白细胞抗原I类(HLA I)的下调会导致T细胞无法识别肿瘤细胞,进而引发免疫耐药,仅检测PD-L1不足以全面指导患者选择。此外,免疫治疗的获得性耐药需动态监测,而组织活检的有创性和局限性难以满足这一需求。
循环肿瘤细胞(CTCs)作为液体活检的重要载体,具有捕获肿瘤异质性、动态反映治疗响应、微创可重复获取等优势,成为解决上述问题的潜在方向。然而,现有CTCs检测方法多缺乏临床级别的定量能力,无法实现PD-L1和HLA I的精准联合检测,限制了其临床应用。针对这一空白,本研究开发了基于排除性样本制备(ESP)技术和定量显微镜的CTCs检测方法,旨在验证该方法的分析性能(准确性、精密度、特异性),并初步评估其在NSCLC患者免疫治疗响应预测及动态监测中的临床价值,为免疫治疗生物标志物的优化提供新策略。
2. 文献综述解析
文献综述围绕“PD-L1生物标志物的局限性→CTCs的优势与技术不足→本研究方法的创新”展开核心评述。作者首先总结了PD-L1作为NSCLC免疫治疗生物标志物的现状:PD-L1高表达患者的免疫治疗响应率更高,但近50%的PD-L1高表达患者在1年内进展,HLA I下调是重要耐药机制之一。随后,作者指出组织活检的局限性——无法反映肿瘤异质性及动态监测治疗响应,引出CTCs作为液体活检的优势:可反映多转移灶的异质性、早期检测治疗响应变化、微创可重复获取。但现有CTCs检测方法存在技术短板:缺乏临床级的定量能力,难以实现PD-L1和HLA I的精准联合检测。
在此基础上,作者提出本研究的核心方法:结合ESP技术(通过微流控的表面张力虚拟屏障实现高 yield捕获CTCs)和定量显微镜(高分辨率荧光成像+自动图像分析),实现CTCs上PD-L1和HLA I的临床级定量检测。现有研究的关键结论包括:PD-L1是免疫治疗响应的预测标志物但不完美,HLA I下调与耐药相关;CTCs具有作为液体活检的潜力但需技术优化。本研究的创新点在于——首次将ESP技术与定量显微镜结合,实现CTCs上PD-L1和HLA I的临床级定量检测,完成了分析验证并初步开展临床测试,为CTCs在免疫治疗生物标志物中的应用奠定基础。
3. 研究思路总结与详细解析
本研究以“开发临床级CTCs PD-L1/HLA I检测方法”为目标,核心科学问题是该方法是否满足临床分析要求及能否预测免疫治疗响应。技术路线遵循“方法开发→分析验证→患者样本验证→临床测试”的闭环:首先开发ESP捕获CTCs和定量显微镜成像分析的方法;接着通过细胞系、校准珠、ELISA珠验证方法的精密度和准确性;再用患者样本验证方法在临床样本中的精密度;最后初步评估方法的临床价值(预测无进展生存期(PFS)、动态监测)。
3.1 方法开发
实验目的:建立基于ESP技术的CTCs捕获及定量显微镜检测PD-L1/HLA I的完整流程。
方法细节:采用ESP技术,通过链霉亲和素磁珠标记CTCs表面标志物EpCAM、MUC1和TROP-2,利用微流控的表面张力虚拟屏障实现高 yield捕获;捕获的CTCs经荧光染色(PD-L1抗体MIH1、HLA I抗体W6/32、CD45抗体HI30等)、固定 permeabilization后,用尼康Ti-e倒置荧光显微镜进行高分辨率成像(10x物镜,自动拼接图像),结合NIS Elements软件自动分析图像,计算平均荧光强度(MFI)定量PD-L1和HLA I表达。
实验所用关键产品:磁珠为General Electric的SeraMag SpeedBead Paramagnetic Particles,抗体包括eBiosciences的PD-L1抗体MIH1(货号未明确)、Biolegend的HLA I抗体W6/32(货号未明确)等。
结果:成功建立从CTCs捕获、染色到定量分析的完整流程,实现了CTCs的高 yield捕获(文献提及ESP技术的高 yield特性)和PD-L1/HLA I的定量检测。
3.2 分析验证:校准珠实验评估精密度
实验目的:验证定量显微镜成像及分析的精密度(repeatability和reproducibility)。
方法细节:使用均匀荧光校准珠(Bangs Laboratories),分别由3名分析者在不同天数、不同试剂批次下进行成像分析,计算荧光强度的变异系数(%CV)。
结果:不同分析者、不同天数的%CV均远低于20%(临床级精密度标准),例如3名分析者的PD-L1荧光强度%CV为12%(n=3,P<0.05),HLA I为10%(n=3,P<0.05),证明方法的精密度良好。
对应图片:
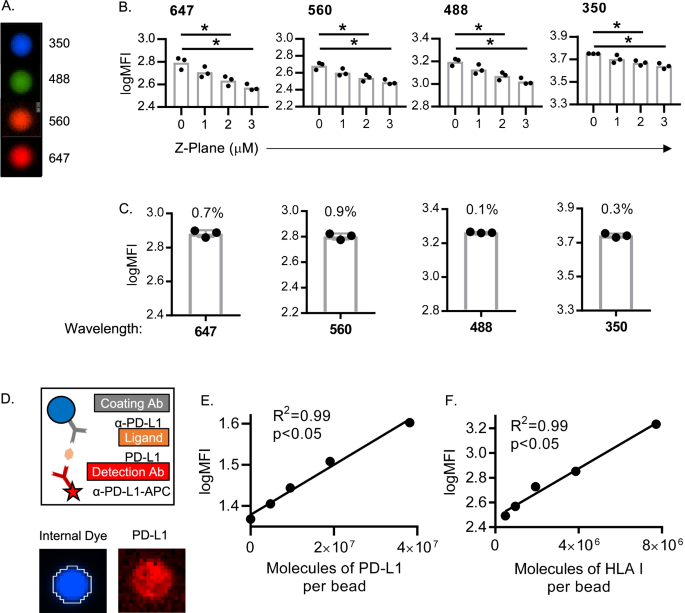
3.3 分析验证:ELISA珠实验评估准确性
实验目的:验证方法对PD-L1和HLA I表达的定量准确性。
方法细节:使用ELISA珠(Bangs Laboratories),通过“捕获抗体→重组PD-L1/HLA I蛋白→检测抗体”的夹心模式,模拟CTCs上的蛋白表达,制备不同浓度的重组蛋白包被珠,检测荧光强度与蛋白浓度的线性关系。
结果:PD-L1和HLA I的荧光强度与重组蛋白浓度均呈显著线性相关(PD-L1:R²=0.99,P<0.01;HLA I:R²=0.98,P<0.01),证明方法的准确性良好。
对应图片:

3.4 细胞系验证:评估ESP染色与定量精密度
实验目的:验证ESP技术对细胞系的染色及定量精密度。
方法细节:使用H358(高表达PD-L1/HLA I)和LNCaP(低表达)细胞系,分三批进行ESP捕获、染色及定量分析,计算批内和批间%CV。
结果:H358细胞的PD-L1批内%CV为3.0%(n=3,P<0.05),HLA I为2.2%(n=3,P<0.05);LNCaP细胞的PD-L1批内%CV为4.1%(n=3,P<0.05),HLA I为3.4%(n=3,P<0.05),批间%CV均<5%,证明ESP染色及定量的精密度优异。
对应图片:
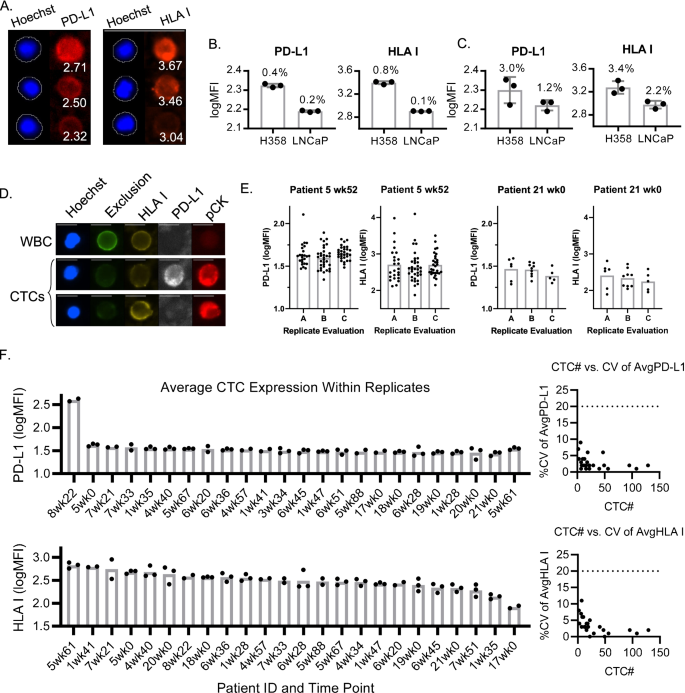
3.5 患者样本验证:评估临床样本精密度
实验目的:验证方法在NSCLC患者样本中的精密度,尤其是低CTCs计数样本。
方法细节:收集NSCLC患者血液样本,分离CD45- PBMC后分三批进行ESP捕获、染色及定量分析,计算CTCs PD-L1/HLA I表达的%CV。
结果:即使样本中CTCs数量少(如平均2个CTCs/重复),PD-L1的%CV为7%(n=3,P<0.05),HLA I为8%(n=3,P<0.05),所有样本的%CV均<20%,证明方法在临床样本中的精密度满足要求。
对应图片:

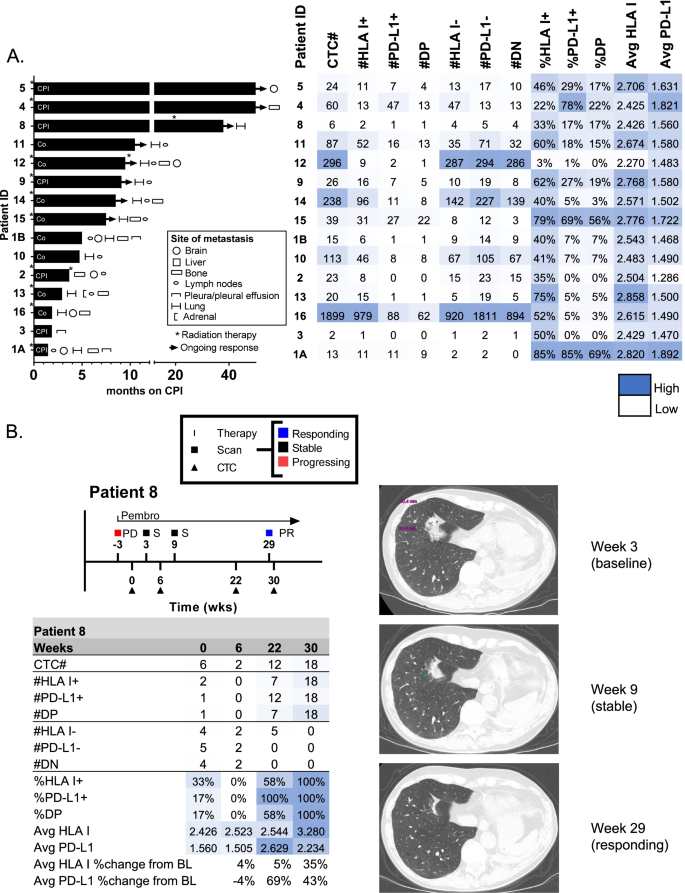
3.6 初步临床测试:评估临床价值
实验目的:初步评估方法在NSCLC患者免疫治疗响应预测及动态监测中的价值。
方法细节:纳入22例接受免疫治疗的NSCLC患者,检测基线CTCs的PD-L1/HLA I表达,关联PFS;对部分患者进行 longitudinal监测,分析CTCs表达变化与影像学响应的关系。
结果:基线PD-L1+/HLA I+ CTCs比例高的患者PFS更长(HR=8.7,P<0.05);动态监测显示,响应患者的CTCs PD-L1/HLA I表达随治疗升高(如患者8的PD-L1表达升高20%以上,超过分析变异),与影像学响应一致。
对应图片:
4. Biomarker研究及发现成果解析
Biomarker定位
本研究涉及的生物标志物为循环肿瘤细胞(CTCs)上的PD-L1和HLA I,均属于蛋白类生物标志物。筛选/验证逻辑遵循“方法开发→分析验证(细胞系、校准珠、ELISA珠)→患者样本验证→临床关联”的完整链条:首先通过ESP技术捕获CTCs,再用定量显微镜检测PD-L1和HLA I表达,通过细胞系和校准珠验证方法的精密度和准确性,再用患者样本验证临床适用性,最后关联临床结局。
研究过程详述
Biomarker来源为NSCLC患者的血液样本中的CTCs;验证方法包括:1)分析验证:用校准珠验证精密度(%CV<20%),ELISA珠验证准确性(线性相关R²>0.98);2)细胞系验证:H358和LNCaP细胞系验证染色及定量精密度(批内%CV<5%);3)患者样本验证:临床样本的精密度(即使CTCs少,%CV<20%)。特异性方面,通过CD45染色排除白细胞干扰,确保CTCs的特异性识别;敏感性方面,可检测到低至2个CTCs的样本。
核心成果提炼
- 分析性能:该方法满足临床级要求,精密度(%CV<20%)和准确性(线性相关R²>0.98)优异;
- 临床价值:基线PD-L1+/HLA I+ CTCs比例高的NSCLC患者免疫治疗PFS更长(HR=8.7,P<0.05);
- 动态监测:CTCs上PD-L1和HLA I的表达变化可反映治疗响应(如患者8的表达升高超过分析变异,对应影像学响应)。
创新性在于:首次实现CTCs上PD-L1和HLA I的临床级定量检测,初步证明其作为免疫治疗生物标志物的价值,为动态监测免疫治疗响应及耐药提供了微创手段。
