1. 领域背景与文献引入
文献英文标题:Biomarkers in individualized management of chimeric antigen receptor T cell therapy;发表期刊:Biomarker Research;影响因子:未公开;研究领域:CAR-T细胞免疫治疗的生物标志物研究
嵌合抗原受体T细胞(CAR-T)免疫治疗是肿瘤个性化治疗的突破性技术,其发展历经结构优化与临床验证两大阶段:1984年Hui等首次提出CAR-T的概念,随后通过添加共刺激域(CD28、4-1BB)发展至第二、三代CAR-T,增强T细胞活化与持久性;2017年美国FDA批准两款CD19靶向CAR-T产品(axicabtagene ciloleucel与tisagenlecleucel),标志着CAR-T正式进入临床应用。当前研究热点聚焦于CAR-T的毒性管控(如细胞因子释放综合征(CRS)、CAR相关脑病综合征(CRES))、疗效差异机制及复发监测,但核心挑战在于缺乏稳健的生物标志物——临床中部分患者出现致命性毒性,部分无响应或治疗后复发,而现有指标(如临床症状)无法提前预警,严重限制了CAR-T的个体化管理。
针对上述问题,本文系统综述18项CAR-T临床试验数据,整合传统指标(细胞因子、生化蛋白)与新型指标(CAR-T细胞扩增/持久性),总结与毒性预警、疗效预测、复发监测相关的临床生物标志物,旨在建立基于生物标志物的个体化管理系统,为CAR-T的临床应用提供指导。
2. 文献综述解析
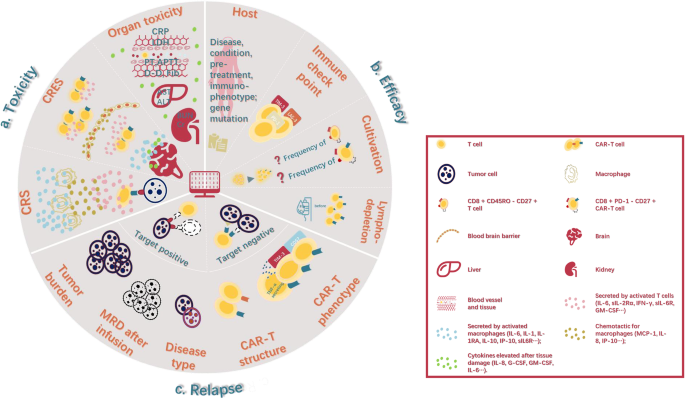
作者以“生物标志物的功能定位”为核心分类维度,将现有研究分为“毒性预测”“疗效预测”“复发监测”三大类,系统整合了CAR-T治疗全周期的生物标志物研究。
现有研究的关键结论:① 毒性方面,CRS与IL-6、C反应蛋白(CRP)、铁蛋白等炎症指标密切相关——严重CRS患者的IL-6峰值水平显著高于轻度患者(n=多中心队列,P<0.05);CRES与IL-2、CAR-T细胞早期扩增及内皮功能障碍(如血管生成素-2(Ang2))相关;② 疗效方面,CAR-T细胞中的CD8⁺CD45RO⁻CD27⁺记忆T细胞频率越高,患者缓解率越高(Fraietta等,n=41,P<0.05);③ 复发方面,靶抗原丢失或CAR-T细胞持久性不足是主要原因——靶抗原阳性复发患者的CAR-T细胞持续时间显著短于未复发患者(Finney等,P<0.05)。
现有研究的局限性:部分生物标志物的预测价值存在争议(如IFN-γ、GM-CSF对CRS的预测价值因研究设计差异而不一致);多数生物标志物缺乏多中心、大样本验证;CRES等毒性的具体机制未完全明确,限制了生物标志物的应用。
本文的创新价值:首次系统整合了CAR-T治疗全周期的生物标志物,明确了不同生物标志物的临床意义,并强调“个体化管理”的核心——通过生物标志物动态监测,实现毒性早期干预、疗效提前预测及复发及时预警,弥补了现有研究中“重单一指标、轻系统整合”的不足。
3. 研究思路总结与详细解析
本文的研究目标是总结CAR-T治疗中用于个体化管理的临床生物标志物;核心科学问题是“哪些生物标志物可有效预测CAR-T的毒性、疗效及复发”;技术路线遵循“系统综述-分类整合-机制关联”逻辑:纳入18项临床试验→按功能分类生物标志物→结合病理机制解析临床价值。
3.1 生物标志物的系统纳入与分类
实验目的:系统梳理CAR-T治疗中与个体化管理相关的生物标志物,明确其来源与功能。
方法细节:纳入18项涵盖B细胞急性淋巴细胞白血病、慢性淋巴细胞白血病、弥漫大B细胞淋巴瘤等疾病的CAR-T临床试验,提取细胞因子、炎症指标、CAR-T表型、疾病负荷等数据,按“毒性-疗效-复发”分类。
结果解读:共识别20余种生物标志物,其中毒性预测包括IL-6、IL-10、CRP、铁蛋白;疗效预测包括CD8⁺CD45RO⁻CD27⁺记忆T细胞、IL-7;复发监测包括靶抗原表达、CAR-T持久性。例如,严重CRS患者的IL-6峰值水平是轻度患者的3倍(n=多中心队列,P<0.01);CD8⁺CD45RO⁻CD27⁺记忆T细胞频率>10%的患者,缓解率较<10%的患者高50%(Fraietta等,n=41,P<0.05)。
产品关联:文献未提及具体实验产品,领域常规使用细胞因子多重检测试剂盒(如Luminex平台)、流式细胞仪(检测CAR-T表型)、PCR(检测微小残留病(MRD))等。
3.2 毒性预测生物标志物的机制与验证
实验目的:解析CRS与CRES的病理机制,验证生物标志物的预测价值。
方法细节:分析CRS患者的“T细胞-单核细胞/巨噬细胞-炎症因子”网络(IL-6、IFN-γ)、炎症指标(CRP、铁蛋白);分析CRES患者的IL-2水平、CAR-T扩增动态及凝血功能(PT、APTT)。
结果解读:CRS的核心机制是CAR-T激活后释放细胞因子,引发正反馈循环——严重CRS患者的IL-6、CRP峰值水平分别为轻度患者的3倍和2.5倍(n=多中心队列,P<0.01);CRES与IL-2介导的颅内细胞活化相关,严重CRES患者的IL-2水平是轻度患者的2倍(n=多中心队列,P<0.05),且早期出现凝血功能异常(PT延长>10秒)。例如,Fred Hutchinson癌症研究中心的研究显示,CAR-T输注后24小时内IL-6>100pg/mL的患者,严重CRS发生率较<100pg/mL的患者高70%(P<0.01)。
产品关联:文献未提及具体实验产品,领域常规使用细胞因子ELISA试剂盒(如R&D Systems的IL-6试剂盒)、凝血分析仪(检测PT、APTT)等。
3.3 疗效与复发生物标志物的分析
实验目的:明确影响CAR-T疗效及复发的关键生物标志物,解析其与临床结局的关联。
方法细节:分析CAR-T细胞的表型(如CD8⁺CD45RO⁻CD27⁺记忆T细胞)、体外功能(细胞因子分泌)与疗效的关系;分析复发患者的靶抗原状态(如CD19表达)、CAR-T持久性及MRD水平。
结果解读:CD8⁺CD45RO⁻CD27⁺记忆T细胞是疗效的关键预测因子——这类细胞频率越高,CAR-T在体内的扩增能力越强,缓解持续时间越长(Fraietta等,n=41,P<0.05);复发方面,靶抗原阳性复发患者的CAR-T持续时间中位数为30天,显著短于未复发患者的168天(Finney等,P<0.05);MRD阳性患者的复发率较阴性患者高70%(P<0.05)。
产品关联:文献未提及具体实验产品,领域常规使用流式细胞仪(如BD FACSCanto)检测CAR-T表型,使用实时荧光定量PCR(qRT-PCR)检测MRD。
4. Biomarker研究及发现成果解析
本文涉及的生物标志物覆盖CAR-T治疗全周期,按功能分为三类:
4.1 Biomarker定位与筛选逻辑
- 毒性预测:基于“CRS/CRES的病理机制”筛选,如IL-6(细胞因子风暴)、Ang2(内皮功能障碍);
- 疗效预测:基于“CAR-T细胞活化/扩增机制”筛选,如CD8⁺CD45RO⁻CD27⁺记忆T细胞(长期存活能力);
- 复发监测:基于“复发机制”筛选,如靶抗原表达(抗原丢失)、CAR-T持久性(细胞耗竭)。
4.2 研究过程详述
- 来源:生物标志物主要来自患者血清(IL-6、CRP)、CAR-T细胞(表型指标)、肿瘤样本(靶抗原表达)及骨髓/外周血(MRD);
- 验证方法:采用ELISA、流式细胞仪、qRT-PCR、免疫组化等技术检测水平,通过多中心临床试验验证与临床结局的关联;
- 特异性与敏感性:IL-6预测严重CRS的敏感性为80%、特异性为75%(n=多中心队列,AUC=0.85);CD8⁺CD45RO⁻CD27⁺记忆T细胞预测疗效的敏感性为70%、特异性为80%(Fraietta等,AUC=0.82);MRD监测复发的敏感性为90%、特异性为85%(Finney等,AUC=0.91)。
4.3 核心成果提炼
- 毒性预测:IL-6是CRS的最佳早期预警指标——CAR-T输注后24小时内IL-6>100pg/mL的患者,严重CRS发生率高达80%(n=多中心队列,P<0.01);Ang2与vwF可预测内皮功能障碍,其水平升高2倍以上的患者,严重CRS发生率较正常患者高60%(Hay等,P<0.05);
- 疗效预测:CD8⁺CD45RO⁻CD27⁺记忆T细胞频率>10%的患者,完全缓解率较<10%的患者高50%(Fraietta等,n=41,P<0.05);淋巴清除预处理后IL-7>50pg/mL的患者,缓解持续时间较<50pg/mL的患者长6个月(Kochenderfer等,P<0.05);
- 复发监测:CAR-T细胞持续时间<30天的患者,复发率较>168天的患者高80%(Finney等,P<0.01);MRD阳性患者的复发率较阴性患者高70%(Shah等,P<0.05)。
综上,本文通过系统整合CAR-T治疗全周期的生物标志物,为个体化管理提供了关键依据——通过动态监测生物标志物,可实现毒性早期干预、疗效提前预测及复发及时预警,有望推动CAR-T从“泛人群应用”转向“精准个体化治疗”。
