1. 领域背景与文献引入
文献英文标题:RUNX1 promotes angiogenesis in colorectal cancer by regulating the crosstalk between tumor cells and tumor associated macrophages;发表期刊:Biomarker Research;影响因子:未公开;研究领域:结直肠癌肿瘤微环境与血管生成。
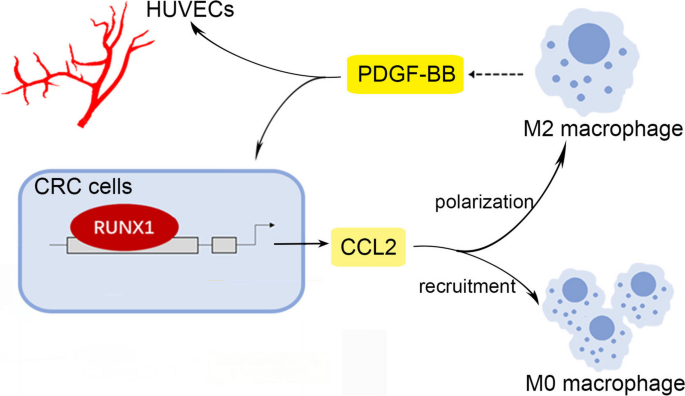
结直肠癌(CRC)是全球范围内常见的恶性肿瘤之一,其发病率居恶性肿瘤第三位,死亡率居第二位,严重威胁人类健康。血管生成是CRC恶性进展的关键标志,它为肿瘤生长提供营养支持并促进转移,但目前临床抗血管生成治疗仅对少数患者有效,其潜在机制尚未完全阐明。Runt相关转录因子1(RUNX1)是一类参与造血和血管生成调控的重要转录因子,此前研究表明其在CRC中作为癌基因,通过激活Wnt/β-catenin、Hedgehog等通路促进肿瘤细胞增殖、转移及化疗耐药,但RUNX1在CRC血管生成中的作用及与肿瘤微环境(TME)中肿瘤相关巨噬细胞(TAMs)的串扰机制仍不清楚。针对这一研究空白,本研究旨在探究RUNX1介导的CRC细胞与M2型TAMs的相互作用及其与肿瘤血管生成的关系,揭示其潜在分子机制,为CRC的靶向治疗提供新的理论依据。
2. 文献综述解析
作者对现有研究的评述逻辑围绕三个核心维度展开:RUNX1在CRC中的功能、TAMs的极化状态与肿瘤进展的关系、血管生成的调控机制。现有研究结论显示,RUNX1在多种实体肿瘤中扮演“双重角色”,既可作为癌基因也可作为抑癌基因,而在CRC中其主要发挥促癌作用,通过激活多条信号通路促进肿瘤增殖、转移及化疗耐药;TAMs是TME中最丰富的免疫细胞群体,根据极化状态可分为促炎的M1型和促肿瘤的M2型,其中M2型TAMs通过分泌细胞因子(如IL-10、VEGF)促进血管生成、免疫逃逸及肿瘤进展,但RUNX1与TAMs的相互作用尚未被报道;血管生成是CRC恶性进展的关键环节,目前已知VEGF等因子是主要调控者,但RUNX1对血管生成的直接或间接调控作用仍缺乏研究。
现有研究的局限性在于,缺乏RUNX1对CRC血管生成的具体机制探讨,以及RUNX1与TAMs相互作用在血管生成中的角色解析。本研究的创新价值在于,首次揭示了RUNX1通过促进趋化因子CCL2分泌和Hedgehog通路激活,招募并诱导TAMs向M2型极化,进而通过M2型TAMs分泌的血小板衍生生长因子BB(PDGF-BB)促进肿瘤血管生成,同时PDGF-BB可反式激活RUNX1表达,形成正反馈环路,这一发现填补了RUNX1在CRC血管生成中作用的空白,为CRC的联合靶向治疗提供了新的思路。
3. 研究思路总结与详细解析
本研究的整体框架围绕“RUNX1介导的CRC细胞与TAMs串扰对血管生成的影响及机制”展开,研究目标是明确RUNX1在CRC血管生成中的作用及与TAMs的相互作用机制,核心科学问题包括:RUNX1如何调控TAMs的招募与极化?RUNX1-TAMs串扰如何影响血管生成?其潜在分子通路是什么?技术路线遵循“生物信息学分析→临床样本验证→细胞实验机制探究→动物实验验证”的闭环逻辑。
3.1 生物信息学与临床样本验证
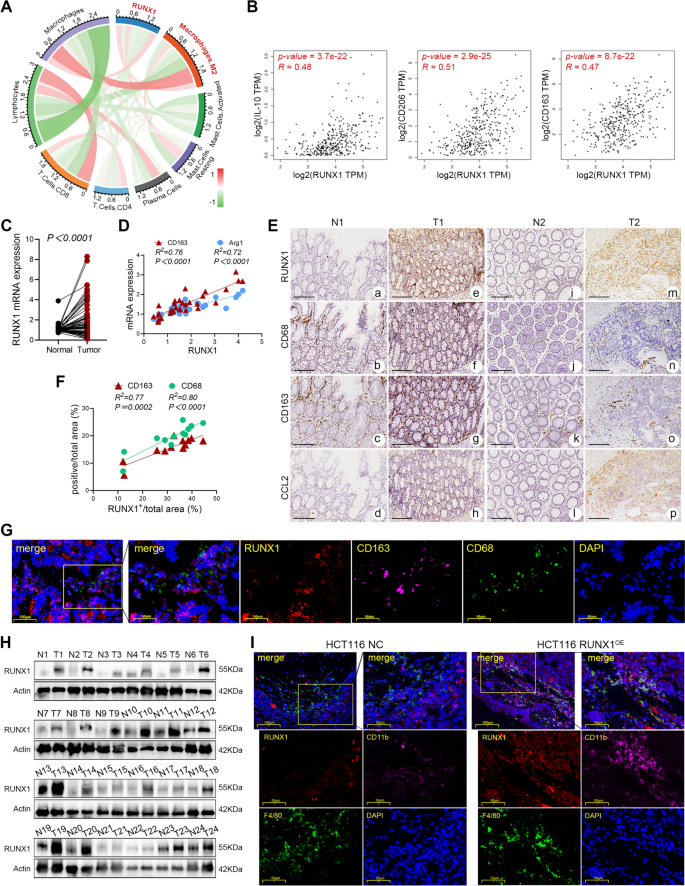
实验目的是通过生物信息学和临床样本分析,明确RUNX1与TAMs浸润、血管生成的相关性。方法上,利用TCGA、GEPIA、TIMER等数据库分析RUNX1与免疫细胞标记物(如CD163、CD206、IL-10)、血管生成相关基因(如SELE、CDH5、KDR)的表达关联;收集66对CRC临床样本进行qRT-PCR检测RUNX1 mRNA表达,24对样本进行Western blotting验证,12对样本进行免疫组化(IHC)分析RUNX1与TAMs标记物(CD68、CD163)、血管生成标记物(CD31)的相关性;通过多重免疫荧光(IF)染色验证RUNX1在肿瘤组织中的细胞定位。结果显示,RUNX1在CRC肿瘤组织中mRNA和蛋白水平均显著高表达(n=66,P<0.0001;n=24,20/24样本高表达);数据库分析及临床样本验证表明,RUNX1表达与M2型TAMs标记物(CD163、CD206、IL-10)呈正相关(P<0.05),与血管生成标记物(CD31)也呈正相关(P<0.05);多重IF染色显示RUNX1高表达位于肿瘤细胞而非巨噬细胞。实验所用关键产品:RUNX1抗体(Proteintech,25315-1-AP)、CD163抗体(ZSGB-BIO,ZM-0428)、CD31抗体(Proteintech,28083-1-AP)。
3.2 CRC细胞RUNX1对TAMs招募与极化的影响
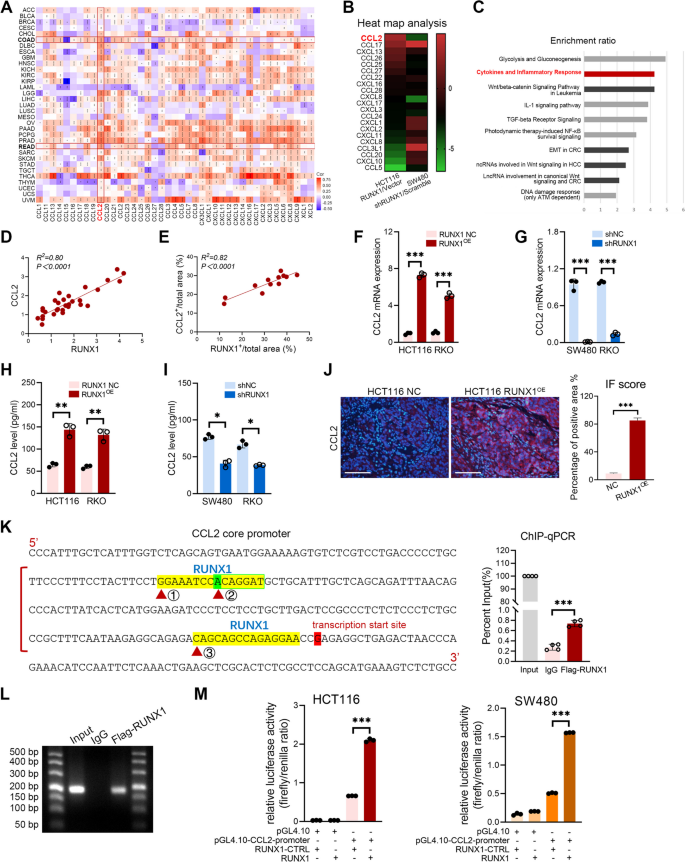
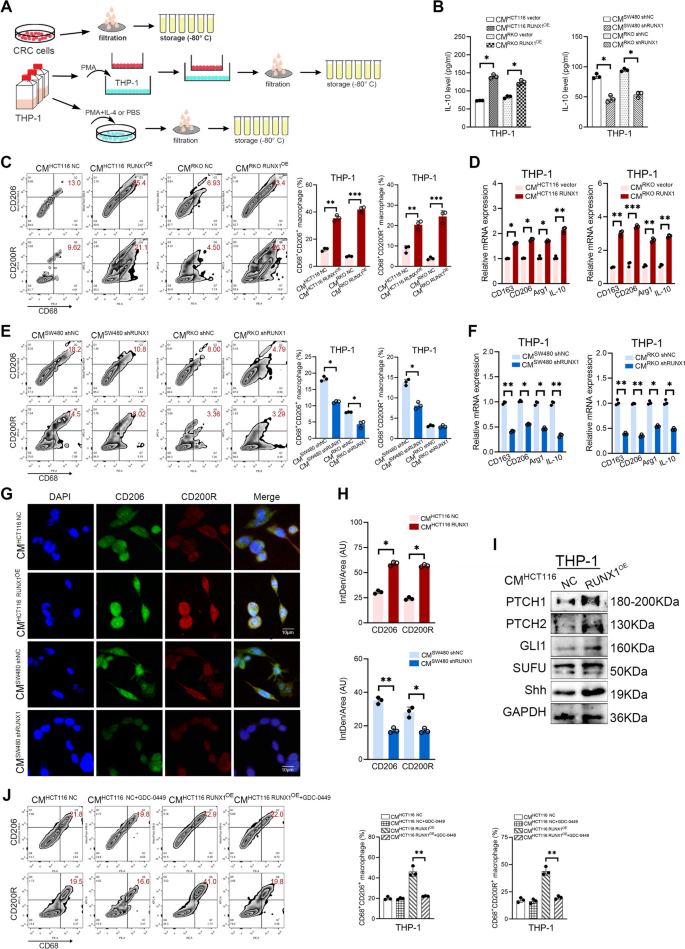
实验目的是验证RUNX1是否通过分泌CCL2招募TAMs并诱导其向M2型极化。方法上,构建RUNX1过表达(HCT116、RKO)和敲低(SW480、RKO)CRC细胞系,收集条件培养基(CMs)处理THP-1细胞(经PMA诱导为M0型巨噬细胞);通过ELISA检测CMs中CCL2水平,ChIP-qPCR和双荧光素酶报告实验验证RUNX1对CCL2启动子的结合与调控;Flow cytometry检测THP-1细胞M2型标记物(CD68+CD206+、CD68+CD200R+)的表达,qRT-PCR检测M2相关基因(CD163、CD206、Arg1、IL-10)的mRNA水平,Western blotting检测Hedgehog通路分子(PTCH1、GLI1、Shh)的表达,并用Hedgehog通路抑制剂GDC-0449进行rescue实验。结果显示,RUNX1过表达显著增加CCL2的mRNA和蛋白水平(P<0.05),且RUNX1可直接结合CCL2启动子的ACAGGAT区域(ChIP-qPCR验证);RUNX1过表达CMs处理后,THP-1细胞中M2型标记物及相关基因表达显著升高(P<0.05),Hedgehog通路分子表达激活,而GDC-0449处理可显著降低M2型细胞比例(P<0.01);RUNX1敲低则呈现相反结果。实验所用关键产品:PMA(分化THP-1)、GDC-0449(Hedgehog抑制剂)、CCL2抗体(Proteintech,25542-1-AP)。
3.3 RUNX1介导的CRC细胞与TAMs串扰对血管生成的影响
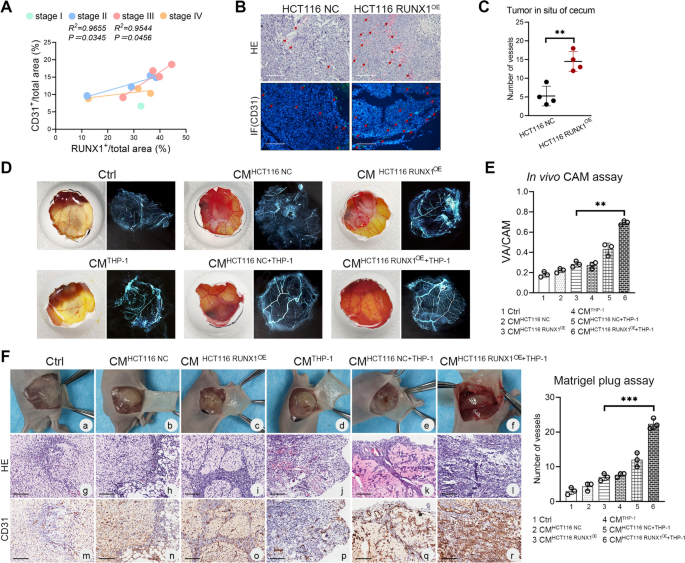
实验目的是探究RUNX1-TAMs串扰对CRC血管生成的作用。方法上,将RUNX1过表达/敲低CRC细胞与THP-1细胞共培养,收集共培养CMs处理人脐静脉内皮细胞(HUVEC),进行细胞增殖(CCK-8)、迁移(Transwell)、侵袭(Transwell)及管形成(Matrigel)实验;通过鸡胚绒毛尿囊膜(CAM)实验、裸鼠Matrigel plug实验及原位瘤模型,检测体内血管生成情况;用PDGF-BB中和抗体验证其在血管生成中的作用。结果显示,RUNX1过表达共培养CMs显著促进HUVEC的增殖(P<0.05)、迁移(P<0.01)、侵袭(P<0.001)及管形成(P<0.001),而PDGF-BB中和抗体可逆转这些效应;体内实验中,RUNX1过表达组CAM血管面积比例(P<0.01)、Matrigel plug血管数目(P<0.001)及原位瘤血管密度(P<0.01)均显著高于对照组。实验所用关键产品:Matrigel(Corning,354248)、HUVEC细胞、PDGF-BB中和抗体。
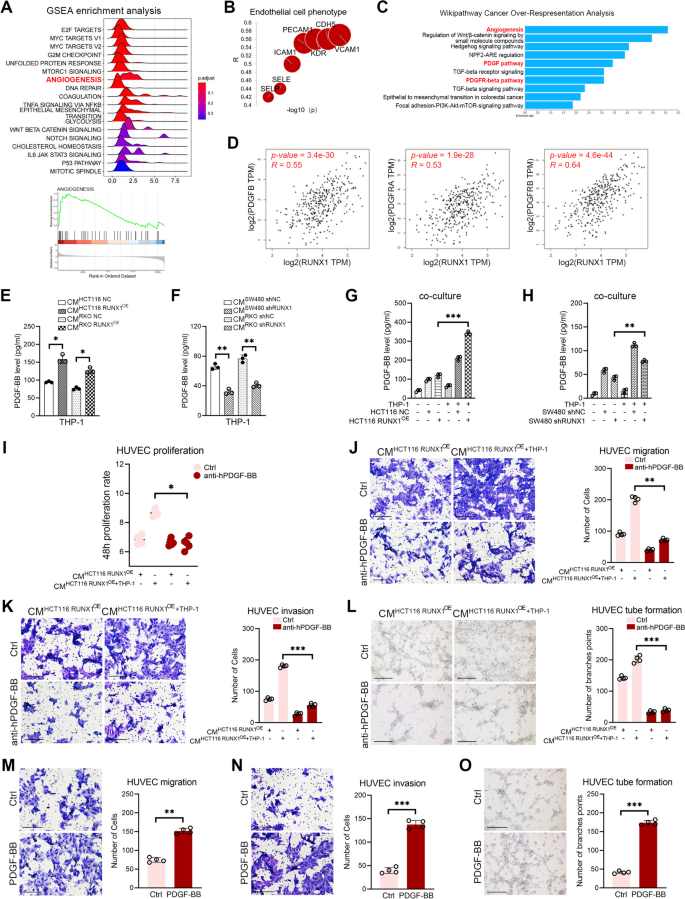
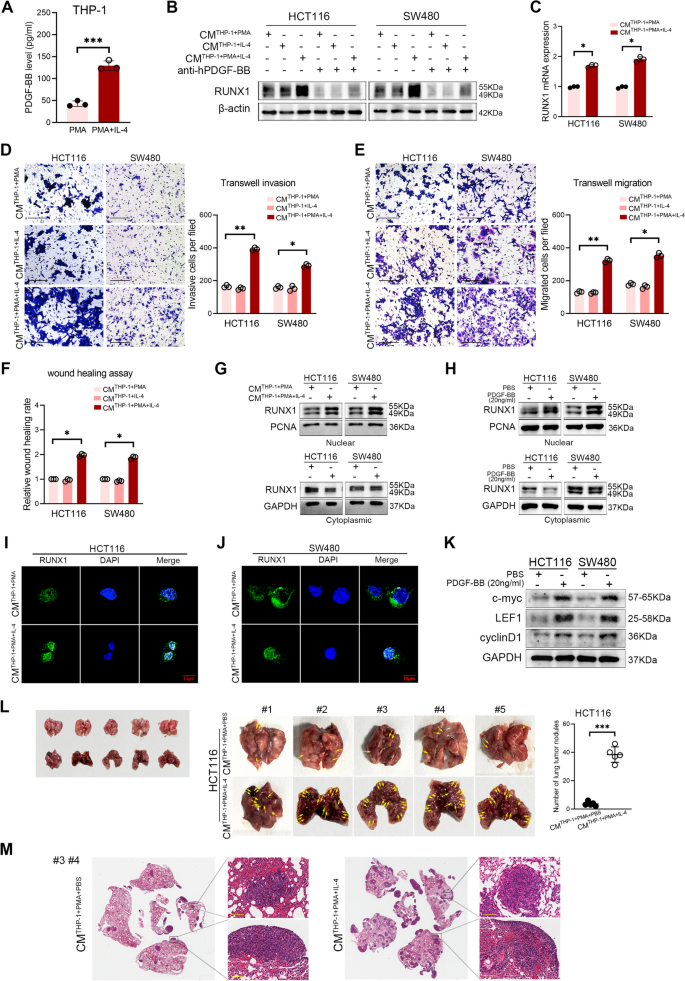
3.4 PDGF-BB对CRC细胞RUNX1表达及恶性行为的影响
实验目的是验证PDGF-BB对RUNX1的反馈调控及对CRC恶性行为的影响。方法上,用IL-4诱导THP-1细胞为M2型,收集CMs处理CRC细胞(HCT116、SW480),或用外源性PDGF-BB处理,通过WB、qRT-PCR检测RUNX1的mRNA和蛋白水平;进行迁移(Transwell)、侵袭(Transwell)及伤口愈合实验验证CRC细胞恶性行为;通过Western blotting检测RUNX1在细胞质和细胞核中的分布,以及Wnt/β-catenin通路分子(c-myc、LEF1、cyclinD1)的表达;构建裸鼠肺转移模型,验证PDGF-BB对CRC转移的影响。结果显示,M2型TAMs CMs或外源性PDGF-BB可显著增加RUNX1的mRNA和蛋白水平(P<0.05),并促进其核转位;PDGF-BB处理显著增强CRC细胞的迁移、侵袭及伤口愈合能力(P<0.05),同时激活Wnt/β-catenin通路;肺转移模型显示,M2型CMs处理的CRC细胞肺转移结节数目显著增加(n=5,P<0.001)。实验所用关键产品:IL-4(诱导M2极化)、PDGF-BB蛋白、Wnt通路分子抗体(c-myc、LEF1、cyclinD1)。
4. Biomarker研究及发现成果解析
Biomarker定位:本研究中RUNX1作为CRC血管生成与TAMs串扰的功能性生物标志物,其筛选与验证逻辑遵循“数据库分析→临床样本验证→细胞/动物实验机制验证”的完整链条。研究过程中,RUNX1的来源为CRC临床样本及细胞系,验证方法包括:通过qRT-PCR和Western blotting检测其在肿瘤组织中的表达水平;通过IHC和IF染色分析其与TAMs标记物、血管生成标记物的相关性;通过细胞实验验证其对TAMs极化和血管生成的调控作用;通过动物实验验证其在体内的功能。
特异性与敏感性方面,临床样本中RUNX1高表达与M2型TAMs浸润(CD163、CD206)、血管生成(CD31)呈显著正相关(P<0.05),提示其作为M2型TAMs和血管生成的关联标志物具有较好的特异性;数据库分析显示RUNX1在CRC中的表达显著高于正常组织(GEPIA分析),临床样本中RUNX1 mRNA高表达率达83.3%(55/66),提示其具有一定的敏感性。
核心成果方面,RUNX1被证实是CRC血管生成的关键调控因子,通过与M2型TAMs的串扰促进血管生成,并通过PDGF-BB形成正反馈环路,增强肿瘤恶性行为;统计学结果显示,临床样本中RUNX1 mRNA在肿瘤组织中显著高表达(n=66,P<0.0001),与CD163 mRNA表达呈正相关(n=30,P<0.05);动物实验中,RUNX1过表达组原位瘤血管数目显著增加(n=3,P<0.01),M2型CMs处理组肺转移结节数目显著增加(n=5,P<0.001)。本研究首次将RUNX1与TAMs串扰及血管生成关联,为CRC的靶向治疗提供了新的潜在biomarker。