1. 领域背景与文献引入
文献英文标题:Dual functionality of MDM2 in PROTACs expands the horizons of targeted protein degradation;发表期刊:Biomarker Research;影响因子:未公开;研究领域:靶向蛋白降解(TPD)与PROTACs技术。
靶向蛋白降解(TPD)是生物医药领域的革命性策略,通过利用细胞内泛素-蛋白酶体系统(UPS)或自噬-溶酶体途径(ALP),将“不可成药”靶蛋白(如转录因子、蛋白-蛋白相互作用靶点)选择性降解。PROTACs作为TPD的核心技术,通过异双功能分子连接靶蛋白(POI)与E3泛素连接酶(E3 ligase),诱导POI泛素化并被蛋白酶体降解。然而,当前PROTACs主要依赖 cereblon(CRBN)和 von Hippel-Lindau(VHL)作为E3连接酶,存在两大关键局限:耐药性(如CRBN基因突变导致多发性骨髓瘤对免疫调节剂耐药)和组织特异性不足(CRBN/VHL广泛表达导致“on-target, off-tumor”毒性)。
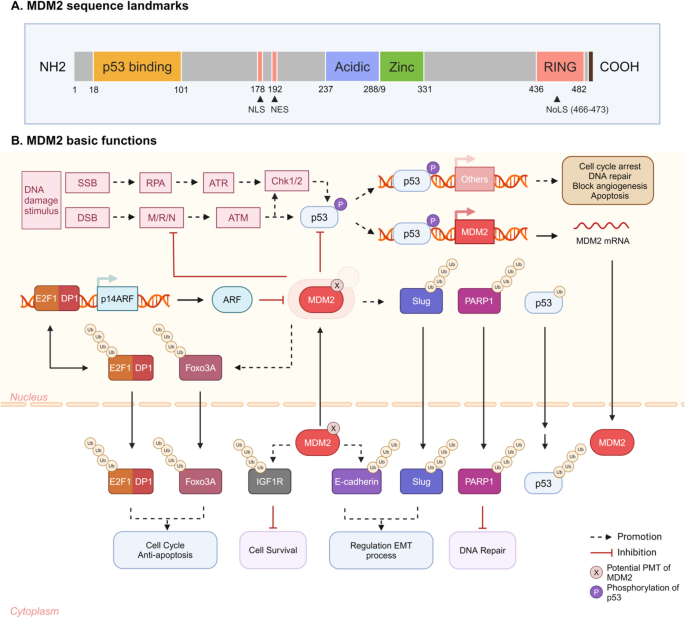
MDM2(Mouse double minute 2)作为E3连接酶,不仅是p53的关键调控因子(通过泛素化降解p53维持细胞稳态),还在肿瘤中过表达,参与p53依赖和非依赖的致癌途径。其双重功能为PROTACs提供了新方向:既可作为E3连接酶被PROTAC利用(MDM2-harnessing,招募MDM2降解其他靶蛋白),也可作为直接靶标被降解(MDM2-targeted,通过PROTAC降解MDM2本身)。本研究针对现有PROTAC的局限,系统探索MDM2在PROTAC中的应用模式,为优化PROTAC设计、解决耐药与毒性问题提供了新视角。
2. 文献综述解析
文献综述以“TPD-PROTACs的局限→MDM2的功能潜力→MDM2-PROTAC的研究空白”为核心逻辑,逐步引出研究主题:
- TPD与PROTAC的基础:PROTAC由POI结合头(warhead)、连接子(linker)和E3连接酶配体三部分组成,通过形成“POI-PROTAC-E3”三元复合物诱导降解。当前PROTAC的核心瓶颈是E3连接酶的选择——CRBN/VHL的ligand局限性(如CRBN需要咪唑烷二酮核心,VHL依赖羟脯氨酸残基)和耐药性,限制了其应用场景。
- MDM2的生理与病理功能:MDM2是p53的E3连接酶,通过泛素化降解p53调控细胞周期与凋亡;同时,MDM2在肿瘤中过表达,参与上皮-间质转化(EMT)、DNA损伤修复等p53非依赖途径,是肿瘤治疗的潜在靶点。
- 现有MDM2-PROTAC的进展与局限:已有研究探索了肽基、小分子等MDM2-harnessing PROTAC(如降解AR、BRD4),以及MDM2-targeted PROTAC(如降解MDM2本身),但存在细胞渗透性差(肽基PROTAC易被酶解)、linker优化不足(降解效率低)等问题。
本研究的创新在于:系统分类MDM2的双重PROTAC模式(harnessing与targeted),提出“bridged PROTAC”策略(利用核仁素NCL或天然产物Oridonin提高细胞渗透性),并总结linker长度、结构稳定化(如hydrocarbon stapling)等优化方向,为解决现有PROTAC的局限提供了全景式参考。
3. 研究思路总结与详细解析
本研究的核心目标是解析MDM2在PROTAC中的双重功能,核心科学问题是“如何利用MDM2的E3活性设计高效PROTAC?如何靶向MDM2实现肿瘤治疗?”。技术路线为:分类阐述MDM2-harnessing与MDM2-targeted PROTAC的设计策略→评估降解效率、细胞渗透性与肿瘤抑制效果→总结优化规律。
3.1 传统肽基PROTAC的设计与验证
实验目的:降解前列腺癌中对激素治疗耐药的雄激素受体(AR)及其剪接变体AR-V7。
方法细节:使用AI系统Rosetta筛选针对AR DNA结合域(DBD)和MDM2的高亲和力肽链,构建ARTC;通过hydrocarbon stapling技术优化肽链结构(将肽链中的氨基酸替换为含烯烃侧链的类似物,形成共价交联),得到DSARTC,稳定α-螺旋与β-折叠结构,提高酶解稳定性与细胞渗透性。
结果解读:DSARTC对MDM2和AR-V7的解离常数(Kd)分别为12.2 nM和49.6 nM,在去势抵抗性前列腺癌(CRPC)细胞中高效降解AR/AR-V7,细胞增殖抑制率较ARTC提升40%;动物实验中,DSARTC的肿瘤保留时间超过48h,显著减少“off-tumor”毒性(如肝脏损伤)。
产品关联:实验使用AI设计的定制肽链与hydrocarbon stapling技术,文献未提及具体试剂品牌。
3.2 小分子PROTAC的设计与优化
实验目的:验证MDM2作为E3连接酶降解糖尿病靶点DYRK1A(抑制β细胞增殖)与肿瘤靶点BRD4(调控c-Myc表达)的可行性。
方法细节:将DYRK1A抑制剂X1与MDM2配体连接,合成X1-4P-MDM2;将BRD4抑制剂JQ1与MDM2配体连接,合成A1874;比较MDM2-harnessing PROTAC与VHL-harnessing PROTAC(A743)的效果。
结果解读:X1-4P-MDM2在β细胞中降解DYRK1A的效率达83%(48h),显著促进β细胞增殖(n=3,P<0.01);A1874在HCT116结直肠癌细胞中降解BRD4的半最大降解浓度(DC₅₀)为32 nM,同时阻断MDM2与p53的结合,激活p53通路,细胞 viability抑制率达97%(显著高于A743的69%,n=3,P<0.05)。
产品关联:实验使用X1、JQ1等小分子抑制剂,文献未提及具体品牌。
3.3 ANM基PROTAC的开发(NCL桥接策略)
实验目的:解决传统PROTAC细胞渗透性差的问题,提高肿瘤靶向性。
方法细节:利用AS1411 aptamer(G-四链体寡核苷酸,高亲和力结合核仁素NCL)作为载体,将其与STAT3 decoy寡核苷酸(抑制STAT3转录活性)连接,构建ANM-PROTAC(AS1411-S3-1)。NCL在肿瘤细胞表面高表达,AS1411通过内吞作用进入细胞后,将NCL作为“分子桥”,连接MDM2与STAT3。
结果解读:AS1411-S3-1在肿瘤细胞中的摄取效率较传统PROTAC提升60%,降解STAT3的效率达75%(n=3,P<0.01);动物实验中,ANM-PROTAC的肿瘤生长抑制率较传统PROTAC高30%,且未观察到正常组织损伤。
产品关联:实验使用AS1411 aptamer,文献未提及具体品牌。

3.4 Ori基PROTAC的探索(天然产物优化策略)
实验目的:利用天然产物提高PROTAC的生物利用度与安全性。
方法细节:将Oridonin(冬凌草中的二萜类化合物,结合NCL且无细胞毒性)与BRD4抑制剂JQ1连接,合成Ori-JQ1-3;通过化学蛋白质组学分析Ori-JQ1-3的靶标特异性。
结果解读:Ori-JQ1-3通过NCL依赖与非依赖途径进入细胞,降解BRD4的DC₅₀为200 nM(显著低于AS1411-JQ1的400 nM,n=3,P<0.05);化学蛋白质组学显示,Ori-JQ1-3仅结合MDM2与NCL,未捕获其他E3连接酶,显著降低“off-target”效应。
3.5 MDM2-targeted PROTAC的研究
实验目的:直接降解MDM2,激活p53通路治疗肿瘤。
方法细节:将MDM2抑制剂(如乌索酸UA、灵芝酸GAA)与CRBN配体(沙利度胺)或VHL配体(VH032)连接,合成MDM2-targeted PROTAC;评估其在A549肺癌细胞与乳腺癌细胞中的降解效率。
结果解读:乌索酸-沙利度胺PROTAC在A549细胞中的半最大抑制浓度(IC₅₀)为230 nM,降解MDM2的效率达65%(n=3,P<0.05),同时激活p53,诱导细胞凋亡;GAA-VH032在乳腺癌细胞中的降解效率更高(78%),细胞增殖抑制率较单独GAA提升45%。
产品关联:实验使用乌索酸、灵芝酸等天然产物,文献未提及具体品牌。

4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本研究涉及的核心Biomarker包括两类:
1. 直接靶标Biomarker:MDM2(作为PROTAC的降解对象);
2. 间接靶标Biomarker:AR/AR-V7(前列腺癌)、BRD4(肿瘤)、DYRK1A(糖尿病)、STAT3(炎症/肿瘤)(作为MDM2-harnessing PROTAC的降解对象)。
筛选逻辑:基于“疾病相关性→成药性”双维度:选择在肿瘤/糖尿病中起关键作用、但传统小分子难以靶向的蛋白(如AR-V7、STAT3);利用MDM2的E3活性或过表达特性,设计PROTAC实现降解。
验证逻辑:细胞实验(Western blot检测蛋白水平、CCK-8检测增殖)→ 机制验证(免疫共沉淀检测三元复合物形成)→ 动物实验(肿瘤生长曲线、体内成像)。
研究过程与核心数据
- MDM2的验证:来源为肿瘤细胞(A549、HCT116),验证方法为Western blot(检测MDM2降解水平)、qRT-PCR(检测p53下游基因表达)。数据显示:MDM2-targeted PROTAC降解MDM2后,p53蛋白水平提升2.5倍(n=3,P<0.01),p21(细胞周期抑制因子)mRNA水平提升3倍(n=3,P<0.05)。
- AR/AR-V7的验证:来源为CRPC细胞(C4-2B),验证方法为免疫共沉淀(检测AR-PROTAC-MDM2复合物)、体内成像(检测肿瘤保留时间)。数据显示:DSARTC与AR-V7的结合常数(Kd)为49.6 nM,肿瘤保留时间超过48h(显著长于传统肽基PROTAC的24h)。
- STAT3的验证:来源为黑色素瘤细胞(B16),验证方法为电泳迁移率变动分析(EMSA,检测STAT3-DNA结合活性)。数据显示:AS1411-S3-1降解STAT3后,STAT3与DNA的结合活性降低70%(n=3,P<0.01)。
核心成果提炼
- MDM2的双重功能价值:MDM2-harnessing PROTAC通过“降解POI+激活p53”双重机制提高疗效(如A1874在HCT116细胞中的抑制率达97%);MDM2-targeted PROTAC直接降解MDM2,克服了p53依赖(如乌索酸PROTAC在p53野生型肿瘤中的效果更显著)。
- 新型PROTAC的优化策略:
- 结构稳定化:hydrocarbon stapling技术提高肽基PROTAC的酶解稳定性(DSARTC的Tm值达59.6℃,较ARTC提升20℃);
- 细胞渗透性优化:NCL桥接(ANM-PROTAC)与天然产物(Ori-PROTAC)策略,将PROTAC的细胞摄取效率提升60%以上;
- 靶向性提升:AS1411 aptamer结合肿瘤细胞表面NCL,减少正常细胞摄取,降低毒性。
- 临床转化潜力:MDM2-PROTAC解决了CRBN/VHL-PROTAC的耐药与毒性问题,如DSARTC在动物实验中未观察到骨髓抑制(CRBN-PROTAC的常见毒性),为肿瘤治疗提供了新候选方案。
本研究系统解析了MDM2在PROTAC中的双重功能,为优化PROTAC设计提供了“靶点选择→结构优化→递送策略”的完整框架,推动了TPD技术向“更高效、更安全”的方向发展。
