1. 领域背景与文献引入
文献英文标题:The involvement of krüppel-like transcription factor 2 in megakaryocytic differentiation induction by phorbol 12-myrestrat 13-acetate;发表期刊:Biomarker Research;影响因子:未公开;研究领域:巨核细胞分化调控。
巨核细胞分化是造血干细胞向血小板生成的关键步骤,其过程由造血干细胞经巨核细胞-红细胞祖细胞(MEP)、集落形成单位-巨核细胞(CFU-MK)逐步成熟为巨核细胞,最终释放血小板。该过程的异常会导致血小板生成障碍,如异基因造血干细胞移植(allo-HSCT)后常见的持续性血小板减少症(PT),其发病率达5%-37%,严重影响患者预后。当前研究热点聚焦于转录因子在巨核细胞分化中的时空调控作用,其中克罗姆样转录因子家族(KLFs)因参与造血细胞增殖与分化而成为研究重点。已有研究表明,KLF1调控红细胞成熟、KLF4调控造血干细胞功能,但KLF2在巨核细胞分化中的功能及机制尚未明确。针对这一研究空白,本研究旨在探究KLF2在佛波酯12-肉豆蔻酸酯13-乙酸酯(PMA,巨核细胞分化诱导剂)诱导的巨核细胞分化中的作用,并解析其分子机制,为血小板减少症的靶向干预提供新的理论依据。
2. 文献综述解析
文献综述围绕“巨核细胞分化的转录调控”与“KLF2的功能研究现状”展开逻辑评述。作者首先总结巨核细胞分化的复杂性:受多种转录因子时空调控,如GATA-1、NF-E2等;随后介绍KLF家族的共性特征(C2H2型锌指结构、结合GC-rich DNA序列)及功能多样性,如KLF1调控红细胞成熟、KLF4调控干细胞自我更新;进一步指出KLF2在其他细胞分化中的作用,如促进胚胎红细胞前体细胞成熟、内皮细胞分化,但KLF2在巨核细胞分化中的角色尚未报道。现有研究的关键结论是KLF家族是造血分化的重要调控因子,但KLF2在巨核细胞中的功能缺失;技术方法的优势在于利用公共数据库(BloodSpot、GEO)筛选差异基因,结合细胞模型验证,但局限性是缺乏KLF2在巨核细胞中的功能及机制研究。本研究的创新点在于首次明确KLF2在PMA诱导的巨核细胞分化中的促进作用,并通过组学技术鉴定其直接靶基因CHN1和KCNQ5,填补了KLF2在巨核细胞分化调控中的研究空白。
3. 研究思路总结与详细解析
本研究的整体框架为“数据库筛选→细胞模型验证→功能实验→组学解析→靶基因验证”,旨在回答“KLF2是否调控巨核细胞分化?如何调控?”的核心科学问题。技术路线以PMA诱导的K562/HEL细胞巨核细胞分化模型为基础,通过慢病毒调控KLF2表达,结合流式细胞术、形态学染色、蛋白质免疫印迹(Western blot)验证功能,再利用RNA测序(RNA-seq)和染色质免疫沉淀测序(ChIP-seq)鉴定靶基因,最终通过小干扰RNA(siRNA)验证靶基因功能。
3.1 KLF家族在巨核细胞分化中的表达模式分析
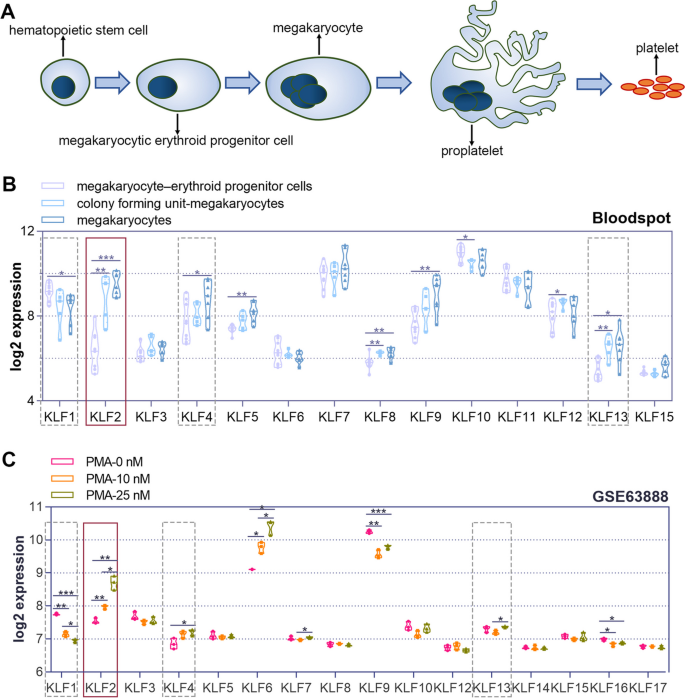
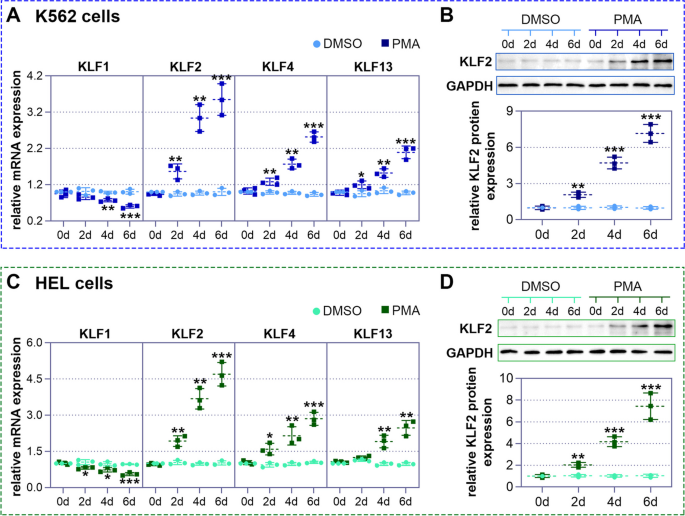
实验目的是筛选巨核细胞分化过程中差异表达的KLF家族成员。方法上,首先从BloodSpot数据库获取正常造血细胞(MEP、CFU-MK、巨核细胞)的KLFs表达数据,从GEO数据库(GSE63888)获取PMA处理K562细胞的KLFs表达数据;随后用25 nM PMA处理K562和HEL细胞(0、2、4、6天),通过实时聚合酶链式反应(实时PCR)检测KLF1、KLF2、KLF4、KLF13的mRNA水平,Western blot检测KLF2的蛋白水平。结果显示,KLF2在正常巨核细胞中的表达高于MEP和CFU-MK(BloodSpot数据库);PMA处理K562细胞6天后,KLF2 mRNA水平较0天升高约3倍,蛋白水平升高约2.5倍(n=3,P<0.01);HEL细胞中呈现类似趋势(图1、图2)。实验所用关键产品:KLF2抗体(Thermofisher,货号PA5-40591)、实时PCR引物(定制)。
3.2 KLF2对巨核细胞分化的功能验证
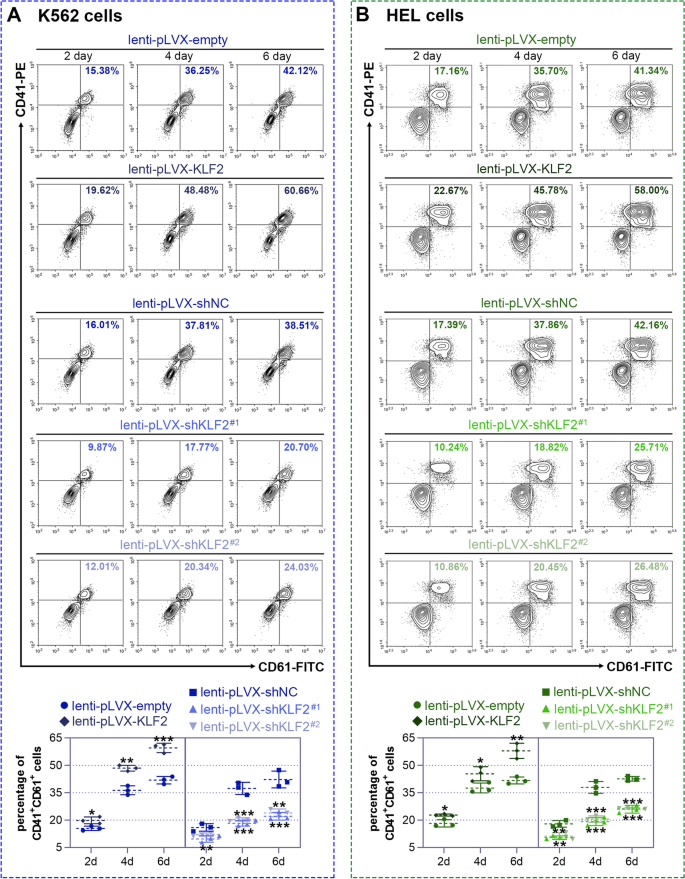
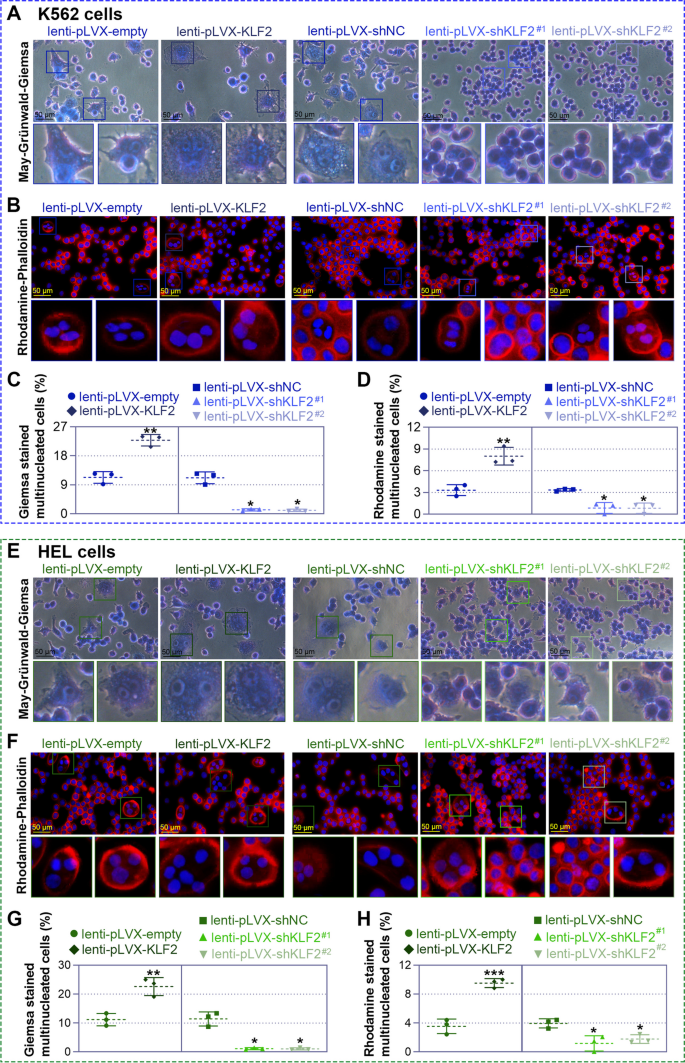
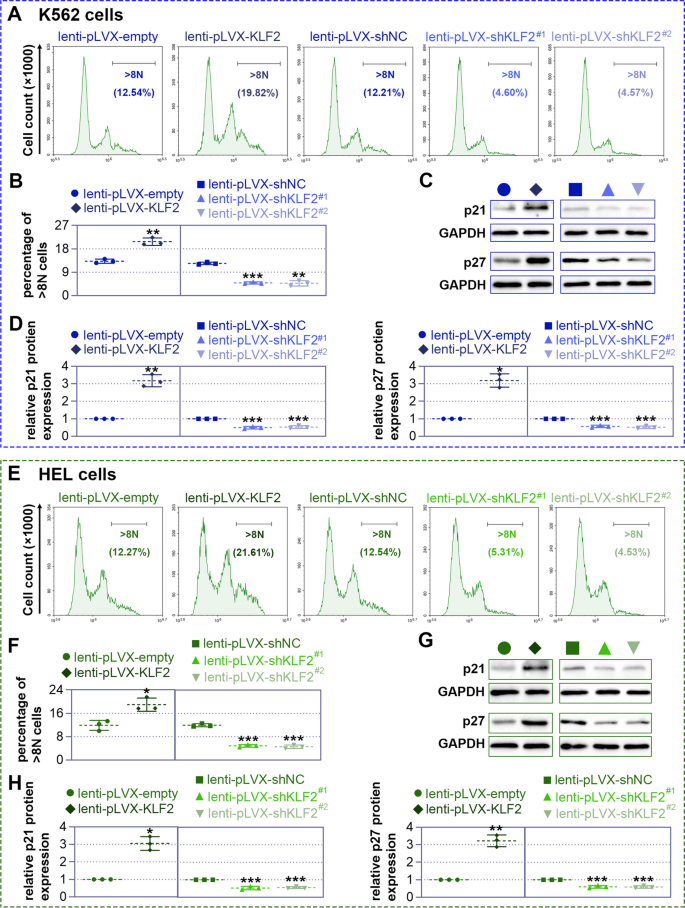
实验目的是明确KLF2对巨核细胞分化的调控作用。方法上,通过慢病毒载体构建KLF2过表达(lenti-pLVX-KLF2)和敲低(lenti-pLVX-shKLF2#1/#2)细胞模型,感染K562/HEL细胞72小时后,用25 nM PMA诱导分化;通过流式细胞术检测巨核细胞表面标志物CD41(血小板膜糖蛋白Ⅱb)/CD61(血小板膜糖蛋白Ⅲa)的阳性细胞比例,May-Grünwald-Giemsa染色观察细胞形态,鬼笔环肽染色检测多核化,碘化丙啶(PI)染色流式检测多倍体(>8N)比例,Western blot检测分化相关蛋白p21、p27的表达。结果显示,过表达KLF2使K562细胞CD41/CD61阳性比例较对照组增加约1.8倍(6天,n=3,P<0.05),多核细胞数增加约2倍,>8N细胞比例升高约1.5倍,p21、p27蛋白水平升高约2倍;敲低KLF2则呈现相反结果(图3、图4、图5)。实验所用关键产品:CD41抗体(Thermo Fisher)、CD61抗体(Proteintech)、p21抗体(ABclonal,货号A19094)、p27抗体(ABclonal,货号A5357)。
3.3 KLF2靶基因的鉴定与验证
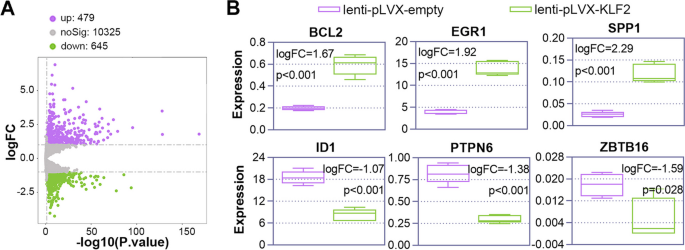
实验目的是解析KLF2调控巨核细胞分化的分子机制。方法上,对KLF2过表达的K562细胞进行RNA-seq(筛选差异表达基因:p<0.05、|log2折叠变化|>1)和ChIP-seq(检测KLF2结合的启动子区域),通过Venn图交集筛选KLF2的直接靶基因;随后用siRNA敲低靶基因Chimerin 1(CHN1)和钾电压门控通道Q亚家族成员5(KCNQ5),检测CD41/CD61阳性细胞比例。结果显示,RNA-seq筛选到1124个差异基因(479上调、645下调),ChIP-seq鉴定到75个KLF2结合的启动子区域基因,两者交集得到CHN1和KCNQ5(图6、图7);敲低CHN1或KCNQ5使K562细胞CD41/CD61阳性比例较对照组降低约40%(n=3,P<0.05)(图8)。实验所用关键产品:RNA-seq试剂盒(Illumina HiSeqTM)、ChIP-seq试剂盒(Illumina NovaSeq 6000)、CHN1 siRNA(JTS Scientific)、KCNQ5 siRNA(JTS Scientific)。


4. Biomarker研究及发现成果解析
本研究涉及的生物标志物(Biomarker)包括“调控型Biomarker”KLF2及“靶标型Biomarker”CHN1、KCNQ5。KLF2作为转录因子,是巨核细胞分化的关键调控节点;CHN1和KCNQ5作为KLF2的直接靶基因,介导其促分化作用。
Biomarker定位与筛选逻辑
KLF2的筛选逻辑为“公共数据库(BloodSpot、GEO)差异分析→细胞模型(K562/HEL)验证→功能实验确认”;CHN1和KCNQ5的筛选逻辑为“RNA-seq差异基因→ChIP-seq结合启动子区域→Venn图交集→siRNA功能验证”,形成完整的“筛选-验证”链条。
研究过程与数据
KLF2的来源为正常造血细胞(BloodSpot数据库)和PMA诱导的细胞模型(K562/HEL),验证方法包括实时PCR(mRNA水平)、Western blot(蛋白水平)及慢病毒调控后的功能实验;CHN1和KCNQ5的来源为组学联合分析的交集基因,验证方法为siRNA敲低后的流式检测。数据显示:1)BloodSpot数据库中,巨核细胞KLF2表达较MEP高约1.6倍,较CFU-MK高约1.3倍;2)PMA处理K562细胞6天后,KLF2蛋白水平较0天升高约2.5倍(n=3,P<0.01);3)过表达KLF2使CD41/CD61阳性比例较对照组增加约1.8倍(n=3,P<0.05);4)敲低CHN1或KCNQ5使CD41/CD61阳性比例降低约40%(n=3,P<0.05)。
核心成果
1)功能关联:KLF2是巨核细胞分化的正调控因子,过表达促进分化、敲低抑制分化;2)分子机制:CHN1和KCNQ5是KLF2的直接靶基因,介导其促分化作用;3)临床意义:KLF2可能作为血小板减少症的潜在干预靶点,通过上调KLF2或其靶基因促进巨核细胞分化,恢复血小板生成。
本研究的创新性在于首次将KLF2与巨核细胞分化关联,并鉴定其靶基因,为巨核细胞分化的分子调控网络提供了新的节点,也为血小板减少症的靶向治疗提供了新的理论依据。
