1. 领域背景与文献引入
文献英文标题:Gilteritinib: a novel FLT3 inhibitor for acute myeloid leukemia;发表期刊:Biomarker Research;影响因子:未公开;研究领域:急性髓系白血病(AML)靶向治疗(FLT3抑制剂方向)
急性髓系白血病(AML)是成人最常见的急性白血病之一,复发/难治(R/R)患者预后极差,5年生存率不足10%。FLT3(FMS样酪氨酸激酶3)突变是AML中最常见的高危遗传改变,尤其在正常核型AML中突变率高达30%,主要包括内部串联重复(FLT3-ITD)和酪氨酸激酶域(FLT3-TKD)突变。这些突变导致FLT3受体持续激活,驱动白血病细胞增殖、耐药,并显著增加复发风险,因此成为AML靶向治疗的关键靶点。
过去 decade,多个FLT3抑制剂进入临床开发,其中midostaurin(米哚妥林)已获批与化疗联合用于初治FLT3突变AML,但R/R患者仍缺乏有效的单药治疗方案。gilteritinib(ASP2215,Xospata)作为一种口服小分子双抑制剂,可同时抑制FLT3和AXL(与FLT3耐药相关的受体酪氨酸激酶),其Ⅲ期ADMIRAL研究显示,对于R/R FLT3突变AML患者,gilteritinib单药治疗的总生存期(OS)显著长于挽救化疗,可能推动R/R AML治疗范式转变。本文系统总结了gilteritinib用于AML的临床试验进展,为其临床应用提供循证支持。
2. 文献综述解析
作者在综述部分以“FLT3抑制剂的临床开发阶段”为核心分类维度,梳理了AML中FLT3突变的生物学意义及现有FLT3抑制剂的研究现状。现有研究的关键结论包括:FLT3突变是AML的高危生物标志物,与患者耐药、复发及短生存期密切相关;已进入临床的FLT3抑制剂分为早期探索(如lestaurtinib、tandutinib)、联合化疗获批(midostaurin)及单药获批(gilteritinib)三类,其中midostaurin主要用于初治FLT3突变AML的联合化疗,而R/R患者此前缺乏有效的单药治疗选择。
技术方法上,早期FLT3抑制剂多为单靶点抑制剂或处于Ⅰ/Ⅱ期研究阶段,而gilteritinib的双靶点(FLT3/AXL)设计旨在克服FLT3抑制剂的耐药问题(如AXL过表达介导的逃逸)。现有研究的局限性在于,FLT3抑制剂与其他药物(如低甲基化剂、化疗)的联合方案证据不足,尤其缺乏针对老年、无法耐受强化化疗患者的大样本研究。
本研究的创新价值在于,首次系统总结了gilteritinib的临床试验数据,重点突出ADMIRAL研究对R/R FLT3突变AML治疗的范式转变意义,填补了FLT3抑制剂单药治疗R/R AML的综述空白,为临床医生选择治疗方案提供了关键参考。
3. 研究思路总结与详细解析
本研究的核心目标是总结gilteritinib治疗AML的临床试验进展,明确其疗效、安全性及推荐剂量;核心科学问题是“gilteritinib单药或联合方案在FLT3突变AML中的疗效是否优于现有治疗”;技术路线遵循“剂量探索(Ⅰ/Ⅱ期)→ 疗效验证(Ⅲ期)→ 联合方案拓展(Ⅰ/Ⅱ期)”的闭环逻辑。
3.1 Ⅰ/Ⅱ期剂量探索研究(全球与日本队列)
实验目的是确定gilteritinib在R/R AML患者中的最大耐受剂量(MTD)、推荐治疗剂量及安全性。方法细节:全球多中心Ⅰ/Ⅱ期研究(NCT02014558)纳入23例剂量递增队列(剂量20、40、80、120、200、300、450mg/天)和229例剂量扩展队列(120、200mg/天);日本单中心Ⅰ期研究(NCT02181660)纳入24例患者,剂量范围20-300mg/天。
结果解读:全球研究中,450mg/天剂量组出现3级腹泻和天冬氨酸氨基转移酶(ALT)升高(剂量限制性毒性,DLT),MTD确定为300mg/天;剂量扩展队列显示120mg/天的客观缓解率(ORR)达40%,且安全性可控(常见不良事件为腹泻、贫血、乏力),因此推荐120mg/天作为后续研究剂量。日本研究中,120mg/天剂量组出现1例3级肿瘤溶解综合征(TLS),300mg/天剂量组出现2例3级乳酸脱氢酶(LDH)升高、淀粉酶升高及晕厥(DLT),MTD为200mg/天,但120mg/天的ORR达80%(5例FLT3突变患者中4例缓解),因此同样推荐120mg/天作为日本患者的治疗剂量。
实验所用关键产品:文献未提及具体实验产品,领域常规使用FLT3突变检测试剂盒(如PCR法)、血常规及生化检测试剂等。
3.2 Ⅲ期ADMIRAL研究(gilteritinib vs 挽救化疗)
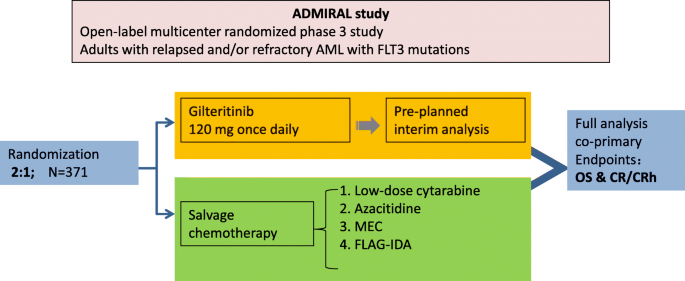
实验目的是验证gilteritinib单药与挽救化疗在R/R FLT3突变AML中的疗效差异。方法细节:该研究为开放标签、多中心、随机对照Ⅲ期试验(NCT03182244),纳入371例R/R FLT3突变AML患者,按2:1随机分配至gilteritinib组(120mg/天,247例)或挽救化疗组(124例,方案包括低剂量阿糖胞苷、阿扎胞苷、MEC、FLAG-IDA)。主要终点为OS和完全缓解伴部分血液学恢复(CR/CRh)。
结果解读:gilteritinib组的中位OS显著长于化疗组(9.3个月 vs 5.6个月, hazard ratio [HR] for death=0.637,P=0.0007);1年OS率分别为37.1%和16.7%。gilteritinib组的CR/CRh率(34%)显著高于化疗组(15.3%,P=0.0001)。安全性方面,gilteritinib组常见严重不良事件为血液学毒性(贫血、发热性中性粒细胞减少、血小板减少),非血液学不良事件包括QT间期延长(9%)、胰腺炎(5%)、分化综合征(3%),多数可通过对症治疗缓解。
3.3 联合方案探索研究(阿扎胞苷与7+3化疗)
实验目的是探索gilteritinib与其他药物联合的安全性及疗效,拓展其在初治或无法耐受强化化疗患者中的应用。方法细节:联合阿扎胞苷的研究(NCT02752035)为多中心、开放标签、3臂研究,首先纳入15例无法耐受强化化疗的初治FLT3突变AML患者(中位年龄76岁),接受gilteritinib(80或120mg/天)联合阿扎胞苷(75mg/m²,d1-7)治疗;联合7+3化疗的研究(NCT02236013)为Ⅰ期剂量递增/扩展研究,纳入62例初治AML患者,接受gilteritinib(40-200mg/天)联合“7+3”化疗(阿糖胞苷+伊达比星/柔红霉素),诱导期gilteritinib给药时间为d4-17(Schedule 1)或d8-21(Schedule 2)。
结果解读:联合阿扎胞苷的安全队列中,120mg/天gilteritinib联合方案无DLT发生,ORR达80%,复合完全缓解(CRc)率67%(10/15),提示该方案对老年无法耐受强化化疗的患者安全有效;联合7+3化疗的研究中,120mg/天gilteritinib联合Schedule 1方案的FLT3突变患者CRc率达100%(17/17),Schedule 2方案(柔红霉素)的患者CRc率也达100%,显示联合强化化疗可显著提高初治FLT3突变患者的缓解率。
实验所用关键产品:文献未提及具体实验产品,领域常规使用化疗药物(阿扎胞苷、阿糖胞苷)、骨髓穿刺针等。
4. Biomarker研究及发现成果解析
本研究的核心生物标志物为FLT3突变(包括FLT3-ITD和FLT3-TKD),筛选逻辑基于AML中FLT3突变的高发性及高危性(领域共识),验证逻辑为通过临床试验中的突变状态分层分析,明确gilteritinib对FLT3突变患者的疗效优势。
Biomarker来源为患者的骨髓或外周血样本,验证方法为聚合酶链反应(PCR)或下一代测序(NGS)检测FLT3基因的突变状态。特异性与敏感性数据:ADMIRAL研究中,371例患者中367例确认FLT3突变(98.7%),其中88.4%为FLT3-ITD,8.4%为FLT3-TKD,1.9%为双重突变;gilteritinib对FLT3-ITD患者的OS获益更为显著(HR=0.637,P=0.0007),而FLT3-TKD患者的疗效趋势一致。
核心成果:FLT3突变是gilteritinib治疗AML的疗效预测生物标志物,gilteritinib治疗FLT3突变R/R AML患者的OS(9.3个月)显著长于挽救化疗(5.6个月,n=371,P=0.0007),CR/CRh率(34%)显著高于化疗组(15.3%,P=0.0001);创新性在于首次通过Ⅲ期随机对照研究确认,FLT3突变可作为R/R AML患者接受gilteritinib单药治疗的疗效预测生物标志物,且gilteritinib是首个针对该生物标志物的获批单药。此外,推测AXL表达可能与gilteritinib的耐药相关,但文献未明确提供具体统计学数据。
