1. 领域背景与文献引入
文献英文标题:Claudin18.2 is a novel molecular biomarker for tumor-targeted immunotherapy;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤靶向免疫治疗(Claudin18.2作为生物标志物及靶向策略方向)。
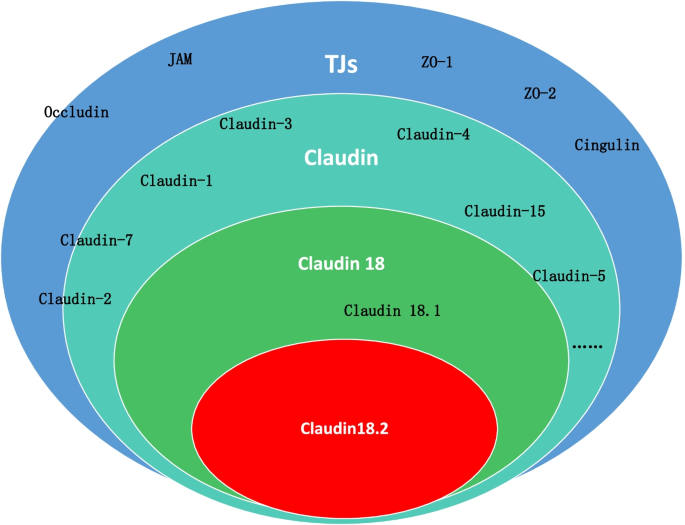
紧密连接蛋白(Claudins)家族是维持上皮细胞间紧密连接的核心组分,通过调控细胞旁通路的分子流动,维持组织屏障功能与细胞极性。Claudin18作为Claudins家族成员,其剪接异构体Claudin18.2具有独特的组织表达谱:正常生理状态下,仅局限于胃黏膜分化上皮细胞的紧密连接中,参与维持胃黏膜H⁺屏障;而在肿瘤发生过程中,细胞极性紊乱导致Claudin18.2暴露于肿瘤细胞表面,在胃癌、胰腺癌、食管癌等多种恶性肿瘤中异常高表达,成为肿瘤特异性靶向位点。
当前肿瘤靶向免疫治疗领域的热点,是开发针对Claudin18.2的精准治疗策略(如单抗、双抗、CAR-T、ADC等)。然而,该领域仍存在核心问题待解决:Claudin18.2的表达调控机制尚未完全阐明;不同肿瘤类型、人群的阳性率差异大,缺乏统一的检测标准;各类靶向治疗的长期疗效、耐药性及安全性需更多临床验证。在此背景下,本文系统总结了Claudin18.2作为肿瘤靶向免疫治疗生物标志物的最新进展,涵盖其生物学特性、肿瘤表达与调控、靶向治疗策略及临床应用,为该领域提供全面参考。
2. 文献综述解析
本文综述以“Claudin18.2的生物学基础-肿瘤表达与调控-靶向治疗策略-挑战与展望”为核心逻辑,对现有研究分层评述:
现有研究的关键结论与局限性
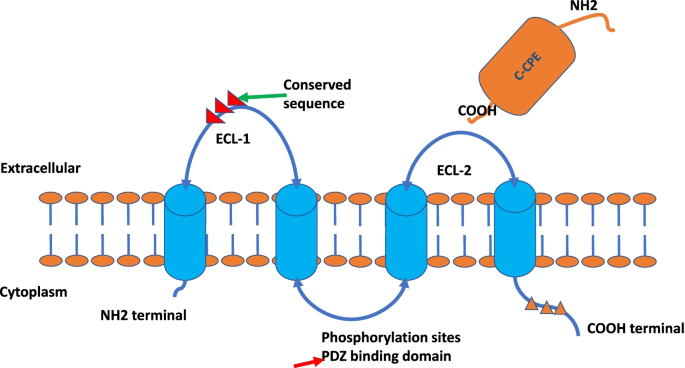
- 生物学特性:Claudin18.2为四跨膜蛋白,包含两个胞外环(ECL-1、ECL-2),C端胞质尾可通过磷酸化调控紧密连接稳定性(如PKA磷酸化Claudin3导致紧密连接破坏);基因敲除小鼠证实其维持胃黏膜屏障的生理功能(敲除后出现胃黏膜萎缩、IL-1β升高)。
- 肿瘤表达与调控:Claudin18.2在胃癌(尤其是弥漫型、EBV阳性亚型)、胰腺癌(59.2%的胰腺导管腺癌阳性)中高表达,与肿瘤增殖、淋巴结转移相关;调控机制包括:转录因子CREB结合启动子区低甲基化CpG岛激活表达、miR-767-3p负调控其3′-UTR、DNA甲基化修饰(如胰腺癌中启动子甲基化抑制表达)。
- 靶向治疗进展:单抗类药物zolbetuximab(IMAB362)联合EOX化疗,显著延长胃癌患者无进展生存期(PFS:7.9 vs 4.8个月,HR=0.47,P<0.001)与总生存期(OS:13.2 vs 8.4个月,HR=0.51,P<0.001);CAR-T细胞CT041在消化系统肿瘤中显示48.6%的客观缓解率(ORR);ADC药物CMG901(Claudin18.2单抗偶联MMAE)在临床前模型中展现强效抗瘤活性。
现有研究的优势在于多维度验证了Claudin18.2的靶向价值,尤其是临床研究初步证实其治疗潜力;局限性包括:检测方法不统一(IHC抗体特异性差异)、阳性阈值混乱(如“阳性”定义为≥1%或≥40%肿瘤细胞表达)、实体瘤CAR-T治疗面临肿瘤微环境 immunosuppression等问题。
本文的创新价值
本文首次将Claudin18.2的基础研究与临床转化数据系统整合,不仅梳理了其生物学特性与调控机制,更重点总结了各类靶向策略的临床进展,为解决“如何精准筛选Claudin18.2阳性患者”“哪种治疗策略更具优势”等关键问题提供了依据。
3. 研究思路总结与详细解析
整体框架概括
研究目标:全面总结Claudin18.2作为肿瘤靶向免疫治疗生物标志物的研究现状与未来方向;
核心科学问题:Claudin18.2的分子结构与功能、肿瘤表达与调控机制、靶向治疗的疗效与安全性;
技术路线:检索Pubmed、ClinicalTrials.gov等数据库,收集基础研究与临床数据,按“结构-表达-治疗-挑战”逻辑整合分析。
3.1 Claudin18.2的生物学特性解析
实验目的:阐明Claudin18.2的分子结构与生理功能。
方法细节:结合小鼠Claudin-15(首个人源Claudin晶体结构)、Claudin-4与C-CPE(产气荚膜梭菌肠毒素C端片段)复合物的晶体结构研究;使用CRISPR-Cas9构建Claudin18基因敲除小鼠,观察胃黏膜屏障功能。
结果解读:Claudin18.2具有典型的四跨膜结构,N端与C端位于胞质内,两个胞外环参与紧密连接形成;其C端磷酸化可调控紧密连接稳定性(如PKA磷酸化Claudin3导致紧密连接破坏);基因敲除小鼠出现胃黏膜萎缩、IL-1β升高,证实其维持H⁺屏障的生理功能。
产品关联:结构研究使用X射线晶体衍射技术(领域常规技术),基因敲除模型使用CRISPR-Cas9(领域常规试剂)。
3.2 Claudin18.2在肿瘤中的表达与调控解析
实验目的:探讨Claudin18.2在不同肿瘤中的表达模式及调控机制。
方法细节:通过TCGA、GEO数据库分析正常与肿瘤组织的Claudin18 mRNA/蛋白表达;细胞实验(胰腺癌细槐春悔胞中使用DNA甲基化抑制剂5-Aza-CdR)验证甲基化对表达的影响;临床样本免疫组化(IHC)检测(105例晚期胃印戒细胞癌)分析表达与临床病理的关联。
结果解读:Claudin18.2在胃癌(弥漫型、EBV阳性亚型)、胰腺癌(59.2%的胰腺导管腺癌阳性)中高表达;其调控机制包括:(1)转录因子CREB结合启动子区低甲基化CpG岛,激活转录;(2)miR-767-3p靶向3′-UTR,负调控表达;(3)DNA甲基化修饰(胰腺癌中启动子甲基化抑制表达)。临床样本显示,Claudin18.2高表达与胃癌的弥漫型亚型、高级别肿瘤相关,且淋巴结转移灶表达高于原发灶。
产品关联:数据库分析使用TCGA、GEO(领域常规数据库),细胞实验使用5-Aza-CdR(DNA甲基化抑制剂,领域常规试剂),IHC检测使用Claudin18.2特异性抗体(如CLAUDETECT 18.2VR试剂盒)。
3.3 靶向Claudin18.2的免疫治疗策略解析
实验目的:评估单抗、双抗、CAR-T、ADC等策略的疗效与安全性。
方法细节:临床前研究使用小鼠异种移植模型(如zolbetuximab抑制胰腺癌细胞移植瘤生长);临床试验包括:(1)zolbetuximab的FAST研究(随机II期,EOX±zolbetuximab一线治疗胃癌);(2)CT041 CAR-T的I期研究(消化系统肿瘤);(3)CMG901 ADC的临床前细胞毒性实验。
结果解读:(1)单抗:zolbetuximab联合EOX显著延长胃癌患者PFS(7.9 vs 4.8个月,HR=0.47,P<0.001)与OS(13.2 vs 8.4个月,HR=0.51,P<0.001);(2)CAR-T:CT041在37例消化系统肿瘤中ORR为48.6%,胃癌患者ORR为57.1%;(3)ADC:CMG901在Claudin18.2阳性胃癌细胞中IC50<1 nM,显著抑制移植瘤生长。
产品关联:提到的关键产品有zolbetuximab(IMAB362)、CT041 CAR-T、CMG901 ADC;未明确的实验使用领域常规试剂(如化疗药物EOX)。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
Claudin18.2是肿瘤靶向免疫治疗的膜蛋白生物标志物,筛选逻辑链为:
1. 差异筛选:正常胃黏膜细胞低表达vs胃癌细胞高表达;
2. 功能验证:细胞实验(knockdown Claudin18.2抑制肿瘤增殖)、动物模型(zolbetuximab抑制移植瘤生长);
3. 临床验证:临床样本IHC(胃癌患者肿瘤组织)与临床试验(如FAST研究)验证疗效相关性。
研究过程与数据
Claudin18.2的来源为肿瘤细胞表面膜蛋白,验证方法包括:
1. 数据库分析:TCGA显示Claudin18 mRNA在胃癌中低表达,但蛋白水平高表达(翻译后调控);
2. 细胞实验:胰腺癌细森陆胞中5-Aza-CdR处理后,Claudin18.2表达上调(甲基化抑制表达);
3. 临床样本IHC:105例胃印戒细胞癌中95.2%阳性,64.8%为中-强阳性;
4. 临床试验:FAST研究中,Claudin18.2阳性(≥40%肿瘤细胞2+表达)患者占48.7%,联合治疗组PFS/OS显著优于化疗组。
特异性与敏感性:不同人群阳性率差异大(Caucasian队列42.2%,亚裔74.4%-87%);FAST研究中,阳性患者联合治疗的PFS HR=0.47(P<0.001),显示高敏感性。
核心成果
- 功能关联:Claudin18.2参与肿瘤增殖、迁移与淋巴结转移,高表达与胃癌的弥漫型亚型、高级别肿瘤相关;
- 疗效预测:Claudin18.2阳性患者接受靶向治疗(如zolbetuximab联合化疗)的PFS与OS显著延长(FAST研究HR=0.47,P<0.001);
- 创新性:首次系统证实Claudin18.2作为生物标志物的价值,涵盖多类治疗策略,为精准治疗提供依据。
总结
本文全面梳理了Claudin18.2作为肿瘤靶向免疫治疗生物标志物的研究进展,明确其在肿瘤中的表达、调控及治疗潜力。未来需解决的关键问题包括:统一Claudin18.2的检测标准、优化靶向治疗的安全性与疗效、探索联合治疗策略(如Claudin18.2靶向治疗+免疫检查点抑制剂)。随着研究深入,Claudin18.2有望成为胃癌等肿瘤靶向治疗的重要生物标志物,惠及更多患者。
