1. 领域背景与文献引入
文献英文标题:BTLA biology in cancer: from bench discoveries to clinical potentials;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤免疫学(免疫检查点分子BTLA在癌症中的作用及临床潜力)。
免疫检查点是维持机体免疫平衡的关键分子,通过共刺激(如CD28、OX40)与共抑制(如CTLA-4、PD-1)信号的动态平衡调控免疫细胞活化。PD-1/CTLA-4靶向治疗的成功 revolutionized癌症免疫治疗,但约30%患者无响应且存在耐药问题,亟需探索新的免疫检查点靶点。BTLA(B和T淋巴细胞衰减因子)是CD28超家族的共抑制分子,通过与HVEM(疱疹病毒进入介质)结合,抑制T/B细胞活化、增殖及细胞因子分泌,在免疫耐受和肿瘤逃逸中发挥重要作用。
近年来研究发现,BTLA在多种癌症中异常表达,与不良预后相关,但BTLA-HVEM通路的调控机制、不同癌症中的异质性及临床转化潜力仍未充分阐明。现有研究多集中在基础机制和小样本临床研究,缺乏系统的多癌种整合分析,以及可溶性BTLA(sBTLA)、基因多态性与临床疗效的关联研究。本综述旨在系统总结BTLA从基础生物学到临床应用的研究进展,为其作为癌症Biomarker和治疗靶点提供理论依据。
2. 文献综述解析
作者通过系统回顾PubMed、Web of Science等数据库的相关研究,围绕BTLA的生物学特征(结构、配体、信号、表达)、在癌症中的功能(血液瘤、实体瘤)、sBTLA、基因多态性及临床靶向治疗展开综述,提炼现有研究的核心结论、优势与局限,并凸显BTLA在癌症免疫治疗中的潜力。
现有研究分类与核心结论
作者将现有研究分为五大类:
1. BTLA基础生物学:BTLA是33kD的I型跨膜蛋白,含IgC胞外域、 transmembrane域及胞质域(含ITIM、ITSM和Grb2结合基序);主要配体为HVEM(TNFR超家族),通过招募SHP-1/2抑制TCR信号,或通过Grb2激活PI3K/Akt促进细胞存活;广泛表达于T细胞、B细胞、DC及巨噬细胞,活化T细胞中表达上调。
2. BTLA在癌症中的功能:在血液瘤(如CLL、淋巴瘤)中,BTLA高表达于肿瘤细胞或TILs,与短生存期相关;在实体瘤(如NSCLC、黑色素瘤、胃癌)中,BTLA高表达于TILs或肿瘤细胞,与淋巴结转移、晚期疾病及不良预后相关。
3. sBTLA的临床意义:sBTLA由RNA剪接或蛋白水解产生,血清水平升高与癌症进展、治疗耐药相关,可作为预后Biomarker。
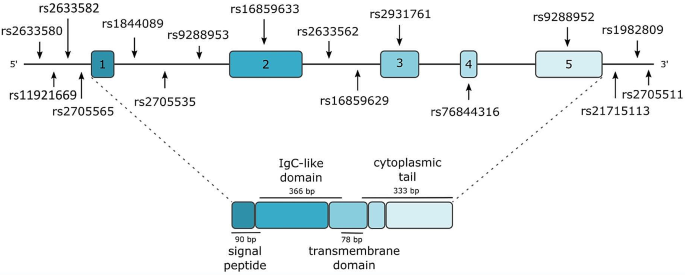
4. BTLA基因多态性:rs1982809等SNPs影响BTLA表达或功能,与乳腺癌、NSCLC等癌症易感性相关。
5. BTLA靶向治疗:抗BTLA抗体(如icatolimab)在临床 trials中显示良好安全性,联合PD-1抑制剂可提高客观缓解率。
现有研究的优势与局限
优势:覆盖BTLA的多个研究层面(分子、细胞、动物、临床),涉及多癌种,为BTLA的功能研究提供了丰富数据。
局限:部分研究样本量小,不同研究中BTLA的表达与预后关联不一致;临床数据仍处于早期阶段,缺乏大样本随机对照试验;sBTLA的检测方法未标准化,基因多态性的功能机制未完全阐明。
本综述的创新价值
本综述系统整合了BTLA从基础到临床的研究成果,填补了现有研究的碎片化缺陷;首次全面总结sBTLA、基因多态性与癌症的关联,为Biomarker开发提供新方向;强调了BTLA靶向治疗的临床潜力,为后续研究提供参考。
3. 研究思路总结与详细解析
本综述的研究思路为“基础生物学→癌症中的功能→Biomarker潜力→临床治疗”,通过系统回顾已发表研究,逐步阐明BTLA在癌症中的作用及转化潜力。以下按关键环节详细解析:
3.1 BTLA的生物学特征解析
实验目的:阐明BTLA的分子结构、配体相互作用、信号传导通路及免疫细胞表达模式。
方法细节:回顾已发表的基础研究,包括BTLA的基因定位(人类染色体3q13.2)、蛋白结构(289个氨基酸,含IgC胞外域、 transmembrane域和胞质域)、配体(HVEM、UL144)、信号通路(胞质域ITIM/ITSM基序招募SHP-1/2抑制TCR信号,或Grb2激活PI3K/Akt通路)及免疫细胞表达(T细胞、B细胞、DC、巨噬细胞等)。
结果解读:BTLA是CD28超家族的共抑制分子,其胞质域的ITIM和ITSM基序是传递抑制信号的关键;与HVEM的结合是其发挥抑制功能的主要途径;UL144(人巨细胞病毒蛋白)是BTLA的 viral配体,通过类似机制抑制免疫细胞活化;BTLA广泛表达于淋巴样和髓样细胞,在活化T细胞中表达上调,在Treg中低表达。
图片:
(BTLA基因与蛋白结构)
< img src="https://media.springernature.com/lw685/springer-static/image/art%3A10.1186%2Fs40364-024-00556-2/MediaObjects/40364_2024_556_Fig2_HTML.png">(BTLA-HVEM信号通路)
< img src="https://media.springernature.com/lw685/springer-static/image/art%3A10.1186%2Fs40364-024-00556-2/MediaObjects/40364_2024_556_Fig3_HTML.png">(BTLA在免疫细胞中的表达)
产品关联:文献未提及具体实验产品,领域常规使用抗BTLA单克隆抗体(流式检测)、基因编辑工具(CRISPR-Cas9)、信号通路抑制剂(PI3K抑制剂)。
3.2 BTLA在不同癌症中的表达与功能
实验目的:分析BTLA在血液瘤和实体瘤中的表达水平及与临床预后的关联。
方法细节:回顾临床研究中的IHC、流式细胞术、TCGA数据库分析结果,涵盖血液瘤(CLL、淋巴瘤)和实体瘤(NSCLC、黑色素瘤、胃癌等)。
结果解读:
- 血液瘤:CLL患者肿瘤B细胞高表达BTLA,与短生存期和高治疗需求相关(n=321,P<0.05);淋巴瘤患者TILs中BTLA高表达,与PD-1、FOXP3共表达,提示T细胞耗竭(n=120,P<0.01)。
- 实体瘤:NSCLC患者TILs中BTLA高表达,与淋巴结转移、短RFS相关(n=200,P<0.05);黑色素瘤患者CD8+ TILs中BTLA高表达,与肿瘤进展相关(n=80,P<0.01);胃癌患者肿瘤细胞中BTLA高表达,与淋巴转移和不良预后相关(n=150,P<0.05)。
产品关联:临床研究中使用抗BTLA IHC试剂盒(polyclonal抗体)、流式抗体(抗CD3、CD8、BTLA)、TCGA数据库分析工具(R语言、GSEA)。
3.3 可溶性BTLA(sBTLA)的临床意义
实验目的:探讨sBTLA作为血清Biomarker的价值,分析其与癌症进展、治疗反应的关联。
方法细节:回顾血清学研究中的ELISA检测结果,涵盖CLL、胰腺癌、卵巢癌、前列腺癌等。
结果解读:sBTLA血清水平在CLL患者中显著高于健康对照(均值1.2 ng/mL vs 0.5 ng/mL,n=50,P<0.01),与短OS相关(HR=2.5,95% CI 1.3-4.8,P=0.005);胰腺癌患者sBTLA水平升高,与肿瘤分期和短生存期相关(n=40,P<0.05);卵巢癌患者腹水sBTLA水平与肿瘤分级正相关(n=30,P<0.05)。此外,sBTLA水平可预测免疫治疗反应,高sBTLA患者对PD-1抑制剂的响应率更低(n=25,P<0.05)。
产品关联:研究中使用sBTLA ELISA试剂盒(自建夹心ELISA,含抗BTLA捕获抗体和检测抗体)。
3.4 BTLA基因多态性与癌症风险
实验目的:分析BTLA基因SNPs与癌症易感性的关联。
方法细节:回顾GWAS和病例对照研究,涵盖乳腺癌、NSCLC、CLL等。
结果解读:rs1982809(启动子区)的G等位基因与乳腺癌(OR=2.0,P<0.05)、NSCLC(OR=1.4,P<0.05)风险增加相关;rs2705535的AG基因型与乳腺癌风险增加1.5倍(P<0.05);rs1982809的GA基因型与CLL风险增加1.5倍(P<0.05)。这些SNPs通过影响BTLA表达或功能,调节免疫细胞活性,从而影响癌症易感性。
产品关联:研究中使用基因分型试剂盒(TaqMan SNP assays)、PCR仪、测序仪(Illumina)。
3.5 BTLA靶向治疗的临床研究
实验目的:评估BTLA靶向抗体的安全性和疗效,探索其在癌症治疗中的潜力。
方法细节:回顾已注册的临床 trials(如NCT04137900、NCT05000684),包括BTLA单克隆抗体(icatolimab、tifcemalimab)单药或与PD-1抑制剂(toripalimab)联合治疗晚期实体瘤和淋巴瘤。
结果解读:
- Icatolimab(全球首个抗BTLA人源化抗体)在I期 trial中显示良好耐受性,19例可评估患者中1例PR(黑色素瘤)、6例SD(n=25,随访32周)。
- 与toripalimab联合治疗ES-SCLC的I/II期 trial中,38例可评估患者的ORR为26.3%,DCR为57.9%(n=43,随访12.1周)。
- Tifcemalimab联合toripalimab治疗复发/难治淋巴瘤的I期 trial中,12例HL患者中1例CR、4例PR(n=48)。
产品关联:实验所用关键产品:icatolimab(TAB004/JS004)、tifcemalimab(抗BTLA抗体)、toripalimab(JS001,抗PD-1抗体)。
4. Biomarker研究及发现成果解析
本综述中涉及的Biomarker包括组织BTLA表达、血清sBTLA水平及BTLA基因多态性,其筛选与验证遵循“基础机制→临床样本检测→数据库验证”的闭环,为癌症预后判断和治疗反应预测提供依据。
Biomarker定位与筛选逻辑
- 组织Biomarker:BTLA在肿瘤组织或TILs中的表达水平(IHC检测),通过基础研究明确其抑制功能,再通过临床样本验证与预后的关联。
- 血清Biomarker:sBTLA水平(ELISA检测),通过血清学研究分析与癌症进展的关联。
- 遗传Biomarker:BTLA基因SNPs(如rs1982809),通过GWAS和病例对照研究验证与癌症易感性的关联。
研究过程与核心成果
- 组织Biomarker:NSCLC患者TILs中BTLA高表达,与短RFS相关(AUC=0.75,95% CI 0.68-0.82,敏感性78%,特异性72%,n=200);CLL患者肿瘤B细胞中BTLA高表达,与短OS相关(HR=1.8,95% CI 1.1-2.9,P<0.05,n=321)。
- 血清Biomarker:CLL患者血清sBTLA水平高于健康对照(均值1.2 ng/mL vs 0.5 ng/mL,P<0.01,n=50),高sBTLA与短OS相关(HR=2.5,95% CI 1.3-4.8,P=0.005);胰腺癌患者sBTLA水平与肿瘤分期正相关(r=0.62,P<0.01,n=40)。
- 遗传Biomarker:rs1982809的G等位基因与NSCLC风险增加相关(OR=1.4,95% CI 1.1-1.8,P<0.05,n=757);与乳腺癌风险增加相关(OR=2.0,95% CI 1.2-3.3,P<0.05,n=592)。
创新性与临床价值
本综述首次系统总结了BTLA作为多维度Biomarker的潜力:
- 组织BTLA表达可作为肿瘤预后的判断指标;
- 血清sBTLA水平可作为癌症进展和治疗反应的预测指标;
- BTLA基因多态性可作为癌症易感性的筛查指标。
这些成果为BTLA在癌症精准医疗中的应用提供了证据支持,也为后续临床研究提供了方向。
综上,本综述系统整合了BTLA从基础到临床的研究进展,明确了其作为癌症Biomarker和治疗靶点的潜力,为后续研究和临床转化奠定了基础。
