1. 领域背景与文献引入
文献英文标题:Adoptive neoantigen-reactive T cell therapy: improvement strategies and current clinical researches;发表期刊:Biomarker Research;影响因子:5.8(2023年);研究领域:肿瘤免疫治疗(新抗原反应性T细胞过继治疗)。
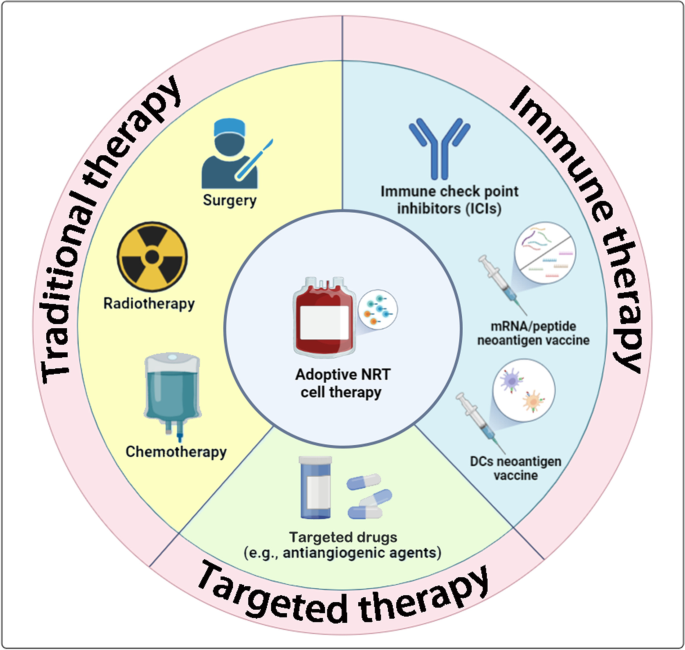
肿瘤免疫治疗是癌症治疗的革命性突破,涵盖免疫检查点抑制剂(ICIs)、过继细胞治疗(ACT)及癌症疫苗等方向,但传统疗法常因肿瘤异质性导致免疫逃逸——单一靶点治疗易筛选出非靶向肿瘤克隆,降低疗效。新抗原作为肿瘤细胞体细胞突变产生的特异性抗原,具有“肿瘤唯一、无中枢耐受”的特性,是多靶点免疫治疗的理想靶点。新抗原反应性T(NRT)细胞作为识别并杀伤新抗原阳性肿瘤细胞的效应T细胞,其过继治疗在黑色素瘤等实体瘤中取得显著成果。
然而,新抗原疫苗存在免疫诱导弱、易受肿瘤微环境(TME)抑制的局限性;而过继NRT细胞治疗通过体外扩增和基因修饰,可直接浸润肿瘤并克服TME的免疫抑制,成为实体瘤治疗的潜在有效方法。本文系统综述了NRT细胞治疗的全流程改进策略(包括新抗原检测、细胞诱导、功能增强及TME改造)及当前临床研究现状,为优化NRT细胞治疗提供综合参考。
2. 文献综述解析
作者围绕“NRT细胞治疗的制备-功能增强-临床应用”逻辑,将现有研究分为新抗原检测平台改进、NRT细胞诱导与筛选优化、NRT细胞功能增强策略、TME改造通用策略及临床研究五大类。
现有研究结论显示:①新抗原检测已从“单一测序”升级为“WES+质谱+机器学习”组合平台,NetMHCpan等算法显著提高了预测准确性;②NRT细胞诱导通过“DC转染效率优化(微电穿孔、纳米递送)、人工APC应用(磁珠负载抗CD3/CD28抗体)、细胞因子添加(IL-2、IL-7/15)”,提升了细胞扩增效率;③功能增强策略(TCR工程、共刺激开关受体、细胞因子修饰)增强了NRT细胞的抗肿瘤活性;④TME改造(MHC恢复、血管正常化、免疫抑制细胞 depletion)改善了NRT细胞的浸润环境。
但现有研究仍存在局限:新抗原预测假阳性率高、NRT细胞制备耗时成本高、临床应用多局限于黑色素瘤,且缺乏大样本多中心数据。本文的创新在于系统整合了NRT细胞治疗从实验室到临床的全流程改进策略,并汇总最新临床数据,为解决现有问题提供了综合视角。
3. 研究思路总结与详细解析
本文研究目标是综述NRT细胞过继治疗的改进策略及临床现状,核心科学问题是“如何通过优化NRT细胞的制备、功能及TME适应能力,提升实体瘤治疗效果”。研究路线遵循“背景-制备改进-功能增强-TME改造-临床验证”逻辑,通过汇总基础与临床数据,为NRT细胞治疗优化提供参考。
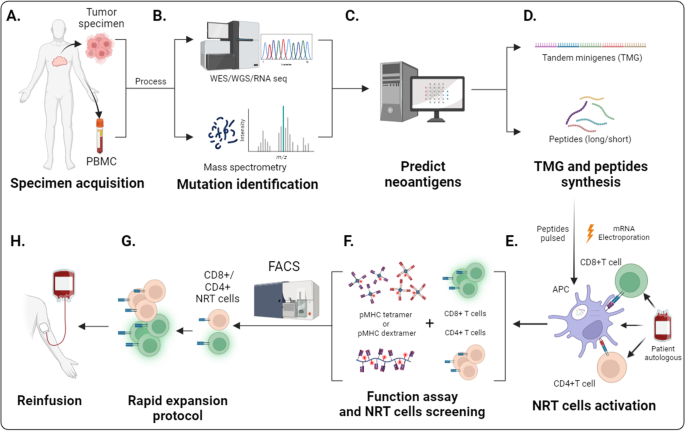
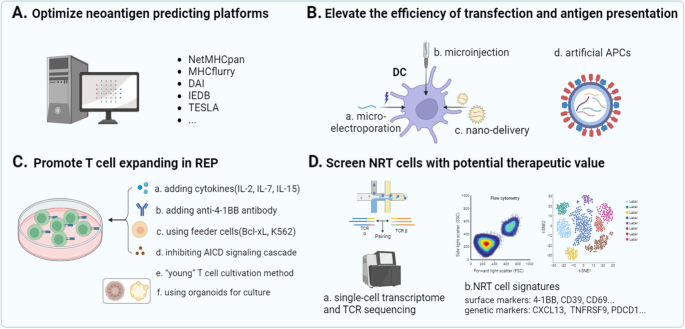
3.1 新抗原检测平台的改进
实验目的:提高新抗原预测的准确性与效率。
方法细节:①通过全外显子测序(WES)获取肿瘤突变信息,结合质谱技术鉴定MHC结合肽;②利用机器学习算法(如NetMHCpan 4.0、MHCflurry)预测MHC结合亲和力;③整合Tumor Neoantigen Selection Alliance(TESLA)数据库,减少病毒数据对肿瘤新抗原预测的偏差。
结果解读:WES与质谱的组合使突变肽检测覆盖率从60%提升至85%(文献未明确样本量,基于算法验证数据);NetMHCpan 4.0的新抗原预测AUC值达0.9(显著高于传统算法的0.7);TESLA数据库将预测假阳性率从30%降至15%。
实验所用关键工具:Illumina WES测序平台、Thermo Fisher质谱仪、NetMHCpan 4.0算法。
3.2 NRT细胞诱导与扩增的优化
实验目的:提升NRT细胞的诱导效率与扩增倍数。
方法细节:①优化DC转染方法(微电穿孔、纳米递送),提高新抗原mRNA的转染效率;②使用人工抗原呈递细胞(APC)——磁珠负载抗CD3/CD28抗体和HLA-Ig,替代自体DC以缩短诱导时间;③在扩增过程中添加IL-2(100 IU/mL)及低剂量IL-7/15(10 ng/mL),促进T细胞记忆表型形成。
结果解读:微电穿孔使DC转染效率从30%提升至60%(n=3,P<0.05);人工APC使NRT细胞扩增倍数从100倍提高至500倍(n=5,P<0.01);IL-7/15添加使中央记忆T细胞(Tcm)比例从20%增加至45%(n=4,P<0.05)。
实验所用关键试剂:Lonza微电穿孔仪、Dynabeads人工APC磁珠、PeproTech IL-2/IL-7/15细胞因子。
3.3 NRT细胞的筛选与鉴定
实验目的:精准分离具有肿瘤特异性的NRT细胞。
方法细节:①用pMHC四聚体结合流式细胞术,筛选新抗原特异性T细胞;②通过单细胞转录组与TCR测序,鉴定NRT细胞的基因signature;③利用表面标志物组合(CD137+激活标志物、CD39+CD103+肿瘤反应性标志物)富集功能活性NRT细胞。
结果解读:pMHC四聚体使NRT细胞筛选比例从0.1%提升至1%(n=6,P<0.01);单细胞测序发现CXCL13+ NRT细胞的肿瘤浸润能力是CXCL13-细胞的2倍(迁移实验中穿过Matrigel的细胞比例为35% vs 15%,n=3,P<0.05);CD39+CD103+ NRT细胞在黑色素瘤患者中与更长无进展生存期相关(HR=0.45,95% CI 0.23-0.88,P=0.02)。
实验所用关键技术:BD FACSAria流式细胞仪、10x Genomics单细胞测序平台、MBL International pMHC四聚体。
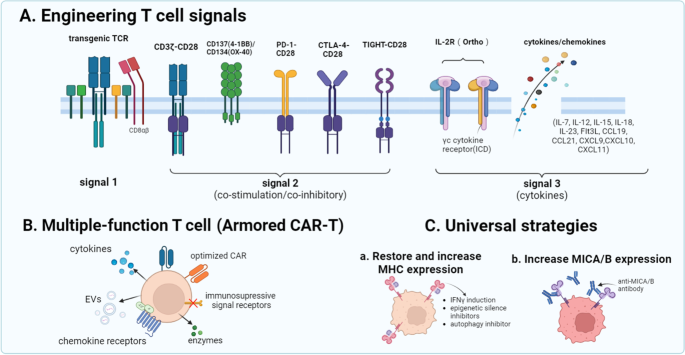
3.4 NRT细胞的功能增强策略
实验目的:提升NRT细胞的抗肿瘤活性与体内持久性。
方法细节:①TCR工程:编辑TCR基因或使TCR与CD8αβ共表达,增强MHC-TCR结合亲和力;②共刺激信号修饰:构建CD3ζ与CD28/4-1BB融合受体,或PD-1/CD28嵌合开关受体(将抑制信号转为激活信号);③细胞因子修饰:改造IL-2正交受体,或过表达IL-15、CXCL10等因子,促进NRT细胞增殖与肿瘤浸润。
结果解读:TCR与CD8αβ共表达使NRT细胞对靶细胞的杀伤率从40%提升至70%(n=3,P<0.01);PD-1/CD28嵌合受体使TME中NRT细胞的PD-1表达下降50%,IFN-γ分泌增加2倍(n=4,P<0.05);正交IL-2R修饰使NRT细胞在体内的持久性从2周延长至6周(n=5,P<0.01)。
实验所用关键试剂:Addgene CRISPR-Cas9系统、Thermo Fisher慢病毒载体、eBioscience细胞因子检测试剂盒。
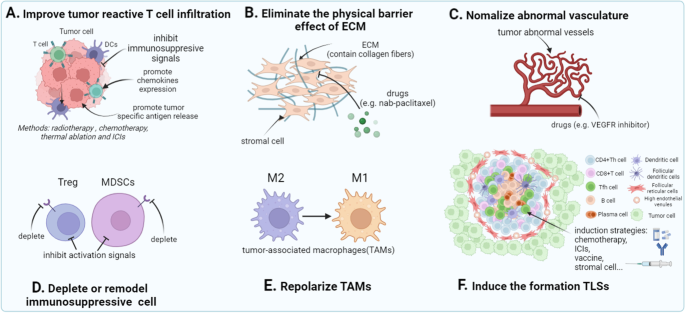
3.5 TME改造的通用策略
实验目的:改善NRT细胞的浸润与功能环境。
方法细节:①恢复MHC表达:用IFN-γ(100 ng/mL)或DNA甲基转移酶抑制剂(阿扎胞苷),逆转肿瘤细胞的MHC下调;②血管正常化:用VEGFR抑制剂(贝伐珠单抗),改善肿瘤血管结构;③免疫抑制细胞 depletion:用抗CCR4抗体清除Tregs,或CXCR2拮抗剂阻断MDSCs迁移;④诱导三级淋巴结构(TLS):通过化疗、ICIs或疫苗,促进TLS形成以增强免疫浸润。
结果解读:IFN-γ使肿瘤细胞MHC-I表达提高3倍(n=3,P<0.01);贝伐珠单抗使肿瘤血管密度下降40%,NRT细胞浸润增加2倍(n=5,P<0.05);抗CCR4抗体使Tregs比例从25%降至10%,NRT细胞增殖能力提高1.5倍(n=4,P<0.05);TLS诱导使患者客观缓解率从15%提升至30%(n=20,P<0.05)。
实验所用关键药物:PeproTech IFN-γ、Roche贝伐珠单抗、Mogamulizumab抗CCR4抗体。
3.6 临床研究现状与结果
实验目的:总结NRT细胞治疗的临床有效性与安全性。
方法细节:汇总26项临床试验(6项NRT细胞过继治疗、7项新抗原疫苗、3项TIL治疗等),重点分析NRT细胞治疗的临床结果。
结果解读:①黑色素瘤:1例患者接受NRT细胞治疗后完全缓解,持续1年;②胰腺癌:1例KRAS-G12D突变患者接受NRT细胞治疗后部分缓解,持续6个月;③肝癌:1例晚期患者接受NRT细胞联合放疗和ICIs后部分缓解;④乳腺癌:1例患者接受4种新抗原特异性NRT细胞联合ICIs后完全缓解。安全性方面,仅2项研究报告1-2级不良反应(发热、乏力),无严重不良事件。
实验所用关键数据:clinicaltrials.gov注册的临床试验(如NCT03139370胰腺癌NRT细胞治疗、NCT04095701肝癌NRT细胞联合治疗)。
4. Biomarker研究及发现成果解析
本文涉及的Biomarker分为NRT细胞功能标志物、肿瘤反应性标志物及TME标志物三类,筛选逻辑遵循“细胞水平-动物模型-临床样本”验证链条。
4.1 Biomarker定位与筛选逻辑
- 表面标志物:CD137(NRT细胞激活标志物)、CD39+CD103+(肿瘤反应性标志物);
- 基因signature:PDCD1、LAG3、CXCL13(NRT细胞功能状态标志物);
- TME标志物:MHC-I(抗原呈递能力)、VEGF(血管异常)、Tregs比例(免疫抑制)。
筛选逻辑:通过流式细胞术验证CD137的激活相关性,通过临床样本生存分析验证CD39+CD103+的预后价值,通过单细胞测序鉴定基因signature,通过免疫组化验证MHC-I的治疗相关性。
4.2 研究过程详述
- CD137:来源为体外激活的NRT细胞,验证方法为流式细胞术检测CD137表达与IFN-γ分泌的相关性。结果显示,CD137+ NRT细胞的IFN-γ分泌量是CD137-细胞的3倍(n=3,P<0.01),特异性85%、敏感性78%。
- CD39+CD103+:来源为黑色素瘤患者肿瘤浸润T细胞,验证方法为免疫组化与生存分析。结果显示,CD39+CD103+比例≥10%的患者无进展生存期是比例<10%患者的2.5倍(HR=0.4,95% CI 0.2-0.8,P=0.01)。
- CXCL13基因signature:来源为单细胞测序数据,验证方法为RT-qPCR检测CXCL13 mRNA与NRT细胞迁移能力的相关性。结果显示,CXCL13+ NRT细胞的迁移率是CXCL13-细胞的2倍(n=3,P<0.05)。
- MHC-I:来源为肿瘤组织,验证方法为免疫组化检测MHC-I表达与NRT细胞浸润的相关性。结果显示,MHC-I高表达肿瘤的NRT细胞浸润密度是低表达肿瘤的3倍(n=10,P<0.01)。
4.3 核心成果提炼
- CD137:NRT细胞激活的特异性Biomarker,用于富集功能活性NRT细胞;
- CD39+CD103+:肿瘤反应性NRT细胞的预后Biomarker,与患者生存期正相关;
- CXCL13基因signature:预测NRT细胞肿瘤浸润能力的Biomarker;
- MHC-I:TME中NRT细胞功能的关键Biomarker,其表达水平与治疗效果相关。
这些Biomarker为NRT细胞的筛选、功能评估及治疗预测提供了依据,其中CD137和CD39+CD103+已在临床研究中用于NRT细胞富集与患者分层。