1. 领域背景与文献引入
文献英文标题:Improving the prediction of Spreading Through Air Spaces (STAS) in primary lung cancer with a dynamic dual-delta hybrid machine learning model: a multicenter cohort study;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肺癌STAS术前预测(精准肿瘤学)。
肺癌是全球死亡率最高的恶性肿瘤,STAS(气道扩散)是其重要侵袭模式,指肿瘤细胞通过气道扩散至周围肺实质,与高复发率、短生存期密切相关,且直接影响手术决策——STAS阳性患者肺叶切除比亚肺叶切除预后更好。目前STAS诊断依赖术后病理,术中冰冻切片敏感性仅55%,无法指导术前决策。影像学研究显示STAS与CT征象(如毛刺、血管集束、胸膜牵拉)相关,但传统影像学评估存在主观误差和技术参数差异(如层厚)。放射组学通过高通量提取图像特征量化肿瘤信息,减少主观误差,现有研究用放射组学或深度学习预测STAS,但多基于单时间点CT,未利用动态随访的CT图像信息,而delta-radiomics(动态放射组学,分析随访期间特征变化)结合深度学习的研究尚未开展,无法捕捉肿瘤生长的动态信息。
针对现有研究的局限,本研究旨在开发基于术前CT动态图像的双delta模型(结合delta-radiomics和delta-DL特征),利用随访期间的肿瘤动态变化信息,提高STAS术前预测的准确性,为手术决策提供可靠依据。
2. 文献综述解析
作者对现有STAS预测研究的分类维度主要是技术类型,包括传统放射组学模型、深度学习模型、联合瘤周信息的模型。现有研究的关键结论:传统放射组学模型如Jiang等用随机森林模型预测肺腺癌STAS,AUC0.754(敏感性0.88,特异性0.588);Chen等用朴素贝叶斯模型预测I期肺腺癌STAS,外部验证AUC0.69;深度学习模型如Tao等比较传统放射组学、计算机视觉、3D-CNN及联合模型,发现3D-CNN预测性能最优;联合瘤周信息的模型如Liao等将瘤周信息纳入特征提取,提高预测性能。现有研究的优势是通过量化图像信息减少主观误差,提高预测客观性;局限性是多基于单时间点CT图像,未利用动态随访的CT信息,无法捕捉肿瘤生长的动态变化,且delta-radiomics与深度学习结合的研究空白。
本研究的创新点在于首次将delta-radiomics(动态放射组学特征,反映随访期间特征变化斜率)与delta-DL(基于图像注册减影的深度学习特征,反映肿瘤生长区域的图像变化)结合,开发双delta模型,利用动态CT随访信息,弥补单时间点模型的不足,提高STAS术前预测性能。
3. 研究思路总结与详细解析
本研究的整体框架:研究目标是开发并验证基于术前CT动态图像的双delta模型,预测肺癌患者STAS状态;核心科学问题是双delta特征(delta-radiomics和delta-DL)能否提高STAS预测的准确性和多中心通用性;技术路线是患者入组→CT图像处理与VOI分割→双delta特征提取→特征选择与分类器优化→模型验证(内部+外部队列)→模型可解释性分析(Grad-CAM+特征排序)。
3.1 患者队列构建与基线信息分析
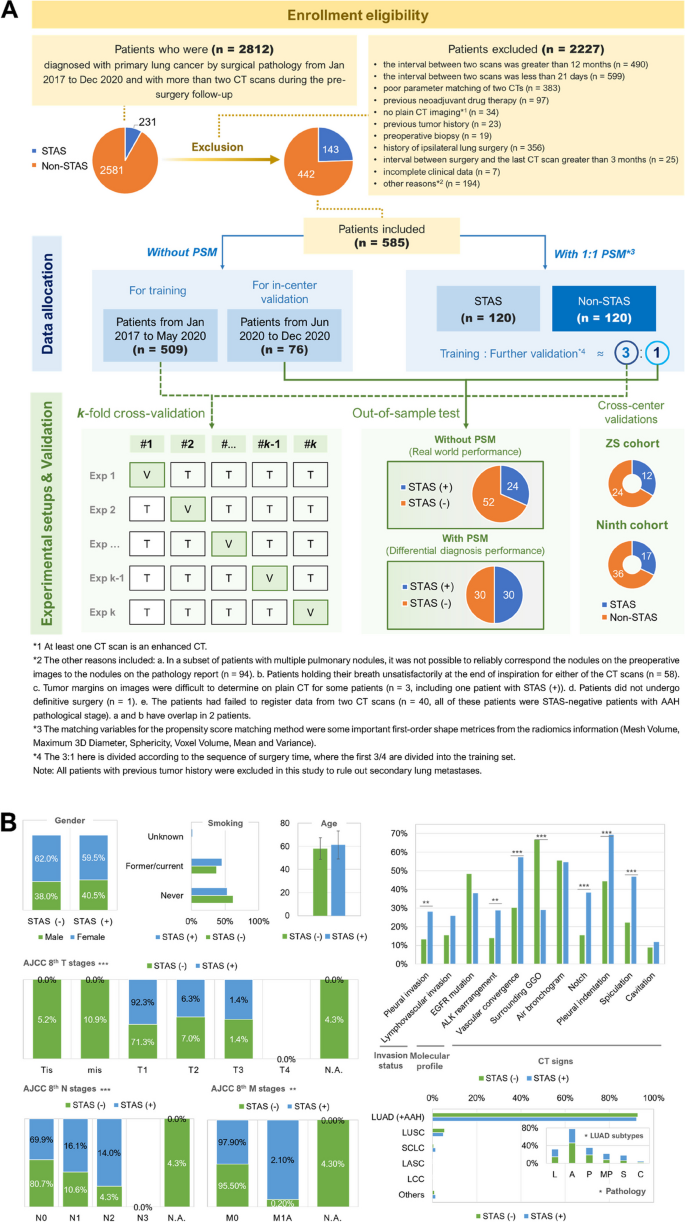
实验目的是建立多中心回顾性队列,确保数据的代表性和可靠性。方法细节:回顾性纳入2017-2020年三个中国医院(上海胸科医院、中山医院、第九人民医院)的674例原发性肺癌患者,均有术前CT随访(间隔≥2周)和术后病理诊断。上海胸科医院的509例为训练集,76例为内部验证集;中山医院36例、第九人民医院53例为外部验证集。排除标准包括随访间隔<21天或>12个月、CT参数不匹配、新辅助治疗、无平扫CT、既往肿瘤史等。对队列进行倾向评分匹配(PSM),平衡STAS阳性与阴性组的形状和一阶特征。结果解读:基线信息显示患者年龄(中位数60岁)、性别(女性占61.4%)、病理亚型(以腺泡型、乳头状、贴壁型为主)与现有研究一致,STAS阳性率24.4%(143/585),PSM后队列平衡,减少选择偏倚。产品关联:文献未提及具体实验产品,领域常规使用医院电子病历系统(如HIS)提取临床信息,病理信息系统(如LIS)获取STAS诊断,统计软件(如SPSS、R)进行基线分析。
3.2 CT图像处理与VOI分割
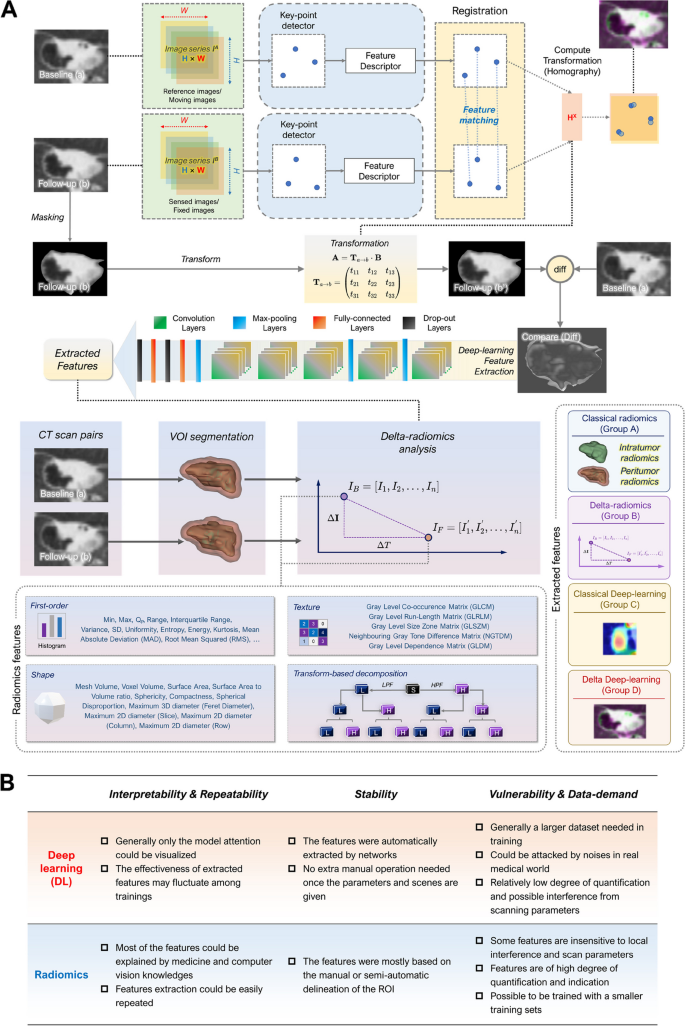
实验目的是获取可靠的肿瘤和瘤周区域图像,确保特征提取的一致性。方法细节:将CT图像转换为 anonymized DICOM格式,用3D Slicer 5.0.3软件手动分割肿瘤(4名观察者:1名资深放射科医生、1名资深胸外科医生、2名住院医师),逐层勾勒肿瘤边界,自动重建3D肿瘤体积。瘤周区域定义为肿瘤边缘外3mm,同样分割。结果解读:通过组内和组间相关系数(ICC)评估分割一致性,选取ICC>0.75的特征进入后续分析,确保分割的可靠性。产品关联:使用3D Slicer(开源医学图像分割软件)进行VOI分割,PyRadiomics v3.0(开源放射组学工具)提取特征。
3.3 双delta特征提取
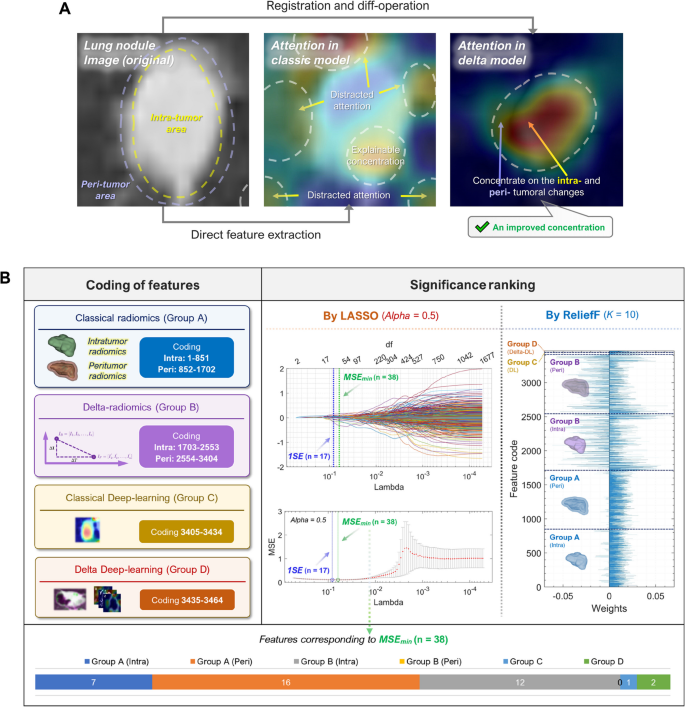
实验目的是提取反映肿瘤动态变化的特征,包括delta-radiomics和delta-DL特征。方法细节:delta-radiomics特征计算:对基线和随访CT的放射组学特征(共851个,包括形状、一阶统计、纹理、小波特征),计算时间斜率(Index_delta=(I_followup - I_baseline)/(t_followup - t_baseline))。delta-DL特征提取:对基线和随访CT图像进行多模态注册(减少体位变化影响),减影得到delta图像(反映肿瘤生长区域),用AlexNet模型提取深度学习特征(每个视角提取10个特征)。结果解读:delta-radiomics提取到反映肿瘤大小、密度、纹理变化的特征;delta-DL特征来自肿瘤生长区域的图像,AlexNet模型训练曲线显示收敛(图5A)。图像注册的结构相似性指数(SSIM)高达0.9587,确保减影图像的可靠性(图4)。产品关联:使用MATLAB R2021b进行图像注册和CNN训练,PyRadiomics提取放射组学特征。

3.4 特征选择与分类器优化
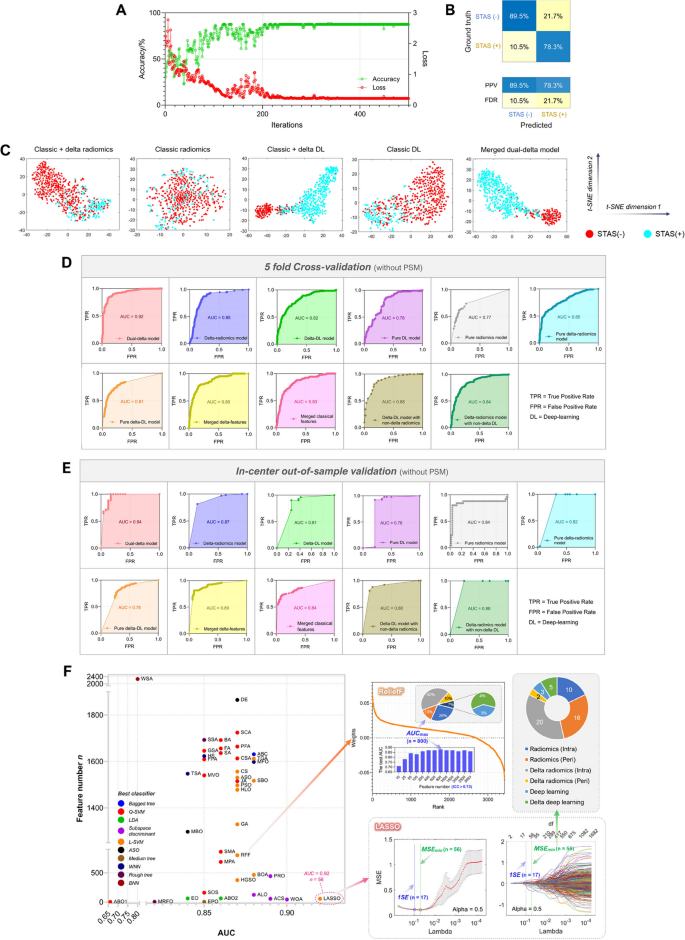
实验目的是筛选可靠特征,优化分类器,提高模型性能。方法细节:首先用ICC>0.75筛选可靠特征(共3404个,包括肿瘤和瘤周的放射组学、delta-radiomics特征),然后用45种特征选择算法(如LASSO、ReliefF)和32种分类器(如SVM、随机森林)组合(共1440种),通过五折交叉验证选择AUC最高的组合。结果解读:最优组合为LASSO回归+线性SVM,提取56个关键特征(其中22个来自delta-radiomics,5个来自delta-DL),这些特征对STAS预测贡献最大。t-SNE聚类显示,加入delta特征后,STAS阳性与阴性组的聚类更分离(图5C)。产品关联:使用Python的scikit-learn库进行特征选择和分类器训练,R软件进行LASSO回归分析。
3.5 模型验证与性能评估
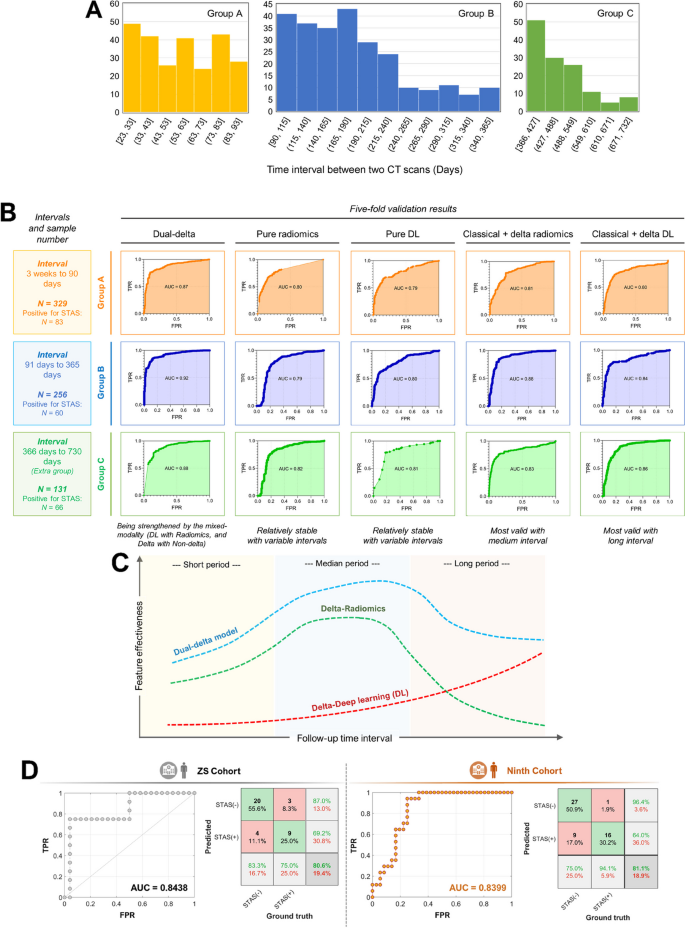
实验目的是评估模型在内部和外部队列的性能,验证通用性。方法细节:用ROC-AUC、混淆矩阵评估模型性能,五折交叉验证验证稳定性,Grad-CAM可视化深度学习模型的注意力区域。结果解读:内部验证集AUC0.94(95%CI 0.92-0.96),准确性87%,敏感性70.6%,特异性92.3%(图5B、E);外部验证集(中山医院)AUC0.844,准确性80.6%,敏感性75%,特异性83.3%;第九人民医院AUC0.840,准确性81.1%,敏感性94.1%,特异性75%(图6D)。Grad-CAM显示delta-DL模型的注意力集中在肿瘤生长区域,比传统DL模型更集中(图7A)。产品关联:使用Python的matplotlib库绘制ROC曲线,Grad-CAM工具(如pytorch-grad-cam)可视化模型注意力。
4. Biomarker研究及发现成果解析
Biomarker定位:本研究的Biomarker是双delta特征组合(delta-radiomics特征+delta-DL特征),即从动态CT图像中提取的反映肿瘤生长变化的放射组学和深度学习特征。筛选逻辑:通过ICC筛选可靠特征(ICC>0.75),再用LASSO回归选择与STAS相关的关键特征;验证逻辑:在训练集、内部验证集、外部验证集评估特征的预测性能。
研究过程详述:Biomarker来源是术前CT动态图像(基线+随访),验证方法包括ROC-AUC(评估区分能力)、混淆矩阵(评估准确性、敏感性、特异性)、多中心验证(评估通用性)。敏感性与特异性数据:内部验证集敏感性70.6%(n=76),特异性92.3%(n=76);外部中山医院队列敏感性75%(n=36),特异性83.3%(n=36);第九人民医院队列敏感性94.1%(n=53),特异性75%(n=53)。
核心成果提炼:双delta特征组合是有效的STAS术前预测Biomarker,内部验证AUC0.94,外部验证AUC0.84,具有良好的区分能力和多中心通用性;创新性是首次将动态放射组学与深度学习结合作为STAS预测Biomarker,捕捉肿瘤生长的动态信息,提高预测性能。此外,模型的可解释性(Grad-CAM和特征排序)增强了临床接受度——Grad-CAM显示模型注意力集中在肿瘤生长区域,特征排序显示delta-radiomics和delta-DL特征对预测贡献最大。
本研究通过双delta模型解决了单时间点模型的局限,为STAS术前预测提供了可靠工具,有望指导肺癌患者的个性化手术决策,推动精准肿瘤学的发展。
