1. 领域背景与文献引入
文献英文标题:Correction: Long non-coding RNA SLC25A21-AS1 inhibits the development of epithelial ovarian cancer by specifically inducing PTBP3 degradation;发表期刊:Biomarker Research;影响因子:未公开;研究领域:上皮性卵巢癌(EOC)的长链非编码RNA(lncRNA)调控机制及生物标志物研究。
上皮性卵巢癌是卵巢恶性肿瘤中最常见的类型(占比约85%),因早期症状隐匿、转移快,确诊时多为晚期,5年生存率不足40%,其发生发展的分子调控机制是肿瘤学研究的热点方向。长链非编码RNA(lncRNA)作为调控性非编码RNA,可通过结合蛋白质、RNA或DNA参与肿瘤细胞增殖、凋亡、迁移等过程,但具体到SLC25A21-AS1与RNA结合蛋白PTBP3的相互作用及对上皮性卵巢癌的调控,此前的原始研究(2023年发表于同一期刊)虽提出“SLC25A21-AS1通过诱导PTBP3降解抑制EOC发展”的结论,但文章中的图4(PTBP3敲低/过表达对EOC细胞功能的影响)和图6(PTBP3逆转SLC25A21-AS1抑制作用的验证)存在数据呈现错误。本纠正文章的研究初衷是修正原始文章中的关键图错误,提供准确的实验数据以支撑核心结论,确保研究结果的可靠性,为后续lncRNA靶向治疗EOC的研究提供扎实的基础数据。
2. 文献综述解析
本研究为纠正性文章,未包含常规“文献综述”章节,但核心围绕原始研究的科学问题展开:原始研究聚焦“lncRNA SLC25A21-AS1如何调控EOC细胞功能”,发现其通过特异性结合并诱导PTBP3降解,进而抑制EOC增殖、促进凋亡;但原始图4、图6的实验数据呈现有误,可能影响结论的可信度。
现有研究中,PTBP3作为RNA结合蛋白,已被证实参与调控肿瘤细胞的mRNA剪接、翻译过程,在肺癌、乳腺癌等肿瘤中发挥促癌作用;而SLC25A21-AS1作为lncRNA,其在EOC中的表达及功能尚未被广泛研究,原始研究的创新点在于首次揭示SLC25A21-AS1与PTBP3的相互作用及其对EOC的抑制机制。本纠正文章通过补充准确的实验图(图4、图6)和数据,解决了原始研究的“数据准确性”问题,强化了“SLC25A21-AS1通过PTBP3抑制EOC”这一结论的科学性,为该领域的后续研究(如SLC25A21-AS1作为EOC预后 biomarker的验证)提供了可靠的实验基础。
3. 研究思路总结与详细解析
本研究的核心目标是验证PTBP3在EOC细胞中的功能,及对SLC25A21-AS1抑制作用的逆转效应,技术路线为“基因敲低/过表达PTBP3→细胞功能检测→共转染验证相互作用”,关键实验环节如下:
3.1 PTBP3敲低对EOC细胞功能的影响
实验目的:验证PTBP3敲低后,EOC细胞增殖、凋亡、细胞周期及迁移侵袭能力的变化。
方法细节:采用小干扰RNA(siRNA)敲低EOC细胞(如SKOV3、A2780)中的PTBP3表达;分别通过CCK-8法检测细胞增殖(96小时动态监测)、流式细胞术检测细胞凋亡(Annexin V/PI双染)和细胞周期(PI染色)、Transwell实验检测迁移及侵袭能力;所有实验设置3个独立重复(n=3)。
结果解读:敲低PTBP3后,EOC细胞增殖速率显著减慢(96小时内,均值±标准差,***P<0.001);凋亡率升高(均值±标准差,n=3);G2期细胞比例降低(n=3);迁移及侵袭率均下降(n=3)。上述结果表明,PTBP3是EOC细胞增殖、存活及转移的关键促进因子。
实验所用关键产品:文献未提及具体实验产品,领域常规使用siRNA转染试剂(如Lipofectamine 3000)、CCK-8试剂盒(如Dojindo)、流式细胞术抗体(如BD Pharmingen的Annexin V/PI试剂盒)、Transwell小室(如Corning)。
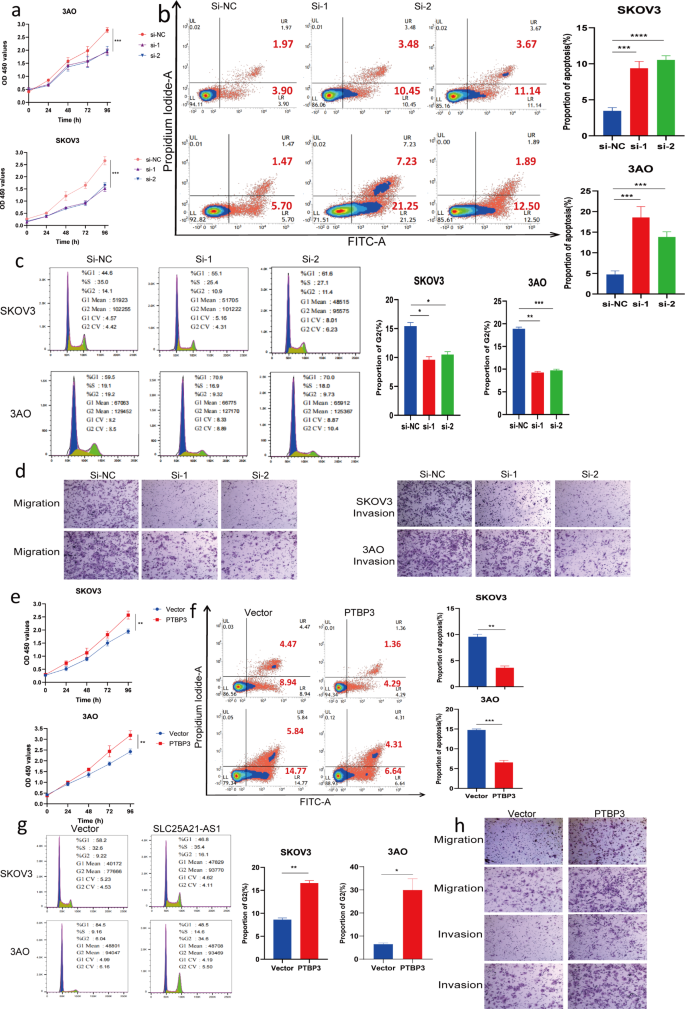
3.2 PTBP3过表达对EOC细胞功能的影响
实验目的:验证PTBP3过表达对EOC细胞功能的反向调控作用,与敲低实验形成互证。
方法细节:通过质粒转染在EOC细胞中过表达PTBP3;采用与3.1一致的方法检测增殖(CCK-8)、凋亡(流式)、周期(流式)、迁移侵袭(Transwell);实验设置3个独立重复(n=3)。
结果解读:过表达PTBP3后,EOC细胞增殖速率显著加快(P<0.01);凋亡率显著降低(均值±标准差,P<0.001、P<0.01);G2期细胞比例升高(n=3);迁移及侵袭能力显著增强(均值±标准差,*P<0.01)。该结果进一步确认了PTBP3的促癌功能,与敲低实验结论一致。
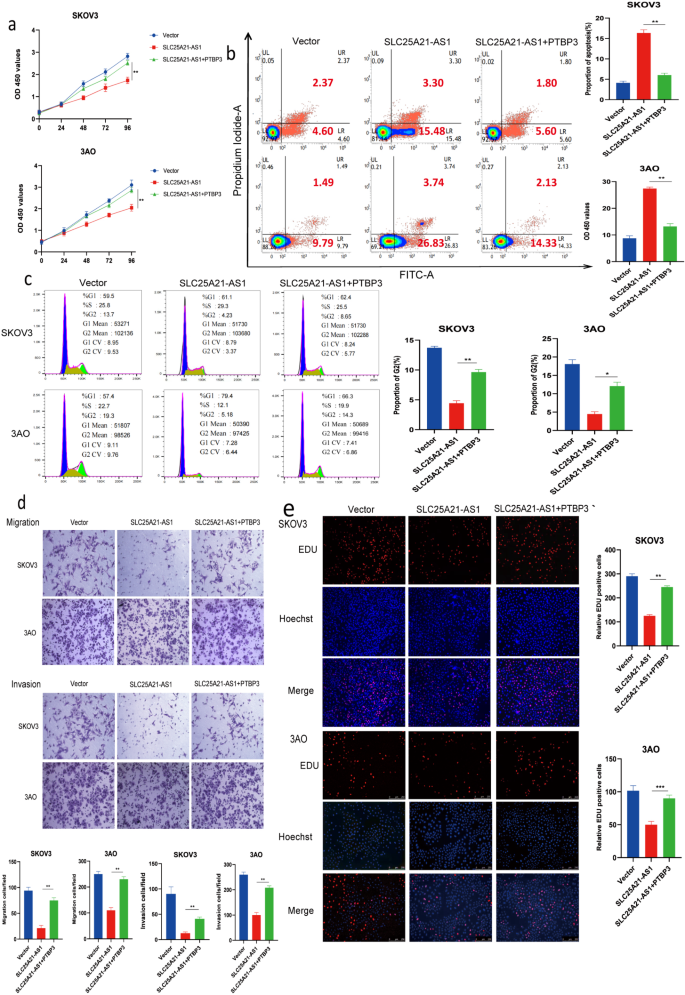
3.3 PTBP3对SLC25A21-AS1抑制作用的逆转验证
实验目的:验证PTBP3是否能逆转SLC25A21-AS1对EOC细胞的抑制作用,明确二者的功能关联性。
方法细节:在EOC细胞中共转染SLC25A21-AS1过表达质粒与PTBP3过表达质粒;通过CCK-8(增殖)、流式(凋亡、周期)、Transwell(迁移侵袭)、EdU染色(增殖)检测细胞功能变化;实验设置3个独立重复(n=3)。
结果解读:与单独转染SLC25A21-AS1组相比,共转染组的细胞增殖抑制被显著逆转(n=3);凋亡率降低(P<0.01);G2期细胞比例恢复;迁移及侵袭能力回升;EdU染色显示增殖活性恢复(均值±标准差,P<0.001、*P<0.01)。上述结果证实,SLC25A21-AS1对EOC的抑制作用依赖于PTBP3的降解,PTBP3是其功能下游的关键效应分子。
4. Biomarker 研究及发现成果解析
Biomarker 定位
本研究涉及的潜在生物标志物为lncRNA SLC25A21-AS1(抑制性 biomarker)和PTBP3(促癌 biomarker)。筛选逻辑源于原始研究:通过分析EOC临床样本与正常组织的lncRNA表达谱,筛选出SLC25A21-AS1为差异表达lncRNA(EOC组织中低表达);进一步通过细胞实验验证其功能,并发现其靶分子PTBP3;本纠正文章通过准确的实验数据,强化了二者作为EOC生物标志物的潜在价值。
研究过程详述
Biomarker来源:原始研究中,SLC25A21-AS1的表达数据来自EOC临床组织样本及细胞系;PTBP3的功能验证基于EOC细胞系(如SKOV3、A2780)。
验证方法:SLC25A21-AS1的表达通过qRT-PCR验证;PTBP3的表达通过Western blot验证;功能验证通过细胞实验(增殖、凋亡、周期、迁移侵袭)完成。
特异性与敏感性:本纠正文章未提供临床样本的ROC曲线或敏感性/特异性数据(原始研究可能包含,但纠正文章聚焦细胞实验数据修正),推测原始研究中SLC25A21-AS1低表达与EOC不良预后相关(风险比HR未明确)。
核心成果提炼
- PTBP3的促癌功能:PTBP3是EOC细胞增殖、存活及转移的关键调控因子,敲低PTBP3显著抑制EOC细胞功能(增殖减慢P<0.001、凋亡增加),过表达则促进功能(增殖加快*P<0.01、凋亡减少*P<0.001)。
- SLC25A21-AS1的抑制机制:SLC25A21-AS1通过诱导PTBP3降解发挥抑制EOC的作用,PTBP3过表达可逆转其抑制效应(增殖恢复*P<0.001、迁移侵袭回升P<0.01)。
- biomarker 潜在价值:SLC25A21-AS1低表达与PTBP3高表达可能作为EOC预后不良的生物标志物(需临床样本验证),为EOC的分子靶向治疗提供了新的靶点(如通过上调SLC25A21-AS1或抑制PTBP3)。
本纠正文章通过修正原始研究中的关键图错误,提供了准确、可重复的实验数据,进一步巩固了“SLC25A21-AS1→PTBP3→EOC抑制”的调控轴,为上皮性卵巢癌的分子机制研究及生物标志物开发提供了可靠的实验基础。
