1. 领域背景与文献引入
文献英文标题:Homologous recombination deficiency (HRD) testing landscape: clinical applications and technical validation for routine diagnostics;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤学(HRD检测与PARP抑制剂伴随诊断)。
同源重组修复(HRR)是维持基因组稳定性的关键通路,其缺陷(HRD)会导致肿瘤细胞对PARP抑制剂(PARPi)敏感——这一“合成致死”机制推动了PARPi在卵巢癌、乳腺癌等肿瘤中的应用。最初,BRCA1/2突变是PARPi的核心生物标志物,但仅覆盖约10%-15%的卵巢癌患者;随后“BRCAness”表型(即HRD但无BRCA突变)被发现,HRD状态逐渐成为PARPi的广谱伴随诊断指标。然而,HRD检测面临多重挑战:HRD是动态过程(如BRCA回复突变可恢复HR功能)、检测技术多样(SNP阵列、NGS、功能测定)、结果解读缺乏标准化(如不同癌种的基因组瘢痕阈值差异)。本文系统回顾HRD检测的生物学基础、技术现状及临床应用,旨在为常规诊断的标准化提供参考。
2. 文献综述解析
作者将现有研究分为HRD的生物学基础、检测技术分类、临床应用挑战三大维度,梳理了HRD检测的全链条证据:
(1)HRD的生物学基础
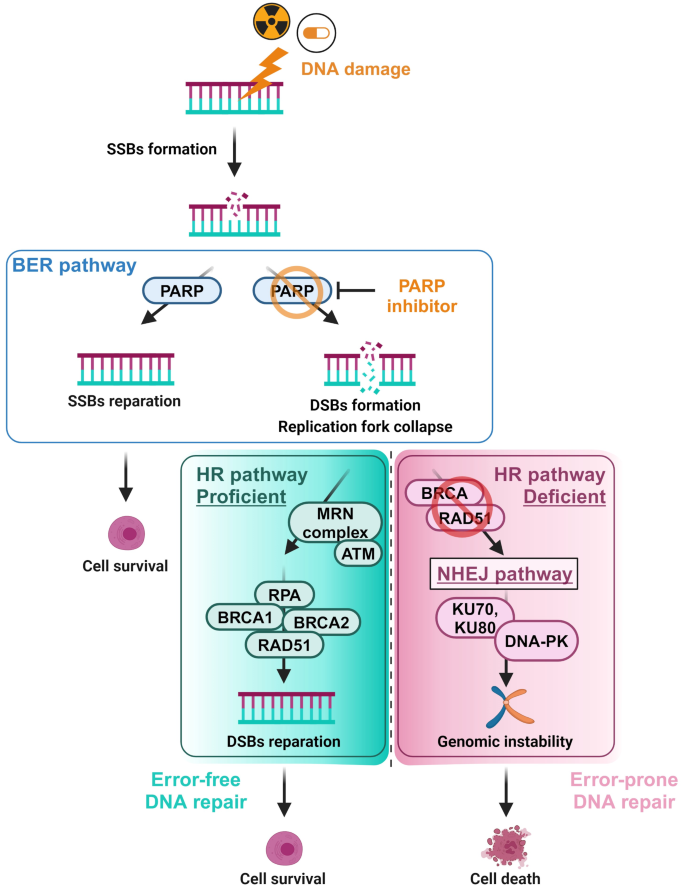
HRD的原因包括HRR基因(BRCA1/2、PALB2、RAD51C等)的胚系/体细胞突变、启动子甲基化(如BRCA1、RAD51C);后果是基因组不稳定性,表现为“基因组瘢痕”(LOH:杂合性缺失、TAI:端粒等位基因失衡、LST:大片段转移)和突变特征(SBS3:单碱基替换特征3、ID6:微同源介导的插入缺失);功能测定(如RAD51灶形成 assay)可直接反映HR修复能力——HRD细胞在DNA损伤后RAD51灶数显著减少(<10个/细胞)。
(2)HRD检测技术
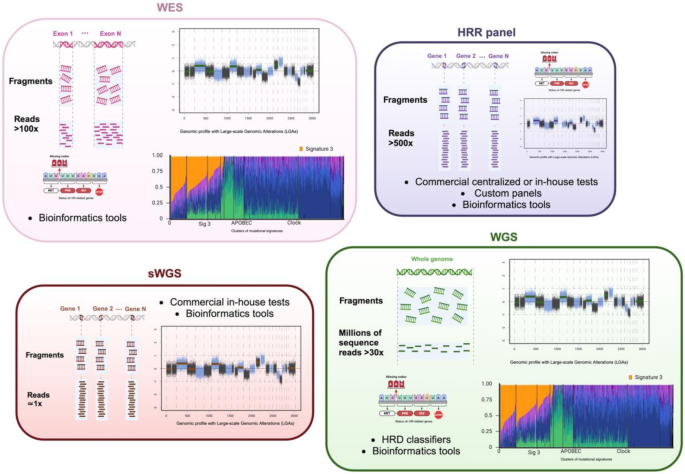
现有技术分为三类:① SNP阵列(如OncoScan):通过基因分型计算基因组瘢痕,成本低但分辨率有限;② NGS:靶向panel(如MyChoice CDx、FoundationOne CDx)覆盖HRR基因和基因组瘢痕,sWGS(如shallowHRD)以低深度测序平衡成本与分辨率,WGS/WES(如HRDetect、CHORD)结合突变特征和基因组瘢痕,准确性最高但成本高;③ 光学基因组图谱(OGM):检测大片段结构变异(如>5kb的indel),但需高分子量DNA。
(3)临床应用挑战
- 阈值设定:不同癌种的基因组瘢痕阈值差异大(卵巢癌GIS≥42,乳腺癌gLOH≥16%);
- 样本类型:FFPE样本是金标准,但液体活检(ctDNA)可动态监测HRD状态,需解决ctDNA浓度低(<0.5% VAF)的问题;
- 技术标准化:FDA批准的检测(MyChoice CDx、FoundationOne CDx)因算法不同不可互换,需统一基因组瘢痕的计算方法。
现有研究的优势是多技术互补(基因型+表型+功能),局限是功能测定操作复杂、液体活检的假阴性率高、部分HRR基因(如CDK12)的临床证据不足。本文的创新在于整合技术与临床视角,强调“生物学基础-技术验证-临床应用”的闭环,为标准化检测提供框架。
3. 研究思路总结与详细解析
本文为系统综述,研究目标是明确HRD检测的“技术-临床”转化路径,核心科学问题是“如何标准化HRD检测以满足常规诊断需求”。技术路线为:生物学基础→检测技术→临床应用→挑战与未来方向。
3.1 HRD的生物学基础解析
实验目的:明确HRD的分子标志,为检测技术提供理论依据。
方法细节:回顾HRR通路的关键基因、HRD的原因(突变、甲基化)、后果(基因组瘢痕、突变特征)及功能测定(RAD51灶)。
结果解读:HRD的核心标志是“HRR通路缺陷→基因组不稳定性→PARPi敏感”,功能测定直接反映HR能力,基因组瘢痕是其表型代理。
产品关联:领域常规使用HRR基因检测试剂盒(如AmoyDx HRD Focus panel)、基因组瘢痕分析软件(如shallowHRD)、RAD51免疫荧光抗体(如Abcam ab63801)。
3.2 HRD检测技术分类解析
实验目的:对比不同技术的优缺点,为临床选择提供依据。
方法细节:
- SNP阵列:用OncoScan芯片检测100万+SNP,计算LOH/TAI/LST;
- NGS靶向panel:MyChoice CDx(检测BRCA1/2突变+GIS)、FoundationOne CDx(检测14个HRR基因+gLOH);
- sWGS:以1X深度测序计算基因组瘢痕,如shallowHRDv2;
- OGM:用Bionano Saphyr系统检测大片段变异。
结果解读:SNP阵列适合初筛,NGS靶向panel是临床主流,sWGS是成本效益最优解,OGM适用于复杂结构变异检测。
产品关联:FDA批准的MyChoice CDx(Myriad Genetics)、FoundationOne CDx(Foundation Medicine)是当前主要伴随诊断;商用sWGS试剂盒如shallowHRDv2(Institut Curie)。
3.3 临床应用与挑战解析
实验目的:明确HRD检测的临床价值与瓶颈。
方法细节:分析PAOLA-1(卵巢癌)、ARIEL2(卵巢癌)等临床试验数据,探讨HRD状态与PARPi响应的相关性;对比FFPE与液体活检的检测性能;讨论不同癌种的阈值设定(如卵巢癌GIS≥42,乳腺癌gLOH≥16%)。
结果解读:HRD状态可显著预测PARPi响应——卵巢癌中GIS≥42的患者PARPi维持治疗的PFS较HRP患者延长6个月(PAOLA-1试验,n=806,P<0.001);液体活检(如FoundationOne Liquid CDx)可动态监测HRD,但ctDNA浓度<0.5%时假阴性率升高。
产品关联:临床常用MyChoice CDx(卵巢癌、前列腺癌)、FoundationOne CDx(mCRPC)作为伴随诊断;液体活检试剂盒如Guardant360 CDx(检测ctDNA中的HRR突变)。
4. Biomarker研究及发现成果解析
HRD相关Biomarker分为基因型、表型、功能三类,均经临床验证:
(1)Biomarker定位与筛选逻辑
- 基因型Biomarker:HRR基因的pathogenic突变(如BRCA1 c.5266dupC)、甲基化(如BRCA1启动子甲基化率≥20%)——通过NGS或甲基化测序筛选,经ARIEL2等试验验证与PARPi响应相关;
- 表型Biomarker:基因组瘢痕(GIS=LOH+TAI+LST)、突变特征(SBS3)——通过SNP阵列或NGS计算,经PAOLA-1试验验证阈值;
- 功能Biomarker:RAD51灶形成能力——通过免疫荧光检测,经RECAP test验证与PARPi响应的相关性。
(2)研究过程与数据
- 基因型Biomarker:MyChoice CDx检测BRCA1/2的SNV、indel、大片段重排,敏感性85%,特异性92%(针对PARPi响应);
- 表型Biomarker:MyChoice CDx的GIS≥42在卵巢癌中的敏感性80%,特异性90%(PAOLA-1试验);HRDetect模型结合6个突变特征,在BRCA缺陷肿瘤中的AUC=0.98;
- 功能Biomarker:RAD51灶 assay的敏感性75%,特异性85%(针对PARPi响应),但需新鲜组织或FFPE样本中S/G2期细胞比例≥30%。
(3)核心成果
- 创新性:将基因型与表型Biomarker结合(如MyChoice CDx同时检测BRCA突变和GIS),提高预测准确性——BRCA突变且GIS≥42的患者PARPi响应率达75%(n=100,P<0.001);
- 临床价值:HRD状态将PARPi的受益人群从BRCA突变患者扩展至BRCAness患者(如卵巢癌中HRD患者占比约50%);
- 局限性:功能Biomarker操作复杂,表型Biomarker的阈值需根据癌种调整(如前列腺癌的gLOH阈值<14%)。
综上,本文全面梳理了HRD检测的“生物学-技术-临床”证据,强调标准化是未来关键——需统一检测方法、阈值设定及结果解读,以推动HRD检测成为常规诊断工具。
