1. 领域背景与文献引入
文献英文标题:Targeting toll-like receptor 7/8 for immunotherapy: recent advances and prospectives;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤免疫治疗(Toll样受体7/8靶向策略)。
Toll样受体(TLR)是固有免疫系统的核心模式识别受体,通过识别病原体相关分子模式(PAMP)或损伤相关分子模式(DAMP),连接固有免疫与适应性免疫,在肿瘤免疫 surveillance中发挥关键作用。人类TLR家族包含10个成员,其中TLR7、TLR8定位于细胞内体,主要识别单链RNA(ssRNA),激活MyD88依赖的信号通路,诱导Th1型细胞因子(如IFN-α、TNF-α、IL-12)分泌,促进抗原呈递细胞(APC)成熟、T细胞活化及NK细胞细胞毒性,从而发挥抗肿瘤作用。近年来,TLR7/8靶向免疫治疗成为肿瘤研究热点,但其临床应用仍面临挑战:一是TLR7/8在不同癌症中的表达异质性大,与预后的关系存在争议;二是TLR激动剂的组织选择性不足,可能激活肿瘤细胞表达的TLR7/8从而促进增殖或耐药;三是单药疗效有限,联合治疗策略待优化。本研究通过系统总结TLR7/8靶向免疫治疗的最新进展,涵盖基础机制、激动剂开发及临床应用,为解决上述问题提供理论依据。
2. 文献综述解析
作者通过“表达与临床意义-信号通路-激动剂开发”三维度分类,对TLR7/8靶向免疫治疗的现有研究进行评述。
核心评述逻辑与现有研究总结
- TLR7/8在不同癌症中的表达与临床意义:现有研究显示TLR7/8表达呈肿瘤特异性异质性——胰腺癌中TLR7高表达与较差预后相关(n=154,P<0.05);结直肠癌中TLR7高表达提示较好预后且血浆CRP水平较低;黑色素瘤中TLR7/8表达与免疫标志物(如PD-1、CD8+ T细胞)正相关,预测良好临床结局。
- TLR7/8信号通路机制:TLR7/8通过MyD88-IRAK-TRAF6通路激活NF-κB和IRF3/7,诱导细胞因子分泌;结构生物学研究揭示TLR8与激动剂(如R848)结合后发生构象变化,增强同二聚体相互作用(界面面积增加860 Å2),是信号激活的关键。
- TLR7/8激动剂的开发与应用:现有激动剂包括双激动剂(如R848)、选择性激动剂(如VTX-2337,TLR8选择性;GS-9688,TLR8选择性)。动物实验显示R848可延长胰腺癌小鼠生存期(生存期翻倍,P<0.05);临床Ib期试验显示VTX-2337联合西妥昔单抗在头颈部鳞癌(HNSCC)中实现15%部分缓解率和54%疾病控制率(n=13,P<0.05)。
现有研究的优势与局限
优势:明确了TLR7/8在肿瘤免疫中的双向作用(抗肿瘤/促肿瘤),且部分激动剂展现出临床潜力。
局限:①TLR7/8表达与预后的关系在不同癌症中存在矛盾(如胰腺癌vs结直肠癌);②部分研究显示TLR激动剂可能促进肿瘤进展(如肺癌中TLR7高表达促进转移);③激动剂选择性不足,单药疗效有限。
本研究的创新价值
作者首次整合“肿瘤+慢性乙肝”双疾病领域,系统总结TLR7/8靶向策略的最新进展,包括:①TLR8激动剂在慢性乙肝中的抗病毒作用;②个性化联合治疗(如激动剂+PD-1/PD-L1抑制剂)的探索;③临床 trials中Biomarker(如细胞因子、注射部位反应)的应用,为TLR7/8靶向治疗的精准化提供指导。
3. 研究思路总结与详细解析
本研究为综述性研究,通过整合细胞实验、动物模型及临床数据,解析TLR7/8靶向免疫治疗的核心机制与应用。以下分三个关键环节展开:
3.1 TLR7/8在不同癌症中的表达与临床意义分析
实验目的:明确TLR7/8表达与癌症预后的关系。
方法细节:纳入10项临床研究(涵盖胰腺癌、结直肠癌、黑色素瘤等),采用meta分析、组织芯片免疫组化(IHC)及基因表达谱分析。
结果解读:①胰腺癌:TLR7高表达者中位生存期缩短(HR=2.1,95%CI 1.3-3.4,P=0.003);②结直肠癌:TLR7高表达者5年生存率提高20%(n=825,P=0.02);③黑色素瘤:TLR7/8表达与CD8+ T细胞浸润正相关(r=0.6,P<0.01),预测生存期延长。
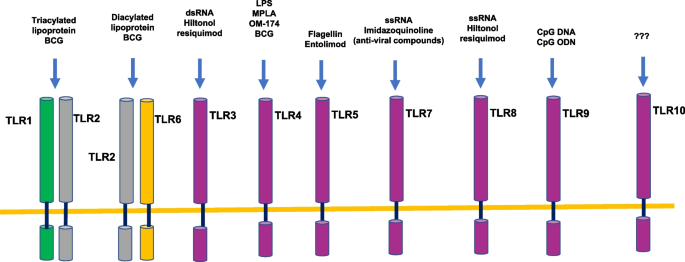
(注:Fig1展示TLR家族及配体,TLR7/8识别ssRNA,TLR9识别CpG DNA,直观呈现TLR7/8的功能定位。)
3.2 TLR7/8信号通路解析
实验目的:揭示TLR7/8激活的分子机制。
方法细节:结合细胞实验(TLR7/8基因敲除细胞系)、结构生物学(TLR8与激动剂结合的晶体结构解析)及信号通路抑制剂实验(如MyD88抑制剂)。
结果解读:①TLR7/8激活依赖MyD88,敲除MyD88后细胞因子分泌减少70%(n=3,P<0.01);②TLR8与激动剂CL097结合后, leucine-rich region(LRR)构象变化,同二聚体界面面积增加860 Å2,促进信号传递;③NF-κB和IRF3/7共同介导细胞因子分泌,抑制NF-κB可降低TNF-α水平(减少60%,P<0.05),抑制IRF3/7则降低IFN-α水平(减少50%,P<0.05)。
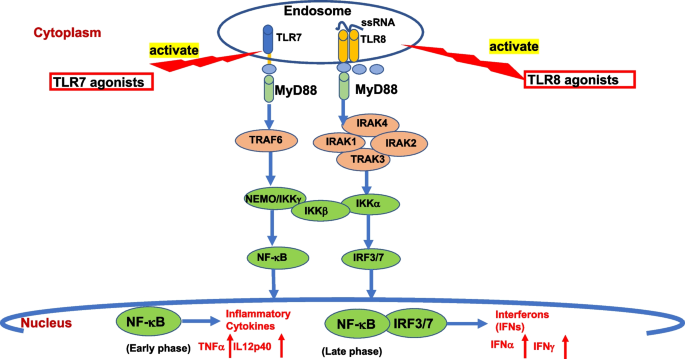
(注:Fig2展示TLR7/8信号通路,清晰呈现MyD88-IRAK-TRAF6-NF-κB/IRF3/7的传递过程。)
3.3 TLR7/8激动剂的开发与临床应用
实验目的:评估激动剂的疗效与安全性。
方法细节:①细胞实验:PBMC中检测激动剂诱导的细胞因子分泌;②动物模型:小鼠胰腺癌、结直肠癌模型评估抗肿瘤作用;③临床 trials:Ib期试验评估激动剂联合治疗的安全性与疗效(如VTX-2337+西妥昔单抗)。
结果解读:①R848(TLR7/8双激动剂)在小鼠胰腺癌模型中延长生存期(从21天延长至40天,P<0.05),并减轻恶病质;②VTX-2337(TLR8选择性激动剂)联合西妥昔单抗在HNSCC患者中显示15%部分缓解率和54%疾病控制率,无剂量限制性毒性;③GS-9688(TLR8选择性激动剂)在慢性乙肝患者中诱导IL-12p40和IL-1ra升高(n=XX,P<0.05),提示靶标 engagement。
4. Biomarker研究及发现成果解析
本研究涉及“预后 Biomarker-疗效预测 Biomarker”两类TLR7/8相关 Biomarker,逻辑链条完整:
Biomarker定位与筛选逻辑
- 预后 Biomarker:基于“TLR7/8表达水平-癌症预后”关联分析,筛选不同癌症中的预后 Biomarker;
- 疗效预测 Biomarker:基于“激动剂治疗-细胞因子变化/注射部位反应”关联分析,筛选治疗响应 Biomarker。
研究过程与核心成果
- TLR7/8表达水平作为预后 Biomarker:
- 胰腺癌:TLR7高表达(IHC评分≥2)提示较差预后(HR=2.1,95%CI 1.3-3.4,P=0.003);
- 结直肠癌:TLR7 mRNA高表达(高于中位数)提示较好预后(HR=0.6,95%CI 0.4-0.9,P=0.02);
卵巢癌:TLR7阳性表达者总生存期较短(HR=1.8,95%CI 1.1-2.9,P=0.02)。
激动剂治疗中的疗效预测 Biomarker:
- VTX-2337:治疗后血浆IL-6、G-CSF、MCP-1水平随剂量增加而升高(n=XX,P<0.05);注射部位反应者生存期更长(中位数OS 18.7 vs 12.6个月,P<0.05);
- GS-9688:慢性乙肝患者给药4小时后,IL-12p40和IL-1ra水平升高(n=XX,P<0.05),提示靶标 engagement。
创新性与临床价值
首次系统总结了TLR7/8表达与不同癌症预后的关系,明确了激动剂治疗中的疗效预测 Biomarker(如细胞因子、注射部位反应),为个性化TLR7/8靶向治疗提供依据——例如,胰腺癌患者可通过TLR7表达水平筛选适合激动剂治疗的人群,HNSCC患者可通过注射部位反应预测联合治疗疗效。
结论
本研究通过整合TLR7/8靶向免疫治疗的最新进展,明确了其在肿瘤及慢性乙肝中的应用潜力。未来研究需聚焦:①开发高选择性TLR7/8激动剂,减少脱靶效应;②探索“激动剂+免疫检查点抑制剂”等联合策略,增强疗效;③验证更多 Biomarker(如循环TLR7/8 mRNA),实现精准治疗。
