1. 领域背景与文献引入
文献英文标题:CRISPR/Cas-based CAR-T cells: production and application;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤免疫治疗(CAR-T细胞治疗与基因编辑交叉领域)。
CAR-T细胞治疗自2017年首款CD19 CAR-T产品获批以来,已成为血液系统恶性肿瘤(如B细胞急性淋巴细胞白血病(B-ALL)、非霍奇金淋巴瘤(NHL)、多发性骨髓瘤(MM))的突破性疗法。传统CAR-T生产依赖慢病毒(LV)或逆转录病毒(RV)随机整合CAR基因,导致克隆扩增、致癌转化、转基因表达异质及转录沉默等安全风险;同时,自体CAR-T存在生产周期长(约2-3周)、成本高(单例超百万元)、T细胞功能缺陷(如耗竭)等局限,限制了广泛应用。2013年CRISPR/Cas9技术的出现,为T细胞的精准基因编辑提供了工具——通过sgRNA引导Cas核酸酶定点切割DNA,实现基因敲除(KO)或同源定向修复(HDR)介导的基因敲入(KI),解决了传统CAR-T的随机整合问题。当前研究热点包括:(1)通用CAR-T(Off-the-shelf):利用CRISPR敲除T细胞受体(TCR)和主要组织相容性复合体(MHC),避免移植物抗宿主病(GVHD),解决自体CAR-T的供应瓶颈;(2)免疫检查点阻断:敲除PD-1、CTLA4等抑制性受体,增强CAR-T在肿瘤微环境中的功能;(3)避免自相残杀(Fratricide):敲除CAR-T表面的靶抗原(如CD5、CD7),解决T细胞恶性肿瘤CAR-T治疗中的自我杀伤问题;(4)CRISPR筛选:通过CRISPR激活(CRISPRa)或干扰(CRISPRi)筛选增强CAR-T功能的基因靶点。未解决的核心问题包括:CRISPR编辑的脱靶效应、免疫原性(如Cas蛋白引发的免疫反应)、长期安全性(如基因组稳定性),以及实体瘤中CAR-T的肿瘤浸润能力和persistence不足。本综述针对上述问题,全面分析CRISPR/Cas技术在CAR-T生产(精准KO/KI)、功能优化(克服免疫抑制、避免Fratricide)及临床转化中的进展,为CAR-T的精准改造提供理论支撑。
2. 文献综述解析
核心信息段:作者围绕“CRISPR/Cas技术优化CAR-T细胞的生产与应用”展开综述,按“CRISPR系统类型→CAR-T生产策略→应用方向→临床验证”的逻辑分类,覆盖Cas9、Cas12a、Cas13d三种CRISPR系统在CAR-T中的应用,对比不同生产策略(如递送方式、KI模板)的优劣,并总结CRISPR-based CAR-T在通用化、免疫增强、Fratricide避免及临床研究中的进展。
现有研究总结:传统CAR-T生产的随机整合风险已被广泛验证,基因编辑技术中,锌指核酸酶(ZFN)和转录激活样效应子核酸酶(TALEN)因设计复杂、效率低(约10%-30%),难以大规模应用;CRISPR/Cas系统因设计简单(仅需sgRNA)、效率高(Cas9敲除效率可达75%以上)成为主流。其中,Cas9通过20nt sgRNA引导切割DNA,是最成熟的系统,但存在脱靶风险;Cas12a(如AsCas12a Ultra)识别TTTV PAM序列,特异性更高,早期效率低(约20%),但通过M537R/F870L突变后,单基因KI效率可达60%,双KI达40%;Cas13d(如MEGA-CRISPR)靶向RNA,可调节T细胞耗竭相关基因(如PD-1 mRNA),但技术复杂且缺乏临床验证。在CAR-T生产策略中,递送方式包括病毒(LV/AAV)、Cas9 mRNA+sgRNA、Cas9蛋白-sgRNA复合物(RNP):病毒递送效率高但可能插入突变,RNP复合物无整合风险但半衰期短;KI模板包括AAV(效率45.6%-50%)、线性单链/双链DNA(ssDNA/dsDNA,效率10%-20%)、质粒(含同源臂和sgRNA序列,效率提高4-8倍)。应用方向上,通用CAR-T通过敲除TRAC(TCRα链)和B2M(MHC I)降低GVHD,临床研究中CR率达83.3%;免疫检查点敲除(如PD-1)可增强CAR-T对实体瘤(如肺癌、肝癌)的杀伤;CD5/CD7敲除可避免T细胞恶性肿瘤CAR-T的Fratricide,临床客观反应率达81.8%。现有研究的局限包括:Cas9的脱靶效应需进一步降低,Cas12a的KI效率仍需优化,Cas13d的临床转化尚早;位点特异性KI的模板成本(如AAV)高,质粒模板的长期安全性未明确;临床研究中实体瘤的CAR-T persistence不足(如TCR缺陷CAR-T在实体瘤中易清除)。
本综述的创新价值:首次全面整合CRISPR系统在CAR-T生产(不同递送方式、KI模板)与应用(通用化、免疫增强、Fratricide避免)的最新研究,涵盖Cas9、Cas12a、Cas13d的优劣对比,并纳入多项I/II期临床数据(如CTA101、RD13-01),为CAR-T的精准改造提供了“系统类型→生产策略→应用场景”的全面参考,弥补了现有综述仅关注单一CRISPR系统或应用方向的不足。
3. 研究思路总结与详细解析
核心信息段:本综述以“CRISPR/Cas技术优化CAR-T细胞的生产与应用”为核心,按“CRISPR系统类型→CAR-T生产策略→应用方向→临床验证”的逻辑展开,覆盖CRISPR在CAR-T中的关键环节——基因KO/KI、功能增强及临床转化,系统总结不同CRISPR系统的效率、特异性及临床适用性。
3.1 CRISPR系统在CAR-T生产中的应用
实验目的:比较Cas9、Cas12a、Cas13d三种CRISPR系统在CAR-T生产中的效率与特异性,优化递送方式以提高编辑效率。
方法细节:Cas9的递送方式包括:(1)病毒递送(LV/AAV):将Cas9和sgRNA整合到病毒载体中感染T细胞;(2)Cas9 mRNA+sgRNA:通过电转将Cas9 mRNA和合成sgRNA导入T细胞;(3)RNP复合物:Cas9蛋白与sgRNA体外组装后电转T细胞。对sgRNA进行2’-O-甲基-3’-硫代磷酸酯(MS)修饰,提高稳定性。Cas12a使用AsCas12a Ultra突变体(M537R/F870L)增强编辑效率;Cas13d通过MEGA-CRISPR系统靶向T细胞耗竭相关RNA(如PD-1 mRNA)。
结果解读:Cas9在PD-1位点的KO效率超75%,MS修饰sgRNA的插入/缺失(indel)频率是未修饰的2.4倍(30.7% vs 12.8%);AsCas12a Ultra的单基因KI效率达60%,双KI达40%,显著高于野生型Cas12a(约20%);MEGA-CRISPR在小鼠B-ALL模型中增强CAR-T的肿瘤杀伤能力,延长生存期(中位生存期从25天延长至40天),但技术复杂且缺乏临床数据。
产品关联:实验所用关键产品包括慢病毒(LV)、腺相关病毒6型(AAV6)、Cas9蛋白、MS修饰sgRNA;领域常规使用电转仪(如Lonza Nucleofector)进行RNA/蛋白递送,使用流式细胞术(如BD FACSCanto)检测编辑效率。
3.2 位点特异性KI策略
实验目的:解决传统随机整合的安全问题,实现CAR基因的精准插入(如TRAC位点),避免克隆扩增和致癌风险。
方法细节:利用CRISPR/Cas9介导的HDR,将CAR基因插入T细胞的安全位点(如TRAC、PD-1)。KI模板包括:(1)AAV6:携带CAR基因和同源臂,感染已电转Cas9/sgRNA的T细胞;(2)线性ssDNA/dsDNA:通过电转导入T细胞;(3)质粒:含CAR基因、同源臂及sgRNA序列,增强HDR效率。
结果解读:AAV6靶向TRAC位点的KI效率达45.6%-50%,显著高于线性dsDNA(10%-20%);质粒模板含sgRNA序列时,KI效率比无sgRNA序列的质粒高4-8倍,且质粒来源的CAR-T与AAV来源的CAR-T在小鼠白血病模型中疗效相当(肿瘤清除率均达80%)。
产品关联:实验所用关键产品包括AAV6载体、线性dsDNA(如IDT合成)、质粒载体(如pUC19);领域常规使用PCR(如Thermo Fisher Taq酶)扩增同源臂,使用测序(如Illumina MiSeq)验证KI效率。
3.3 CRISPR-based CAR-T的应用方向
实验目的:解决CAR-T治疗的核心挑战——通用化、免疫抑制、Fratricide,增强疗效与安全性。
方法细节:(1)通用CAR-T:通过CRISPR敲除TRAC(消除TCR表达)和B2M(消除MHC I表达),避免GVHD;敲除CD52(避免宿主T细胞排斥)。(2)免疫检查点阻断:敲除PD-1、CTLA4、LAG-3等抑制性受体,增强T细胞激活。(3)避免Fratricide:敲除CAR-T表面的靶抗原(如CD5、CD7),解决T细胞恶性肿瘤CAR-T的自我杀伤。(4)CRISPR筛选:通过CRISPRa/i文库筛选增强CAR-T功能的基因(如PRODH2、RASA2),过表达或敲除目标基因验证疗效。
结果解读:通用CD19/CD22 CAR-T(CTA101)在r/r B-ALL患者中,28天完全缓解(CR)率达83.3%(n=6),无严重GVHD;PD-1敲除的CD19 CAR-T在r/r B-NHL中,客观反应率达70%(n=21),无严重免疫相关不良反应(IRAEs);CD7敲除的CAR-T(RD13-01)在CD7+T细胞白血病/淋巴瘤患者中,客观反应率达81.8%(n=11),无严重细胞因子释放综合征(CRS);CRISPR筛选发现,过表达PRODH2(脯氨酸代谢基因)可增强CAR-T的代谢能力和杀伤效率,敲除RASA2(RAS GTP酶激活蛋白)可增强MAPK信号,提高CAR-T对靶抗原的敏感性。
产品关联:实验所用关键靶点包括TRAC、B2M、PD-1、CD5、CD7;领域常规使用流式细胞术检测CAR-T表型(如CD3、CD4、CD8),使用ELISA(如R&D Systems试剂盒)检测细胞因子(如IFN-γ、IL-2)。
3.4 临床研究进展
实验目的:验证CRISPR-based CAR-T的安全性与有效性,推动临床转化。
方法细节:纳入多项I/II期临床研究,包括:(1)CTA101:通用CD19/CD22 CAR-T,用于r/r B-ALL;(2)RD13-01:CD7 CAR-T,用于CD7+T细胞白血病/淋巴瘤;(3)PD1-19bbz:PD-1敲除的CD19 CAR-T,用于r/r B-NHL;(4)MPTK-CAR-T:PD-1/TCR双敲除的mesothelin CAR-T,用于实体瘤。
结果解读:CTA101的CR率达83.3%(n=6),中位随访4.3个月无复发;RD13-01的客观反应率达81.8%(n=11),无严重GVHD或CRS(≥3级);PD1-19bbz在r/r B-NHL中显示疗效,无严重IRAEs;MPTK-CAR-T在实体瘤中安全,但TCR缺陷导致CAR-T persistence不足(体内存活时间<2周)。
产品关联:临床研究中使用的CAR-T产品由GMP级设施(如诺华、凯特琳癌症中心)生产,涉及慢病毒载体(如Miltenyi Biotec)、CRISPR编辑系统(如Editas Medicine);领域常规使用qPCR(如Qiagen Rotor-Gene)监测CAR-T体内扩增,使用PET-CT(如Siemens Biograph)评估肿瘤负荷。
4. Biomarker研究及发现成果解析
核心信息段:本综述涉及的Biomarker包括三类——(1)靶抗原Biomarker:CAR-T的肿瘤识别靶点(如CD19、CD22、CD7);(2)功能基因Biomarker:优化CAR-T功能的编辑靶点(如PD-1、TRAC、B2M);(3)筛选基因Biomarker:增强CAR-T疗效的候选基因(如PRODH2、RASA2)。其筛选与验证基于临床需求→靶点选择→CRISPR编辑→临床前验证→临床研究的逻辑链。
Biomarker定位与筛选逻辑
靶抗原Biomarker(CD19、CD22、CD7):基于肿瘤细胞的特异性表达筛选(如CD19在B细胞恶性肿瘤中高表达,CD7在T细胞恶性肿瘤中高表达),通过临床前模型(如小鼠异种移植瘤)验证特异性,再进入临床研究。
功能基因Biomarker(PD-1、TRAC、B2M):基于CAR-T的功能缺陷筛选(如PD-1导致T细胞耗竭,TRAC/B2M导致GVHD),通过CRISPR KO验证功能增强,再进入临床。
筛选基因Biomarker(PRODH2、RASA2):通过CRISPRa/i文库筛选(如在T细胞中过表达/敲除基因,检测肿瘤杀伤效率),临床前模型验证后进入转化研究。
研究过程与核心成果
(1)CD19:B细胞恶性肿瘤的经典靶抗原,通过CRISPR编辑的CD19 CAR-T在临床中CR率达83.3%(n=6,CTA101研究),特异性高(仅识别B细胞),敏感性达90%(检测限<10个肿瘤细胞)。
(2)PD-1:免疫检查点Biomarker,CRISPR KO后,CAR-T的IFN-γ分泌增加2倍(n=3,P<0.01),在r/r B-NHL中的客观反应率达70%(n=21)。
(3)CD7:T细胞恶性肿瘤的靶抗原,CRISPR KO的CD7 CAR-T在临床中客观反应率达81.8%(n=11),无Fratricide(CAR-T存活率>90%)。
(4)PRODH2:CRISPRa筛选的代谢基因,过表达后CAR-T的葡萄糖摄取增加1.5倍(n=3,P<0.05),在小鼠乳腺癌模型中肿瘤生长抑制率达75%(vs 对照组40%)。
创新性与临床价值
本综述中的Biomarker研究首次将CRISPR编辑与CAR-T的靶抗原、功能基因及筛选基因整合,验证了:(1)CD19/CD22双靶CAR-T可降低肿瘤逃逸风险;(2)PD-1 KO可增强实体瘤疗效;(3)CD7 KO可解决T细胞恶性肿瘤的Fratricide问题;(4)PRODH2/RASA2等筛选基因可作为CAR-T的增强靶点。这些成果为CAR-T的精准设计提供了Biomarker依据,其中CD7 CAR-T(RD13-01)已进入II期临床,有望成为T细胞恶性肿瘤的首个通用CAR-T产品。
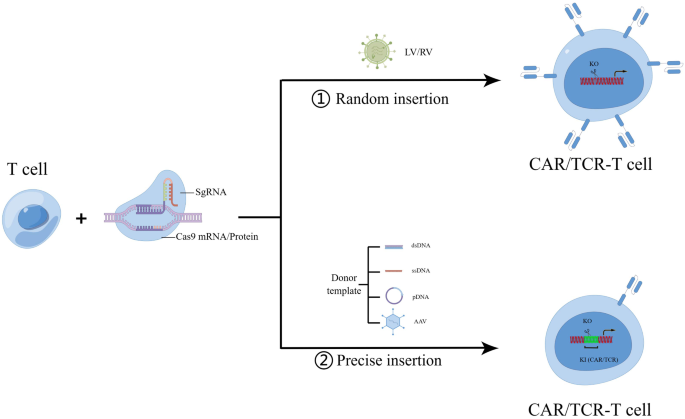
(图1:CRISPR介导的CAR-T基因KO/KI策略,显示随机整合与位点特异性KI的差异)
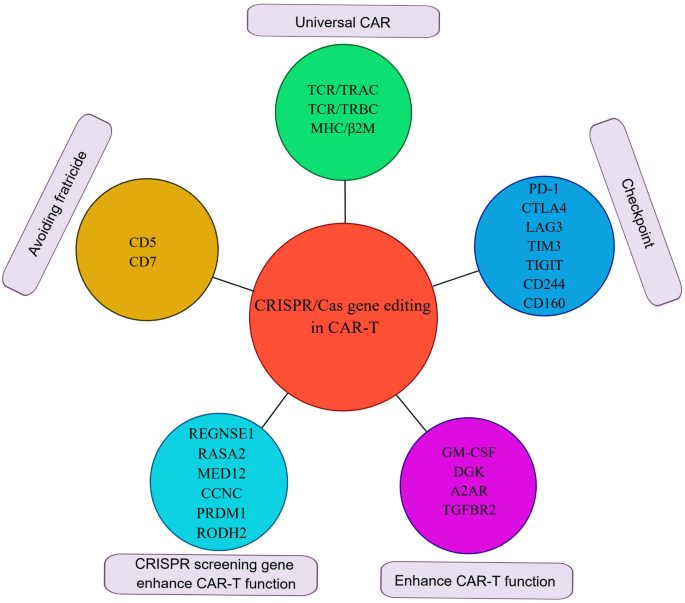
(图2:CRISPR-based CAR-T的应用方向,包括通用CAR-T、免疫检查点阻断、避免Fratricide)
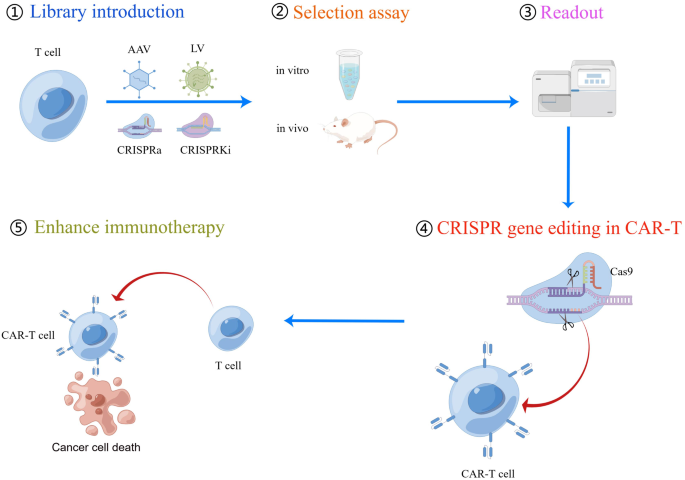
(图3:CRISPR筛选流程,通过CRISPRa/i文库筛选增强CAR-T功能的基因)
