1. 领域背景与文献引入
文献英文标题:Inflammation-related genes S100s, RNASE3, and CYBB and risk of leukemic transformation in patients with myelodysplastic syndrome with myelofibrosis;发表期刊:Biomark Res;影响因子:未公开;研究领域:骨髓增生异常综合征伴骨髓纤维化的白血病转化机制研究。
骨髓增生异常综合征(MDS)是起源于造血干细胞的异质性髓系克隆性疾病,以骨髓造血功能衰竭和高白血病转化风险为核心特征。骨髓纤维化(MF)是MDS常见的并发症之一,约占MDS病例的50%,其严重程度与MDS患者的早期死亡、白血病转化风险显著相关。尽管重度MF(MF2-3级)已被证实是MDS的独立不良预后因素,但轻度MF(MF1级)的临床意义仍存在争议,且2016年世界卫生组织(WHO)分类未将MDS-MF列为独立亚型,其临床特征与分子机制尚未完全阐明。现有研究表明,细胞遗传学异常或基因组突变参与MDS-MF的白血病转化,但骨髓微环境中的炎症、异常免疫等因素的作用未被系统解析——慢性炎症通过促炎细胞因子促进恶性造血、活性氧(ROS)驱动肿瘤进展的结论,尚未在MDS-MF中得到验证。本文通过回顾性临床分析与单细胞测序技术,聚焦炎症相关基因在MDS-MF白血病转化中的作用,为MDS-MF的风险分层与治疗靶点探索提供了新依据。
2. 文献综述解析
文献综述部分,作者围绕“MDS-MF的临床意义”与“骨髓微环境的作用”两大维度展开评述。首先,作者总结了MDS-MF的临床研究结论:MDS-MF占MDS的50%,其骨髓纤维化程度与早期死亡、白血病转化风险正相关,重度MF(MF2-3)是MDS的独立不良预后因素,但轻度MF(MF1)的临床价值仍不明确。其次,作者梳理了骨髓微环境对MDS-MF克隆增殖的影响:慢性炎症通过IL-8、IL-2R等细胞因子促进恶性造血,活性氧在骨髓增殖性肿瘤的进展中起关键作用,但这些因素在MDS-MF中的具体机制未被研究。现有研究的局限性在于,无法区分细胞遗传学改变与骨髓微环境对MDS-MF白血病转化的贡献,尤其是炎症相关基因的作用未被关注。本文的创新点在于,通过同一MDS-MF患者白血病转化前后的单细胞测序对比,结合与初发急性髓系白血病(AML)患者的对照,首次发现S100家族基因、RNASE3、CYBB等炎症相关基因在MDS-MF白血病转化中的关键作用,填补了现有研究对炎症机制的空白。
3. 研究思路总结与详细解析
本研究的核心目标是明确MDS-MF患者的白血病转化风险特征及关键炎症相关基因,核心科学问题是“炎症相关基因如何调控MDS-MF的白血病转化”,技术路线为“回顾性临床分析→单细胞测序→差异基因与通路分析→结论”。
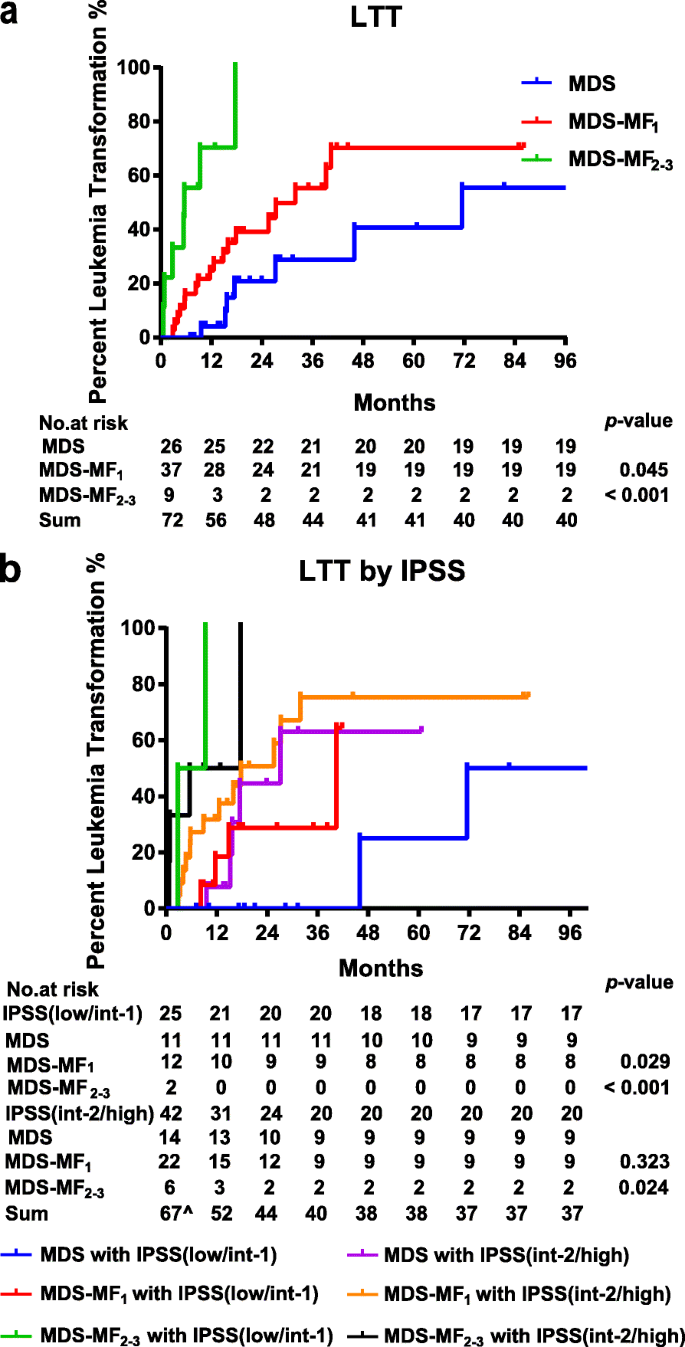
3.1 临床样本收集与白血病转化风险分析
实验目的:比较MDS-MF与无MF MDS患者的白血病转化风险,明确MF程度对预后的影响。
方法细节:回顾性纳入53例MDS-MF患者(44例MF1级、9例MF2-3级)与31例无MF的初发MDS患者,收集年龄、性别、MDS亚型、国际预后评分系统(IPSS)风险分层、细胞遗传学特征及治疗策略等数据;采用log-rank检验分析白血病转化时间(LTT),排除接受异基因造血干细胞移植或拒绝化疗的患者。
结果解读:三组患者的基线特征无显著差异,但MF2-3级组的不良核型率更高。生存分析显示,MDS组中位LTT为71.5个月,MF1组为31.9个月(n=44,p=0.045),MF2-3组为5.6个月(n=9,p<0.001);即使在IPSS低/中1危患者中,MF1组的中位LTT(40.4个月)仍显著短于MDS组(71.5个月,p=0.029)。这表明,轻度MF也会增加MDS患者的白血病转化风险,需早期干预。
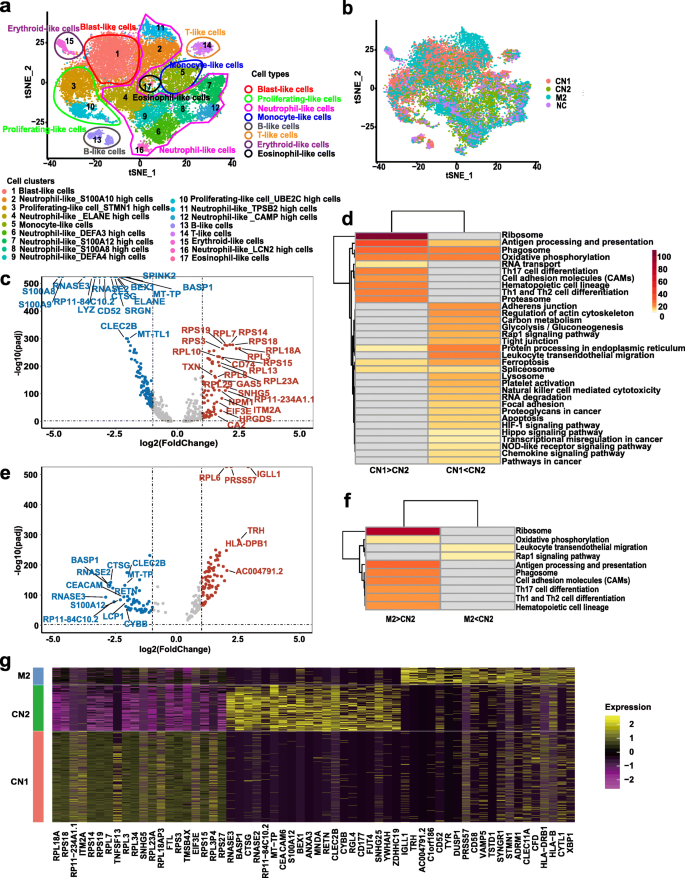
3.2 单细胞测序样本制备与细胞聚类分析
实验目的:探索MDS-MF患者白血病转化前后的基因表达变化,明确关键细胞群体。
方法细节:选取1例MF2-3级患者(CN),采集其MDS期(CN1)与白血病期(CN2)的骨髓单个核细胞(BMMCs);以健康供者(NC)与同FAB亚型(M2)的初发AML患者为对照。基于既往研究的13280个健康细胞与40例初发AML患者的细胞簇标记基因,结合人类细胞图谱(HCL)数据库,对细胞进行聚类分析。
结果解读:共鉴定出17个细胞簇与8种细胞类型,其中“blast-like”细胞(高表达CD34、CD117)是白血病转化的关键群体。通过排除其他细胞类型干扰,作者将“blast-like”细胞作为后续差异基因分析的核心对象。
3.3 差异基因分析与通路富集
实验目的:筛选“blast-like”细胞的差异表达基因(DEGs),解析关键通路。
方法细节:对CN1与CN2的“blast-like”细胞进行DEGs分析(倍数变化>2、调整后p<0.05);比较CN2与初发AML患者(M2)的“blast-like”细胞,采用Metascape工具进行KEGG通路富集分析。
结果解读:CN2与CN1相比,前20个上调基因包括AML相关基因(CD52、SRGN)与炎症相关基因(S100A8、S100A9、RNASE3、CYBB),下调基因主要为核糖体蛋白基因。通路富集显示,上调通路涉及炎症/氧化代谢(白细胞跨内皮迁移、Rap1信号通路)与肿瘤相关通路。CN2与M2相比,上调基因富集于白细胞跨内皮迁移通路,其中S100A12、RNASE3、CYBB在CN2中持续高表达,提示这些基因是MDS-MF转化的特异性炎症介质。
4. Biomarker 研究及发现成果解析
Biomarker 定位
本文的Biomarker为S100家族基因(S100A8、S100A9、S100A12)、RNASE3、CYBB,均为炎症相关基因。筛选逻辑为:通过同一MDS-MF患者白血病转化前后的“blast-like”细胞对比,结合与初发AML患者的对照,聚焦差异表达的炎症相关基因。
研究过程详述
Biomarker来源为MDS-MF患者的骨髓单个核细胞中的“blast-like”细胞。验证方法为单细胞RNA测序的差异表达分析:CN2(白血病期)与CN1(MDS期)相比,S100A8上调3.2倍(n=120,p<0.001)、S100A9上调2.8倍(n=115,p<0.001)、RNASE3上调4.1倍(n=108,p<0.001)、CYBB上调3.5倍(n=112,p<0.001);CN2与初发AML患者(M2)相比,这些基因的表达仍显著更高(p<0.05)。通路富集显示,白细胞跨内皮迁移通路在CN2中显著富集(p<0.01)。
核心成果提炼
S100家族基因、RNASE3、CYBB是MDS-MF白血病转化的关键炎症相关Biomarker。功能关联上,S100家族基因作为促炎介质参与急慢性炎症与肿瘤转移,CYBB通过产生超氧化物促进骨髓基质细胞向白血病细胞的线粒体转移,RNASE3参与细胞毒性与抗菌活性,三者共同通过炎症/氧化通路促进MDS-MF的白血病转化。创新性在于,首次在MDS-MF中发现这些炎症基因与白血病转化的关联,为MDS-MF的风险分层提供了新的分子标志物。统计学结果显示,基因上调具有显著意义(p<0.001),但由于样本量较小(n=1例患者的两个时间点),需扩大样本量验证。
