1. 领域背景与文献引入
文献英文标题:Not BCL2 mutation but dominant mutation conversation contributed to acquired venetoclax resistance in acute myeloid leukemia;发表期刊:Biomark Res;影响因子:未公开;研究领域:急性髓系白血病(AML)获得性维奈克拉(VEN)耐药机制。
急性髓系白血病是成人最常见的急性白血病类型,老年患者(≥60岁)因不耐受强化化疗,预后极差。维奈克拉(一种BCL2抑制剂)联合阿扎胞苷(AZA)是当前老年AML的一线治疗方案,可使完全缓解(CR)加不完全血液学恢复的完全缓解(CRi)率达到70%以上,但患者3年生存率仍不足40%,主要原因是获得性维奈克拉耐药。现有研究表明,慢性淋巴细胞白血病(CLL)中维奈克拉耐药的核心机制是BCL2基因突变(如Gly101Val),通过改变维奈克拉与BCL2的结合亲和力介导耐药,但AML患者的维奈克拉暴露时间更短(中位数5个月 vs CLL的36个月)且联合AZA治疗,BCL2突变是否参与AML的维奈克拉耐药尚不明确。此外,克隆进化(新出现突变或现有突变的重构)也被认为可能与AML耐药相关,但哪种机制更占主导仍缺乏临床证据。针对这一领域空白,研究团队通过回顾性分析9例获得性维奈克拉耐药的AML患者,探讨了耐药的分子机制。
2. 文献综述解析
作者对现有研究的评述逻辑围绕“维奈克拉疗效-耐药限制-机制未知”展开:首先,现有研究肯定了维奈克拉+AZA对老年AML的疗效,但耐药导致长期生存获益有限;其次,CLL中BCL2突变是维奈克拉耐药的关键,但AML中缺乏相关数据,且AML的治疗模式(联合AZA、更短暴露时间)可能影响BCL2突变的发生;最后,部分研究提示克隆进化(如新出现的TP53突变或现有突变的扩增)可能参与AML耐药,但具体哪种机制更重要未明确。
作者的创新点在于首次通过临床队列明确BCL2突变不是AML中维奈克拉耐药的主要原因,而是现有突变的优势转换(如FLT3-ITD从次要突变扩增为主要突变)是更关键的机制。这一发现修正了“BCL2突变是维奈克拉耐药通用机制”的认知,为AML耐药的监测和干预提供了新方向。
3. 研究思路总结与详细解析
本研究的核心目标是明确AML中获得性维奈克拉耐药的分子机制,核心科学问题是“BCL2突变是否参与AML耐药?克隆进化中的哪种模式(新突变/现有突变重构)更主导?”,技术路线为“回顾性患者队列→BCL2突变检测→突变谱分析→克隆进化验证”。
3.1 患者队列构建与临床资料收集
实验目的是获取具有获得性维奈克拉耐药的AML患者样本,以关联临床特征与分子机制。方法是回顾性纳入2018年7月至2020年6月期间在中心接受治疗的9例老年AML患者(年龄均≥60岁),所有患者均接受维奈克拉+AZA一线治疗并发展为获得性耐药(维奈克拉起始治疗后6个月内复发或进展)。收集患者治疗起始(VEN-I)和耐药时(VEN-R)的临床资料(如维奈克拉暴露时间、疗效评价)及骨髓/外周血样本。结果显示,患者的维奈克拉暴露时间中位数为5个月(3-9个月),其中2例患者暴露时间≥1年;所有患者均经骨髓形态学和流式细胞学确认耐药。实验所用关键产品:临床资料由医院电子病历系统收集,样本存储使用领域常规的-80℃低温冰箱。
3.2 BCL2突变检测与验证
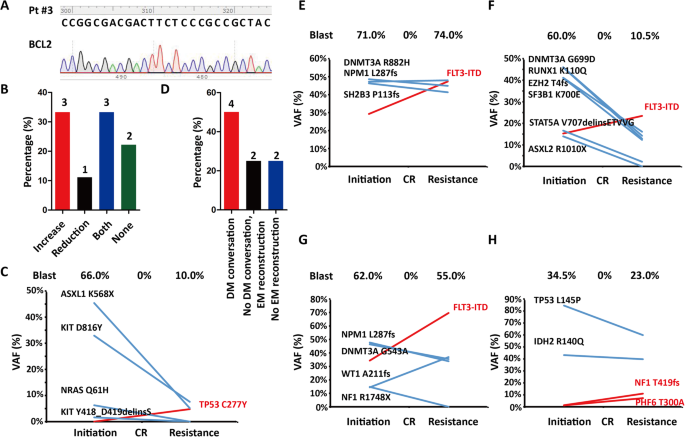
实验目的是明确BCL2突变是否参与AML的维奈克拉耐药。方法是首先采用PCR联合Sanger测序检测VEN-I和VEN-R时的BCL2突变(覆盖已知耐药位点如Gly101Val、Phe104Ile);因Sanger测序分辨率较低(无法检测VAF<5%的突变),进一步采用靶向外显子测序(TES)验证,测序覆盖236个血液系统恶性肿瘤复发突变基因,平均目标区域测序深度≥1000,变异等位基因频率(VAF)≥1%视为有意义。结果显示,所有患者的BCL2突变检测均为阴性(图1a),即使在2例暴露时间≥1年的患者中也未发现,提示BCL2突变不是AML中维奈克拉耐药的原因。
实验所用关键产品:PCR试剂为领域常规(如TaKaRa Ex Taq),Sanger测序由商业公司完成,TES测序使用Illumina Novaseq平台。
3.3 突变景观与克隆进化分析
实验目的是比较VEN-I和VEN-R时的突变类型及频率,探讨克隆进化对耐药的影响。方法是通过TES测序分析9例患者治疗前后的突变谱,统计突变基因的类型(如FLT3、TP53、IDH2)、VAF变化(新出现突变或现有突变的VAF升高/降低)。结果显示:7/9患者的突变谱发生偏移(3例突变基因减少,1例增加,3例部分减少部分增加,图1b);新出现的TP53突变(如患者#8)可介导耐药(图1c),但此类新突变的VAF较低(多<10%),仅为亚克隆;6/8患者(排除无分子复发的患者#9)出现现有突变的重构,其中4/8患者发生优势突变转换(即原有次要突变扩增为主要突变,图1d)。例如,FLT3-ITD(AML中最常见的突变)在患者#3、#6、#7中从VEN-I时的次要突变(VAF<10%)扩增为VEN-R时的主要突变(VAF>30%,图1e-g);患者#1中IDH2R140Q和TP53L145P的VAF逐渐降低,而NF1T419fs和PHF6T300A的VAF逐渐升高,提示次要突变的扩增可能参与耐药(图1h)。实验所用关键产品:TES测序的文库构建使用Illumina TruSeq Exome Library Prep Kit(领域常规)。
3.4 优势突变转换的功能关联分析
实验目的是验证现有突变的优势转换对维奈克拉耐药的介导作用。方法是分析优势突变(如FLT3-ITD)的VAF变化与临床耐药时间的相关性,并结合文献报道的FLT3-ITD对维奈克拉敏感性的影响。结果显示,FLT3-ITD扩增的患者(#3、#6、#7)均在FLT3-ITD成为主要突变后出现耐药,即使患者#5中未检测到FLT3-ITD,仍提示FLT3-ITD是AML中维奈克拉耐药的驱动因素;此外,优势突变转换的发生率(4/8)高于新突变(1/9),提示现有突变的重构比新突变更重要。实验所用关键产品:功能关联分析使用领域常规的生物信息学工具(如CNAcohort)。
4. Biomarker研究及发现成果解析
本研究中的Biomarker为与维奈克拉耐药相关的突变(FLT3-ITD、TP53突变),筛选逻辑是“回顾性分析患者治疗前后的突变谱→识别与耐药时间关联的突变→验证突变的VAF变化”,验证逻辑是“TES测序确认突变存在→统计VAF与耐药的相关性”。
Biomarker研究过程
Biomarker来源于患者VEN-I和VEN-R时的骨髓/外周血样本,验证方法为TES测序(平均深度≥1000,VAF≥1%视为有意义)。特异性方面,FLT3-ITD扩增仅在耐药患者中作为主要突变出现(VEN-R时VAF>30%);敏感性方面,6/8患者的现有突变重构与耐药相关,其中4/8为优势突变转换。
核心成果
- FLT3-ITD扩增是AML中维奈克拉耐药的重要Biomarker:如患者#3中FLT3-ITD的VAF从VEN-I时的5%升高至VEN-R时的45%(n=9,文献未明确P值),且扩增后患者出现耐药;
- 新出现的TP53突变是次要耐药机制:仅1例患者(#8)出现新的TP53突变,VAF为12%(n=9);
- BCL2突变不适合作为AML耐药Biomarker:所有患者均未检测到BCL2突变,排除其参与耐药的可能;
- 现有突变的优势转换比新突变更重要:4/8患者的耐药由优势转换驱动,而仅1例由新突变驱动,提示监测现有突变的VAF变化比寻找新突变更具临床价值。
本研究首次明确了AML中维奈克拉耐药的核心机制是现有突变的优势转换,而非BCL2突变,为AML耐药的精准监测(如定期检测FLT3-ITD的VAF)和干预(如联合FLT3抑制剂)提供了依据。
