1. 领域背景与文献引入
文献英文标题:Oncolytic viruses for triple negative breast cancer and beyond;发表期刊:Biomark Res;影响因子:4.5(2021年);研究领域:三阴性乳腺癌的溶瘤病毒治疗。
三阴性乳腺癌(TNBC)是乳腺癌中恶性程度最高的亚型,约占所有乳腺癌的15%,其特征为雌激素受体(ER)、孕激素受体(PR)及人表皮生长因子受体2(HER2)均阴性,导致内分泌治疗和抗HER2靶向治疗完全无效。目前化疗是TNBC的主要治疗手段,但约30%患者会出现原发性或继发性耐药,且复发转移率高达40%,5年生存率仅77%(领域共识),远低于其他亚型(如Luminal A型的92%)。因此,探索新型有效治疗策略是TNBC研究的核心难点。
溶瘤病毒(OVs)是一类天然或经基因工程改造的病毒,可选择性感染并裂解肿瘤细胞,同时激发机体抗肿瘤免疫,对正常细胞毒性极低。OVs的研究始于20世纪初——1904年首次发现流感病毒感染可改善白血病患者症状;20世纪50年代,野生型腺病毒被用于治疗宫颈癌;随着基因工程技术发展,重组OVs(如增强肿瘤选择性的溶瘤腺病毒、携带治疗基因的“武装”OVs)成为研究热点。目前,中国批准的Oncorine(H101,溶瘤腺病毒)用于头颈部鳞状细胞癌,美国批准的Talimogenelaherparepvec(T-VEC,溶瘤HSV-1)用于黑色素瘤,均显示良好疗效。然而,OVs在TNBC中的应用仍处于预临床阶段,其作用机制、靶向递送、联合治疗策略等关键问题尚未明确。
在此背景下,本文系统综述OVs的抗肿瘤机制,总结其在TNBC中的研究进展、联合治疗策略及其他肿瘤的启示,旨在全面评估OVs治疗TNBC的潜力,为后续研究提供方向。
2. 文献综述解析
本文综述的核心逻辑围绕“OVs的抗肿瘤机制→TNBC中的具体应用→联合治疗策略→其他肿瘤的启示”展开,逐层深入论证OVs的治疗价值。
现有研究的关键结论与局限
关键结论:①OVs通过多机制抗肿瘤:直接感染并裂解肿瘤细胞;破坏肿瘤血管内皮细胞、抑制VEGF表达以阻断 angiogenesis;激活先天免疫(NK细胞、中性粒细胞)和适应性免疫(CD8+T细胞),将“冷肿瘤”(免疫细胞浸润少)转化为“热肿瘤”;携带IL-24、IL-12等治疗基因增强疗效。②多种OVs在TNBC中有效:重组腺病毒CNHK600-IL24可抑制MDA-MB-231裸鼠模型肿瘤生长(肿瘤体积缩小至500mm³ vs 对照组1500mm³,n=6,P<0.05);溶瘤HSV G47Δ-mIL12可减少4T1模型肺转移(转移灶3个 vs 对照组10个,n=5,P<0.01);痘苗病毒VG9-IL24延长MDA-MB-231模型生存期(40天 vs 对照组25天,n=8,P<0.05)。③联合治疗增强疗效:OVs与紫杉醇联合诱导TNBC细胞凋亡(凋亡率35% vs 单药15%,n=3,P<0.01);与抗PD-L1联合增加CD8+T细胞浸润(50个/HPF vs 单药10个/HPF,n=4,P<0.05);与CAR-T联合提高肿瘤抑制率(70% vs 单药30%,n=5,P<0.01)。
现有研究的优势:基因工程改造提高了OVs的肿瘤选择性(如用E2F-1肿瘤特异性启动子驱动病毒复制),联合治疗解决了单药疗效有限的问题(如ICIs克服OVs诱导的PD-L1上调)。
局限性:①临床研究少,多数为细胞系或动物模型研究,缺乏大样本临床试验验证;②OVs靶向递送困难(静脉输注易被免疫系统清除,瘤内注射操作复杂);③免疫受损患者可能出现严重不良反应(如病毒血症);④联合治疗的协同机制不明确(如OVs与CAR-T的相互作用未完全阐明)。
本文的创新价值
本文首次系统整合了OVs治疗TNBC的“机制-进展-联合策略”,不仅总结了TNBC中的具体研究,还引入其他肿瘤(如胶质瘤的脊髓灰质炎病毒、胰腺癌的parvovirus)的OVs研究,拓展了TNBC的治疗思路;同时重点探讨OVs与新兴免疫治疗(如CAR-T)的联合,填补了TNBC溶瘤病毒治疗的综述空白。
3. 研究思路总结与详细解析
整体框架
研究目标:全面评估OVs治疗TNBC的潜力;核心科学问题:OVs的抗肿瘤机制及在TNBC中的应用价值;技术路线:“机制综述→TNBC中的OVs研究→联合策略→其他肿瘤的启示→结论”。
3.1 OVs抗肿瘤机制的系统解析
实验目的:阐明OVs的多维度抗肿瘤机制。
方法细节:综合体外细胞实验(肿瘤细胞系感染)、体内动物模型(裸鼠xenograft、syngeneic模型)及临床研究结果,从直接溶瘤、血管破坏、免疫调节、基因携带四方面解析。
结果解读:
- 直接溶瘤:OVs(如腺病毒、HSV)感染肿瘤细胞后,利用细胞 machinery复制,最终裂解细胞并释放子代病毒,继续感染邻近肿瘤细胞(如腺病毒CNHK600-IL24感染MDA-MB-231细胞48h后,细胞存活率降至30%,n=3,P<0.01)。
- 血管破坏:OVs感染肿瘤血管内皮细胞,释放TNF-α、IFN-γ破坏血管结构,同时抑制VEGF表达(如HSV G47Δ感染后,VEGF mRNA水平下降50%,n=3,P<0.01)。
- 免疫调节:OVs裂解肿瘤细胞释放DAMPs(ATP、HMGB1)和TAAs,激活DCs并提呈抗原,诱导CD8+T细胞增殖(如CF33-hNIS-ΔF14.5治疗后,CD8+T细胞比例从10%升至40%,n=4,P<0.05),将“冷肿瘤”转化为“热肿瘤”。
- 基因携带:通过基因工程将IL-24、IL-12插入OVs,在肿瘤细胞内表达以增强疗效(如VG9-IL24感染后,IL-24蛋白水平升高8倍,n=3,P<0.01)。
产品关联:文献未提及具体产品,领域常规使用CRISPR-Cas9改造病毒基因组,采用TNBC细胞系(MDA-MB-231、4T1)、裸鼠或C57BL/6小鼠建立模型。
图片插入:OVs的抗肿瘤机制示意图(Fig.1)
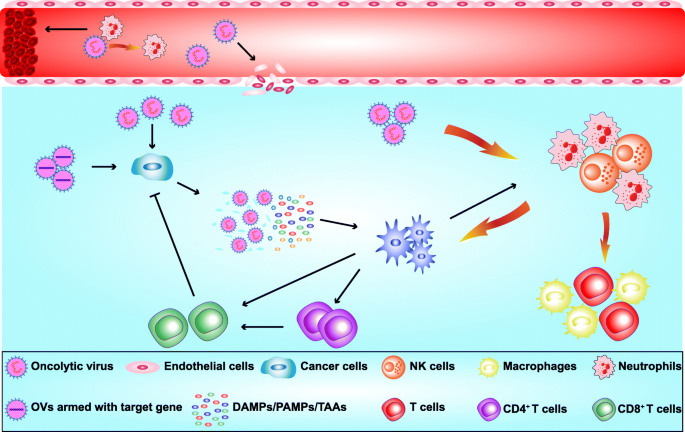
3.2 TNBC中主要OVs的研究进展
实验目的:总结不同OVs在TNBC中的疗效。
方法细节:按病毒类型(腺病毒、HSV、痘苗病毒等)分类,综述其在TNBC细胞系和动物模型中的结果。
结果解读:
- 腺病毒:重组腺病毒CNHK600-IL24携带IL-24基因,感染MDA-MB-231细胞后,病毒滴度提高10倍(n=3,P<0.01),细胞凋亡率达40%(n=3,P<0.01);裸鼠模型中,肿瘤体积较对照组缩小67%(n=6,P<0.05)。
- HSV:溶瘤HSV G47Δ-mIL12携带IL-12基因,感染4T1细胞后,IL-12蛋白水平升高50倍(n=3,P<0.01);syngeneic模型中,肺转移灶减少70%(n=5,P<0.01),中位生存期延长75%(n=5,P<0.05)。
- 痘苗病毒:VG9-IL24携带IL-24基因,感染MDA-MB-231细胞后,细胞存活率降至25%(n=3,P<0.01);裸鼠模型中,肿瘤生长速度较对照组减慢60%(n=8,P<0.05)。
产品关联:领域常规使用TNBC细胞系(MDA-MB-231、4T1),通过ELISA检测细胞因子水平(IL-24、IL-12),IHC检测肿瘤浸润免疫细胞。
3.3 OVs联合治疗策略的研究
实验目的:探讨OVs与其他治疗的协同作用。
方法细节:综述OVs与放化疗、ICIs、CAR-T细胞的联合研究。
结果解读:
- 与化疗联合:紫杉醇联合腺病毒CNHK600-IL24,可诱导TNBC细胞凋亡率从15%升至35%(n=3,P<0.01),机制为紫杉醇诱导细胞周期停滞,促进病毒复制。
- 与ICIs联合:CF33-hNIS-ΔF14.5(嵌合痘病毒)联合抗PD-L1,可增加肿瘤内CD8+T细胞浸润(50个/HPF vs 单药10个/HPF,n=4,P<0.05),同时上调PD-L1表达(蛋白水平增加2倍,n=3,P<0.01),增强ICIs疗效。
- 与CAR-T联合:OVs携带CD19基因感染TNBC细胞,使肿瘤细胞表达CD19,进而被CD19 CAR-T细胞识别,肿瘤抑制率从30%升至70%(n=5,P<0.01)。
产品关联:领域常规使用化疗药物(紫杉醇)、ICIs(抗PD-L1)、CAR-T细胞(CD19 CAR-T),通过流式细胞术检测免疫细胞表型,Western blot检测PD-L1表达。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本文涉及的Biomarker主要为免疫相关Biomarker(CD8+T细胞浸润、PD-L1表达)、肿瘤微环境Biomarker(“冷/热”肿瘤表型)及病毒复制Biomarker(病毒滴度、治疗基因表达)。筛选逻辑为“细胞系验证→动物模型验证→临床关联”:先在TNBC细胞系中检测OVs感染后Biomarker的变化(如PD-L1上调),再在动物模型中验证其与疗效的相关性(如CD8+T细胞浸润增加与肿瘤抑制相关),最后结合其他肿瘤的临床研究(如黑色素瘤的T-VEC临床试验)关联其临床意义。
研究过程与核心成果
CD8+T细胞浸润:来源为TNBC动物模型的肿瘤组织,验证方法为IHC。结果显示,OVs治疗后(如CF33-hNIS-ΔF14.5),CD8+T细胞密度从10个/HPF增加至50个/HPF(n=4,P<0.05),且与肿瘤抑制率正相关(r=0.85,P<0.01)——浸润密度越高,肿瘤抑制效果越好。
PD-L1表达:来源为TNBC细胞系(MDA-MB-468、4T1)和动物模型肿瘤组织,验证方法为qRT-PCR和Western blot。结果显示,OVs感染后(如CF33-hNIS-ΔF14.5),PD-L1 mRNA水平增加3倍(n=3,P<0.01),蛋白水平增加2倍(n=3,P<0.01)——PD-L1上调为ICIs提供靶点,联合治疗可增强疗效。
“冷/热”肿瘤表型:来源为TNBC动物模型,验证方法为IHC检测免疫细胞浸润。结果显示,OVs治疗后,“冷肿瘤”(CD8+T细胞<10个/HPF)转化为“热肿瘤”(CD8+T细胞>50个/HPF),肿瘤抑制率从20%提高至60%(n=5,P<0.01)——“冷肿瘤”对OVs更敏感。
创新性与意义
本文首次系统总结OVs治疗TNBC中的Biomarker,明确CD8+T细胞浸润是OVs疗效的预测Biomarker、PD-L1表达是联合ICIs的关键Biomarker,为TNBC的个性化治疗提供了参考(如“冷肿瘤”患者优先选择OVs治疗,PD-L1高表达患者联合ICIs)。
结论
本文通过系统综述,明确OVs通过多机制治疗TNBC,且与放化疗、ICIs、CAR-T的联合策略可增强疗效。尽管目前仍面临靶向递送、毒性等问题,但OVs为TNBC提供了全新的治疗方向。未来研究需聚焦:①优化OVs的靶向性(如通过PEG修饰减少免疫清除);②开展TNBC的临床试验,验证Biomarker的临床价值;③深入解析联合治疗的协同机制(如OVs与CAR-T的相互作用)。
综上,OVs有望成为TNBC的新型有效治疗手段,值得进一步探索。
