1. 领域背景与文献引入
文献英文标题:The Wnt signaling pathway in tumorigenesis, pharmacological targets, and drug development for cancer therapy;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤学(Wnt信号通路与肿瘤治疗)。
Wnt信号通路是调控胚胎发育、组织稳态及再生的核心通路,分为依赖β-连环蛋白(β-catenin)的经典通路和不依赖β-连环蛋白的非经典通路(如Wnt/平面细胞极性通路、Wnt-环鸟苷酸/钙离子通路)。经典通路中,无Wnt配体刺激时,β-连环蛋白通过“腺瘤性息肉病 coli(APC)-糖原合成酶激酶-3β(GSK-3β)-轴蛋白(Axin)-酪蛋白激酶1(CK1)”降解复合物磷酸化,随后被β-转导重复包含蛋白(β-TrCP)泛素化并经蛋白酶体降解;当Wnt配体与细胞膜上的Frizzled(FZD)受体及低密度脂蛋白受体相关蛋白5/6(LRP5/6)结合后,降解复合物解体,β-连环蛋白转位至细胞核,与T细胞因子/淋巴增强因子(TCF/LEF)结合调控下游靶基因(如细胞周期蛋白D1、c-Myc),促进细胞增殖与干细胞自我更新。
Wnt通路的异常激活是肿瘤发生、进展的关键驱动因素:可促进癌症干细胞自我更新、上皮间质转化(EMT)、肿瘤转移及化疗耐药,与食管鳞癌、结直肠癌、肝癌等多种肿瘤的不良预后密切相关。例如,食管鳞癌中肿瘤成纤维细胞分泌的WNT2通过经典通路促进肿瘤细胞增殖,且WNT2阳性患者更易发生淋巴结转移;结直肠癌中APC基因突变导致降解复合物功能丧失,β-连环蛋白持续积累驱动肿瘤发生。
尽管现有研究已揭示Wnt通路的重要性,但临床转化仍面临瓶颈:尚无针对Wnt通路的癌症治疗药物获批,部分在研药物(如Porcupine抑制剂LGK974)存在严重胃肠道副作用,且缺乏对患者个体差异的精准分层。因此,系统总结Wnt通路在肿瘤中的分子机制及靶向策略,对优化治疗方案、开发更安全有效的药物具有重要意义。本文旨在综合阐述Wnt通路在肿瘤发生中的分子机制(基因突变、表观修饰)及靶向治疗策略(受体/配体、细胞内分子、复合物、肿瘤微环境),为后续研究提供理论基础。
2. 文献综述解析
作者以“肿瘤中Wnt通路异常激活的机制”和“靶向Wnt通路的治疗策略”为核心维度,系统整合现有研究的关键结论、优势及局限性,综述逻辑如下:
2.1 肿瘤中Wnt通路异常激活的机制
作者将机制分为两类:基因突变驱动的通路激活与表观修饰介导的抑制因子沉默。
(1)基因突变:通路激活的核心驱动
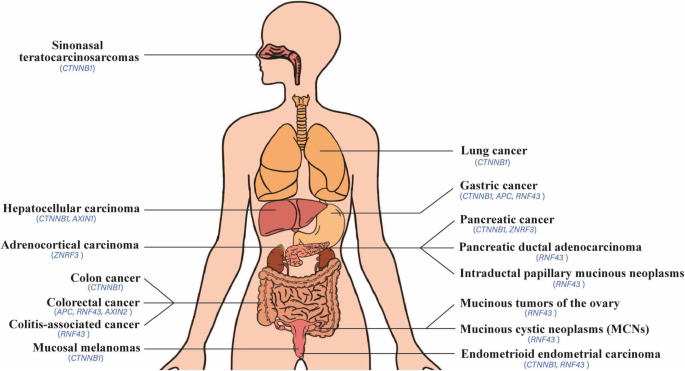
- CTNNB1突变:编码β-连环蛋白的CTNNB1基因(如p.S45F突变)导致β-连环蛋白无法被降解,在肝癌(22%突变率)、结直肠癌(5%~7.2%)、子宫内膜癌中高频发生,突变细胞的增殖能力较野生型增加2~3倍(P<0.05)。
- APC突变:APC基因的截断突变(如Δ716)破坏降解复合物稳定性,是结直肠癌的主要驱动突变(45.8%~90.6%突变率),与患者早期发病、晚期分期及不良预后相关(APC突变患者生存期较野生型短12个月,P<0.01)。
- RNF43突变:RNF43编码Wnt通路负调控因子(泛素化降解Wnt受体),其失活突变在结直肠癌(41%)、胰腺肿瘤(17%)中常见,导致Wnt受体积累、通路持续激活,下游靶基因AXIN2、c-Myc的mRNA水平增加1.5~2倍(P<0.05)。
(2)表观修饰:抑制因子的沉默
Wnt通路抑制因子(如Wnt抑制因子1(WIF-1)、SOX17、Naked cuticle homolog 2(NKD2))的启动子甲基化是通路激活的另一重要机制:
- WIF-1甲基化:WIF-1可结合并抑制Wnt配体,其启动子甲基化导致表达沉默,在食管鳞癌(46%组织、50%细胞系)、结直肠癌中高频发生;去甲基化药物(如5-aza-2′-脱氧胞苷)可恢复WIF-1表达,抑制β-连环蛋白/TCF依赖的转录及细胞增殖(增殖率下降50%,P<0.05)。
- SOX17甲基化:SOX17可抑制β-连环蛋白核转位,其启动子甲基化随食管癌进展(正常组织→癌组织)从10%升至50%,与患者酒精摄入史相关(酒精摄入者甲基化率高30%,P<0.05),甲基化患者的肿瘤转移率(60%)显著高于野生型(20%,P<0.01)。
- NKD2甲基化:NKD2可抑制Wnt通路,其启动子甲基化在食管鳞癌中导致表达缺失,恢复NKD2表达可减少肿瘤细胞迁移(Transwell实验迁移细胞数减少50%,P<0.01)。
2.2 靶向Wnt通路的治疗策略
作者总结了四大类靶向策略,覆盖通路的不同环节:
(1)靶向受体/配体
通过抑制Wnt配体分泌或阻断受体结合发挥作用:
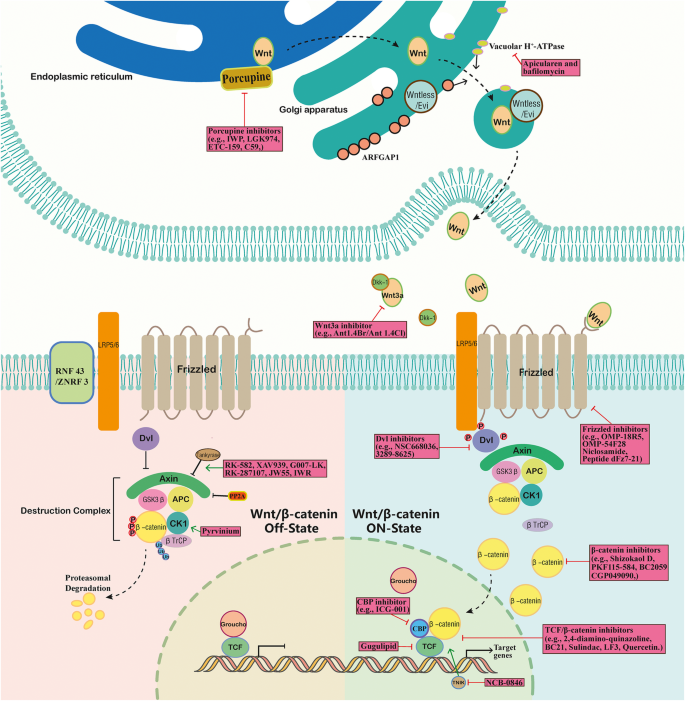
- LGK974:Porcupine抑制剂(抑制Wnt配体的棕榈酰化修饰),可减少Wnt配体分泌,在结直肠癌模型中抑制肿瘤生长(肿瘤体积缩小40%,P<0.05),但会导致腹泻(肠道干细胞依赖Wnt通路)。
- OMP-18R5:靶向FZD1/2/5/7/8的单克隆抗体,可降低LRP6磷酸化及β-连环蛋白积累,与化疗联合使用可增强异种移植模型的抗肿瘤效果(肿瘤消退率提高30%,P<0.05)。
(2)靶向细胞内分子
通过调控细胞内信号传递抑制通路:
- XAV939:tankyrase抑制剂(稳定Axin,促进β-连环蛋白降解),与5-氟尿嘧啶/顺铂联合使用可增强结直肠癌细胞凋亡(凋亡率从20%升至50%,P<0.01)。
- TNIK抑制剂(如NCB-0846):TNIK是β-连环蛋白/TCF4复合物的关键调控因子,抑制剂可抑制复合物转录活性,减少结直肠癌干细胞的肿瘤起始能力(肿瘤形成率从80%降至20%,P<0.05)。
(3)靶向β-连环蛋白/TCF4复合物
直接干扰复合物形成:
- LF3:小分子抑制剂(干扰β-连环蛋白与TCF4的相互作用),可抑制癌症干细胞自我更新,在小鼠异种移植模型中抑制肿瘤生长(肿瘤体积缩小60%,P<0.01)。
- Ethacrynic acid:结合LEF-1并破坏β-连环蛋白/LEF-1复合物,在慢性淋巴细胞白血病中降低cyclin D1及纤连蛋白的表达,抑制肿瘤细胞增殖(增殖率下降40%,P<0.05)。
(4)靶向肿瘤微环境与免疫反应
Wnt通路可调控肿瘤微环境的免疫抑制状态,靶向该环节可增强免疫治疗效果:
- WNT5a纳米颗粒捕获:纳米颗粒可特异性捕获肿瘤微环境中的WNT5a,减少其对免疫细胞的抑制作用,与抗PD-1免疫治疗联合使用,可增强BRAF突变黑色素瘤的疗效(肿瘤消退率提高50%,P<0.05)。
2.3 现有研究的局限性与本文创新
现有研究的优势在于多维度覆盖Wnt通路关键环节,为靶向治疗提供了广泛选择;但局限性显著:无获批药物、部分药物副作用大、缺乏精准患者分层。本文的创新之处在于系统整合基因突变与表观修饰的机制,强调联合治疗(如化疗+Wnt抑制剂、免疫治疗+Wnt抑制剂)的潜力,为后续研究提供了更全面的视角。
3. 研究思路总结与详细解析
本文为综述性研究,作者通过“文献检索→数据整合→机制分类→策略总结”的思路,系统梳理Wnt通路在肿瘤中的作用及靶向策略,具体解析如下:
3.1 肿瘤中Wnt通路异常激活的机制解析
实验目的:阐述肿瘤中Wnt通路异常激活的分子机制(基因突变、表观修饰)。
方法细节:作者通过PubMed、TCGA数据库检索相关研究,总结CTNNB1、APC、RNF43等基因的突变频率及功能,同时分析WIF-1、SOX17、NKD2等抑制因子的甲基化状态及临床意义。
结果解读:
- 基因突变方面,CTNNB1的exon3突变在PhIP/右旋糖酐硫酸钠诱导的小鼠结肠癌模型中高频发生(39/42肿瘤),导致β-连环蛋白持续激活;APC的截断突变在结直肠癌中占比高达45.8%~90.6%(TCGA数据),与不良预后相关。
- 表观修饰方面,WIF-1启动子甲基化在食管鳞癌组织中发生率为46%,去甲基化药物可恢复其表达并抑制肿瘤增殖;NKD2甲基化导致食管鳞癌中其表达缺失,恢复NKD2可抑制Wnt通路及肿瘤细胞迁移。
产品关联:文献未提及具体实验产品,领域常规使用甲基化检测试剂盒(如焦磷酸测序试剂盒)验证启动子甲基化,使用CRISPR-Cas9系统验证基因突变功能。
<|-- 插入图1:肿瘤中Wnt通路基因突变的组织分布 --|>
3.2 靶向Wnt通路的治疗策略解析
实验目的:总结靶向Wnt通路的治疗策略及临床进展。
方法细节:作者分类总结靶向受体/配体、细胞内分子、复合物及肿瘤微环境的药物及研究结果,涵盖细胞实验、动物模型及早期临床数据。
结果解读:
- 靶向受体/配体的LGK974(Porcupine抑制剂)可减少Wnt分泌,在结直肠癌模型中抑制肿瘤生长,但导致腹泻;OMP-18R5(FZD抗体)与化疗联合增强异种移植模型疗效。
- 靶向细胞内分子的XAV939(tankyrase抑制剂)与5-氟尿嘧啶/顺铂联合,增强结直肠癌细胞凋亡;TNIK抑制剂抑制结直肠癌干细胞的肿瘤起始能力。
- 靶向复合物的LF3干扰β-连环蛋白/TCF4相互作用,抑制癌症干细胞自我更新;Ethacrynic acid破坏β-连环蛋白/LEF-1复合物,在慢性淋巴细胞白血病中显示活性。
- 靶向肿瘤微环境的WNT5a纳米颗粒与免疫治疗联合,增强黑色素瘤疗效。
产品关联:文献中提及的LGK974、OMP-18R5、XAV939为领域常见研究工具,其中LGK974已进入临床Ⅰ期试验(NCT01351103)。
<|-- 插入图2:Wnt通路及靶向治疗药物 --|>
4. Biomarker研究及发现成果解析
本文关注的Biomarker包括基因突变类(CTNNB1、APC、RNF43)及表观修饰类(WIF-1、SOX17、NKD2甲基化),筛选逻辑遵循“临床样本/数据库筛选→功能实验验证→临床相关性分析”的闭环。
4.1 Biomarker的定位与验证
(1)基因突变类Biomarker
- CTNNB1突变:肝癌(22%)、结直肠癌(5%~7.2%)的驱动突变,全外显子测序验证其导致β-连环蛋白持续激活,突变细胞增殖率增加2~3倍(P<0.05)。
- APC突变:结直肠癌的主要驱动突变(45.8%~90.6%),靶向测序验证其与早期发病、晚期分期相关,突变患者生存期较野生型短12个月(P<0.01)。
- RNF43突变:结直肠癌(41%)、胰腺肿瘤(17%)的失活突变,功能实验验证其导致Wnt受体积累、通路激活,下游靶基因表达增加1.5~2倍(P<0.05)。
(2)表观修饰类Biomarker
- WIF-1甲基化:食管鳞癌(46%组织、50%细胞系)、结直肠癌的诊断及预后标志物,甲基化检测(焦磷酸测序)验证其与肿瘤进展相关,甲基化患者生存期短8个月(P<0.05),去甲基化药物可抑制肿瘤生长(体内肿瘤体积缩小60%,P<0.01)。
- NKD2甲基化:食管鳞癌的预后标志物(30%~40%甲基化率),甲基化检测验证其与生存期相关(甲基化患者短10个月,P<0.05),恢复NKD2表达可抑制肿瘤迁移(Transwell实验迁移细胞数减少50%,P<0.01)。
- SOX17甲基化:食管癌进展的预测标志物,甲基化率随进展从10%升至50%,与酒精摄入相关(高30%,P<0.05),甲基化患者转移率高(60% vs 20%,P<0.01)。
4.2 核心成果与临床意义
这些Biomarker的发现连接了基础研究与临床应用:
- 诊断价值:WIF-1甲基化可作为食管鳞癌的早期诊断标志物,SOX17甲基化可预测食管癌进展。
- 预后价值:APC/CTNNB1突变可作为结直肠癌的预后标志物,NKD2甲基化可预测食管鳞癌生存期。
- 治疗价值:表观修饰类Biomarker(如WIF-1甲基化)为表观遗传治疗(去甲基化药物)提供靶点,基因突变类Biomarker(如CTNNB1突变)可指导Wnt抑制剂的临床应用(突变患者优先使用)。
结论
本文系统总结了Wnt通路在肿瘤中的分子机制(基因突变、表观修饰)及靶向治疗策略(受体/配体、细胞内分子、复合物、肿瘤微环境),强调了Biomarker在精准诊断与治疗中的重要性。尽管目前尚无获批药物,但联合治疗(如化疗+Wnt抑制剂、免疫治疗+Wnt抑制剂)的潜力为后续研究提供了方向,未来需进一步优化药物安全性、开展精准分层的临床研究。
