1. 领域背景与文献引入
文献英文标题:BNT162b2 mRNA vaccination affects the gut microbiome composition of patients with follicular lymphoma and chronic lymphocytic leukemia;发表期刊:Biomarker Research;影响因子:未公开;研究领域:血液系统恶性肿瘤(慢性淋巴细胞白血病、滤泡性淋巴瘤)、COVID-19疫苗免疫反应、肠道微生物组与免疫互作。
慢性淋巴细胞白血病(CLL)和滤泡性淋巴瘤(FL)是常见的惰性B细胞恶性肿瘤,患者因疾病本身(如B细胞克隆性增殖导致免疫细胞比例失调)或治疗(如抗CD20单克隆抗体导致B细胞耗竭)存在严重免疫缺陷,对病原体易感性显著增加。COVID-19疫情期间,这类患者感染风险和重症率显著高于健康人群,因此亟需通过疫苗获得保护。然而,现有研究表明,CLL/FL患者的BNT162b2 mRNA疫苗反应存在异质性:体液免疫(抗体产生)显著受损,尤其是近期接受抗CD20治疗的患者;细胞免疫(T细胞、NK细胞反应)在FL患者中相对保留,但具体机制不清。此外,肠道微生物组作为“免疫器官”,通过调节T细胞分化、细胞因子分泌等影响疫苗免疫原性,但此前缺乏针对CLL/FL患者的纵向研究,探究疫苗接种对肠道微生物组的动态影响,以及微生物组变化与免疫反应的关联——这是本研究的核心切入点。
2. 文献综述解析
作者对现有研究的分类围绕三方面展开:① CLL/FL患者的疫苗免疫反应特征:体液免疫受损与治疗史(如抗CD20抗体)强相关,细胞免疫在FL患者中相对保留,但CLL患者的细胞免疫也存在缺陷;② 肠道微生物组与疫苗效果的关联:健康人群中,微生物组多样性和短链脂肪酸(SCFA)产生菌(如Lactobacillus)与疫苗抗体滴度正相关,但这类研究未涉及免疫缺陷的血液肿瘤患者;③ CLL/FL患者的肠道微生物组特征:现有研究提示CLL患者肠道微生物组多样性降低,Firmicutes/Bacteroidetes比值改变,但未探讨疫苗对其的影响。
作者指出,现有研究的局限性在于:缺乏纵向设计(无法捕捉疫苗接种后的动态变化)、未同时分析免疫组(体液+细胞免疫)和微生物组的整合变化。因此,本研究的创新点是通过前瞻性纵向研究,整合分析CLL/FL患者疫苗接种后的体液免疫、细胞免疫和肠道微生物组变化,揭示三者的关联,为这类患者的疫苗策略优化提供依据。
3. 研究思路总结与详细解析
本研究的核心目标是探究BNT162b2疫苗对CLL/FL患者免疫组和肠道微生物组的动态影响,核心科学问题是“疫苗如何调节这类患者的免疫反应和微生物组,以及两者的关联”,技术路线为“患者招募→多时间点样本采集→体液/细胞免疫检测→微生物组测序→代谢功能预测→关联分析”。
3.1 患者招募与样本采集
实验目的:建立CLL/FL患者的疫苗接种纵向队列,获取不同时间点的生物样本。
方法细节:招募38例未感染COVID-19、未接种过其他COVID-19疫苗的CLL/FL患者(19例CLL,19例FL),采集三个时间点样本:① 疫苗接种前(T1);② 第二针后15天(T2);③ 第三针后15天(T3)。其中15例患者(7例CLL,8例FL)提供粪便样本用于微生物组分析。所有患者均接受BNT162b2疫苗(每剂30μg,间隔3周)。
结果解读:患者基线特征(年龄、性别、治疗史)无显著组间差异(CLL:中位年龄65岁,5例接受过抗CD20治疗;FL:中位年龄62岁,6例接受过抗CD20治疗),样本采集合格,符合后续分析要求。
产品关联:文献未提及具体样本采集或保存的试剂品牌,领域常规使用EDTA抗凝管(血液样本)、无菌冻存管(粪便样本)。
3.2 体液免疫反应检测
实验目的:评估CLL/FL患者疫苗接种后的抗体反应。
方法细节:采用化学发光微粒子免疫分析法(Abbott ALINITY analyzer的SARS-CoV-2 IgG II Quant assay)检测血清中抗SARS-CoV-2 Spike蛋白IgG抗体,抗体滴度≥40 AU/mL定义为阳性反应,结果转换为WHO国际单位(BAU/mL = 0.142×Abbott AU/mL)。
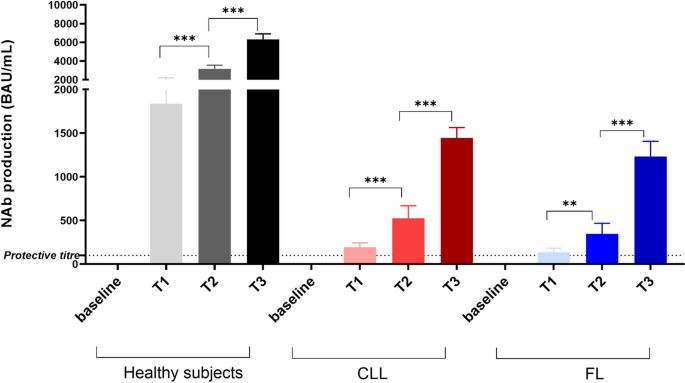
结果解读:CLL患者(n=19)第一针后抗体滴度为137±44 BAU/mL,FL患者(n=19)为194±48 BAU/mL,均显著低于健康对照(n=40)的1840±361 BAU/mL(p<0.001);第二针后,CLL患者滴度升至347±120 BAU/mL,FL患者升至524±144 BAU/mL,但仍低于健康对照的3161±381 BAU/mL(p<0.001);第三针后,完成booster的CLL患者(n=15)滴度为1234±171 BAU/mL,FL患者(n=15)为1445±119 BAU/mL,健康对照仍为6317±581 BAU/mL(p<0.001)。90%的无反应患者(18/20)在过去12个月内接受过抗CD20治疗,提示治疗史是体液免疫受损的关键因素。
产品关联:实验所用关键产品:Abbott的SARS-CoV-2 IgG II Quant assay(抗体检测)。
3.3 细胞免疫 profiling(多色流式细胞术)
实验目的:分析疫苗接种后T细胞、NK细胞、髓系细胞亚群的变化。
方法细节:采集EDTA抗凝血,采用EuroFlow标准方案进行细胞染色,分为三管:① 髓系细胞管(CD15、CD14、CD64、CD16、PD-L1、CD33、CD38、HLA-DR、CD45);② T细胞管(CD45RA、CCR7、CD28、CD279(PD-1)、CD27、CD4、CD8、CD3、CD57、CD45);③ NK细胞管(CD45RA、CD27、CD279、CD57)。使用Beckman Coulter Navios EX-10流式细胞仪采集数据,FlowCT软件分析。
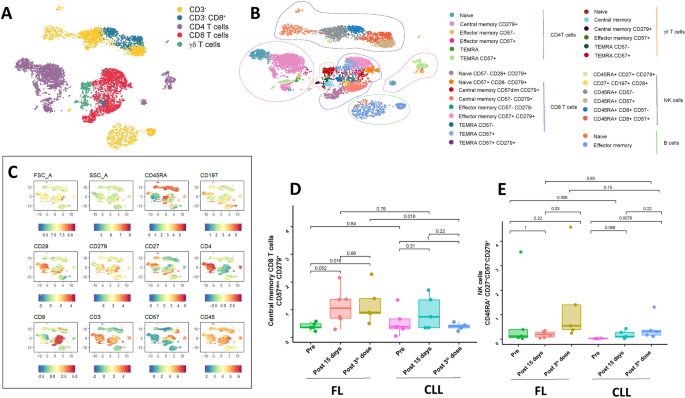
结果解读:FL患者(n=19)第二针后,CD8+CD57dimCD279+中心记忆T细胞比例轻度增加(p=0.05),且显著高于CLL患者(n=19,p=0.016);CLL患者各时间点T细胞亚群无显著变化。CLL/FL患者(n=19 each)第三针后,CD45RA+CD27+CD279+CD57- NK细胞比例显著增加(CLL:p=0.03;FL:p=0.0079)。CLL患者(n=19)第三针后,中性粒细胞Myeloid-2(CD14-CD15+CD16-CD64-CD33-CD38+PD-L1+HLA-DR-)、Myeloid-6(CD14-CD15+CD16+CD64-CD33+CD38+PD-L1+HLA-DR-)、Myeloid-9(CD14-CD15+CD16+CD64+CD33+CD38+PD-L1+HLA-DR+)亚群比例分别增加(p=0.038、0.01、0.01),Myeloid-1(CD14-CD15+CD16dimCD64+CD33-CD38+PD-L1+HLA-DR-)亚群比例减少(p=0.007);FL患者(n=19)Myeloid-1亚群第二针后减少(p=0.01),第三针后增加(p=0.013)。
产品关联:实验所用关键产品:Beckman Coulter Navios EX-10流式细胞仪、EuroFlow标准化抗体组合(具体抗体品牌未提及)。
3.4 肠道微生物组分析(16S rRNA测序)
实验目的:检测疫苗接种后肠道微生物组的组成变化。
方法细节:采集患者T1和T3的粪便样本,使用QIAamp PowerFecal Pro DNA Kit提取微生物DNA,扩增16S rRNA基因V3-V4区,Illumina MiSeq平台进行双端测序(2×300 bp)。通过QIIME2 pipeline处理数据(去噪、OTU聚类),使用Greengenes数据库(99%相似性)进行物种注释,分析alpha多样性(Chao1、Shannon、Pielou指数)和beta多样性(Jaccard PCoA),MetagenomeSeq和Limma进行差异丰度分析。
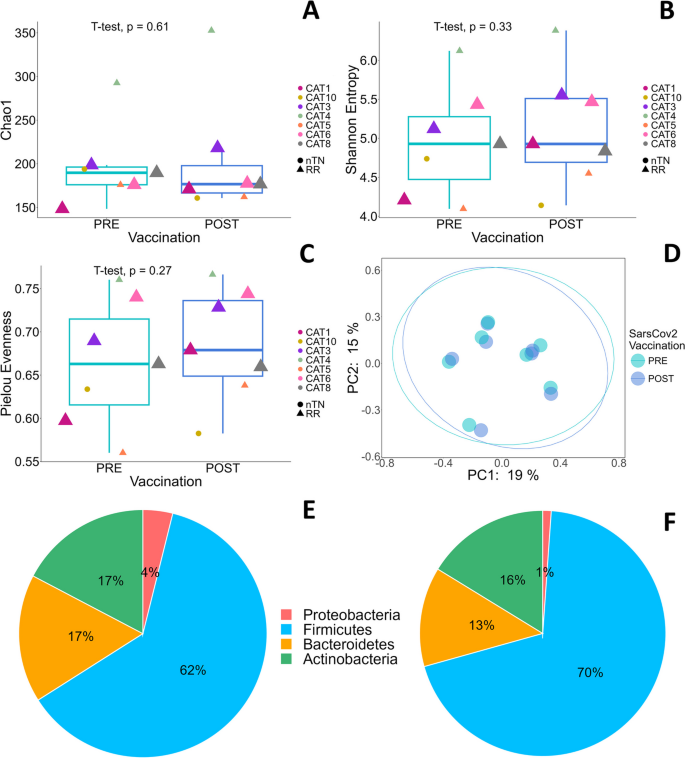
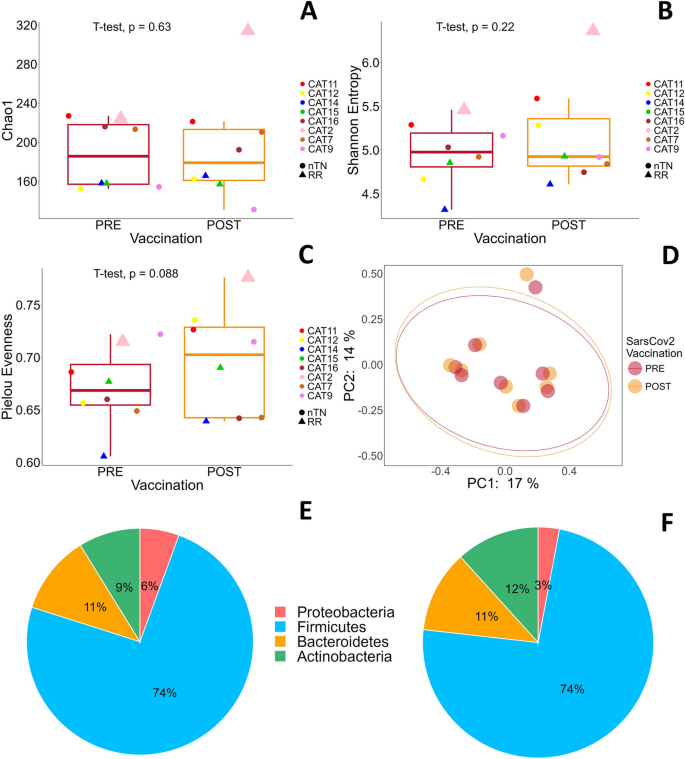
结果解读:CLL患者(n=7)疫苗后,Firmicutes比例从62%增加至70%,Bacteroidetes从17%降至13%,Actinobacteria从17%降至16%,Proteobacteria从4%降至1%;FL患者(n=8)Firmicutes保持74%,Bacteroidetes保持11%,Actinobacteria从12%降至9%,Proteobacteria从6%降至3%。alpha多样性分析显示,CLL/FL患者疫苗前后Chao1(丰富度)、Shannon(多样性)指数无显著变化,但Pielou指数(均匀度)增加(提示微生物组均匀度改善)。beta多样性分析(Jaccard PCoA)显示,疫苗前后微生物组结构无显著聚类差异(PCoA图无分离)。差异属分析显示,CLL/FL患者疫苗后Collinsella、Gemmiger、Lachnospiraceae、Blautia、Ruminococcus、Lactobacillus属丰度增加,Faecalibacterium、Enterobacteriaceae、Enterococcus属丰度减少,但无统计学显著差异(p>0.05)。
推测:Collinsella、Gemmiger等短链脂肪酸产生菌的增加,可能通过调节肠道Treg细胞分化或细胞因子分泌,改善CLL/FL患者的疫苗免疫反应,但需进一步的机制研究验证。
产品关联:实验所用关键产品:Qiagen QIAamp PowerFecal Pro DNA Kit(DNA提取)、Illumina MiSeq测序平台。
3.5 微生物组代谢功能预测(PICRUSt2)
实验目的:分析疫苗接种后肠道微生物组的代谢功能变化。
方法细节:基于16S rRNA测序数据,使用PICRUSt2预测微生物组的元基因组功能,比较CLL/FL患者T1和T3的代谢通路差异。
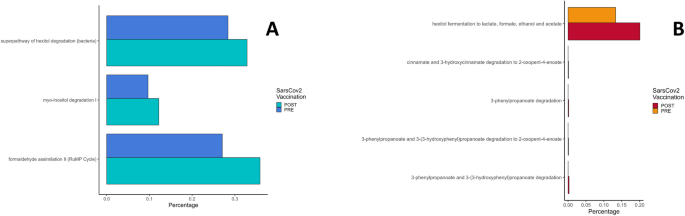
结果解读:CLL患者(n=7)疫苗后,糖降解通路(如己糖醇降解、肌醇降解)和甲醛同化通路(RuMP循环)增加(logFC分别为0.69、0.88、0.73),这些通路与短链脂肪酸(SCFA)产生相关;FL患者(n=8)疫苗后,三羧酸循环(TCA cycle)相关通路(如3-苯基丙酸降解、肉桂酸降解)和己糖醇发酵通路增加(logFC分别为3.74、3.17、0.79),涉及SCFA和甲酸产生。组间比较显示,CLL患者L-赖氨酸生物合成通路更丰富(logFC=1.25),FL患者L-缬氨酸降解通路(logFC=-2.00)和嘌呤核苷厌氧降解通路(logFC=-0.63)更丰富,提示两类患者微生物组代谢功能存在固有差异。
产品关联:实验所用工具为开源软件PICRUSt2,无商业产品关联。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本研究涉及两类Biomarker:① 免疫细胞亚群(CD8+中心记忆T细胞、NK细胞亚群、中性粒细胞亚群);② 肠道微生物组属(Collinsella、Gemmiger等)。筛选逻辑为“纵向样本动态检测→免疫/微生物组数据分析→差异Biomarker鉴定→关联分析”,验证方法包括多色流式细胞术(免疫细胞)、16S rRNA测序(微生物组)和统计学分析(差异丰度、相关性)。
研究过程详述
- 免疫细胞Biomarker:
- 来源:患者外周血样本(n=19 CLL,n=19 FL)。
- 验证方法:多色流式细胞术,通过标准化抗体组合(如CD8、CD57、CD279)保证特异性,流式细胞仪的高分辨率检测保证敏感性。
核心结果:FL患者的CD8+CD57dimCD279+中心记忆T细胞比例在疫苗后增加(p=0.05),可能与细胞免疫保护相关;CLL/FL患者的CD45RA+CD27+CD279+CD57- NK细胞比例在疫苗后扩张(CLL:p=0.03;FL:p=0.0079),可能是疫苗诱导的细胞免疫补偿机制;CLL患者的Myeloid-1中性粒细胞亚群减少(p=0.007),提示疫苗对髓系细胞的调节作用。
微生物组Biomarker:
- 来源:患者粪便样本(n=7 CLL,n=8 FL)。
- 验证方法:16S rRNA测序结合Greengenes数据库注释,Illumina MiSeq的深度测序保证敏感性,物种注释的高精度保证特异性。
- 核心结果:CLL/FL患者疫苗后Collinsella、Gemmiger、Lachnospiraceae、Blautia、Ruminococcus、Lactobacillus属丰度增加,Faecalibacterium、Enterobacteriaceae、Enterococcus属丰度减少。其中,CLL患者Gemmiger属丰度与Myeloid-1中性粒细胞亚群正相关(r=0.82,p=0.034),FL患者Lactobacillus属丰度与Myeloid-1亚群正相关(r=0.72,p=0.044),提示微生物组变化与免疫细胞亚群存在互作。
核心成果提炼
- 免疫细胞Biomarker:FL患者的CD8+中心记忆T细胞增加可能是其细胞免疫保留的标志,CLL/FL患者的NK细胞亚群扩张是疫苗诱导的细胞免疫补偿机制,中性粒细胞亚群变化提示疫苗对髓系细胞的调节作用。
- 微生物组Biomarker:Collinsella、Gemmiger等短链脂肪酸产生菌的增加可能通过调节肠道免疫改善疫苗反应,Faecalibacterium(抗炎菌)减少可能与患者免疫状态有关,但需进一步验证。
- 关联成果:微生物组变化与免疫细胞亚群存在互作(如Gemmiger与Myeloid-1亚群正相关),提示肠道微生物组可能通过调节免疫细胞功能影响疫苗反应。
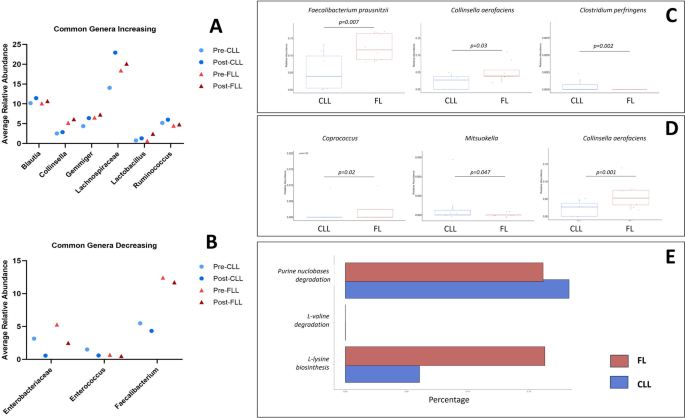
(注:图6展示了CLL/FL患者疫苗前后微生物组属的变化及组间差异,支持上述Biomarker的发现。)
