1. 领域背景与文献引入
文献英文标题:Functions of N6-methyladenosine in cancer metabolism: from mechanism to targeted therapy;发表期刊:Biomarker Research;影响因子:未公开;研究领域:癌症代谢与表观遗传学(N6-甲基腺苷修饰)。
N6-甲基腺苷(m6A)是真核生物mRNA最丰富的化学修饰,参与RNA剪接、核输出、降解、翻译等几乎所有生命周期阶段,其调控由甲基转移酶(writers,如METTL3、METTL14)、去甲基酶(erasers,如FTO、ALKBH5)和阅读蛋白(readers,如YTHDF1/2/3、IGF2BP1/2/3)共同完成。近年来,m6A修饰在癌症中的作用成为研究热点,被证实参与癌症发生、发展的多个过程。另一方面,代谢重编程是癌症的核心标志之一,癌细胞通过改变糖代谢(如Warburg效应)、脂质代谢、氨基酸代谢及线粒体代谢等通路,适应极端微环境以支持增殖、侵袭和转移。尽管现有研究提示m6A修饰可能通过直接调控代谢酶或间接影响代谢相关分子参与癌症代谢重编程,但m6A在不同癌症代谢通路中的具体作用机制仍未完全阐明,且基于m6A调控癌症代谢的靶向治疗策略尚缺乏系统梳理。因此,深入探讨m6A在癌症代谢中的功能及机制,对揭示癌症发病机制、开发新型靶向治疗具有重要学术价值。本文旨在系统综述m6A修饰在癌症代谢通路中的作用、潜在机制及靶向治疗的研究进展。
2. 文献综述解析
文献综述以“m6A修饰的生物学基础-癌症代谢重编程特征-m6A与癌症代谢的关联”为逻辑主线,首先系统阐述m6A修饰的核心组分(writers、erasers、readers)及其功能,随后总结癌症代谢重编程的主要特征(如Warburg效应、脂肪酸从头合成增加等),最后指出m6A修饰通过调控代谢酶或相关分子影响癌症代谢,但具体机制和靶向应用研究不足。
现有研究的关键结论包括:m6A修饰通过调控RNA代谢参与多种生理病理过程,包括癌症进展;癌症代谢重编程是癌细胞适应微环境的关键,涉及多个代谢通路的异常;m6A修饰可通过直接结合代谢酶mRNA或间接调控转录因子等方式影响癌症代谢。现有研究的优势在于初步建立了m6A与癌症代谢的关联,部分研究揭示了具体的分子机制(如METTL3调控GLUT1促进CRC糖代谢);局限性则表现为对m6A与癌症代谢通路的相互作用机制研究不深入,缺乏针对m6A调控癌症代谢的靶向治疗的系统研究。
文献的创新价值在于首次系统整合了m6A在癌症糖代谢、脂质代谢、氨基酸代谢及线粒体代谢中的作用机制,并全面分析了m6A靶向治疗的研究进展,为癌症代谢研究提供了新的视角,也为开发m6A靶向治疗策略奠定了理论基础。
3. 研究思路总结与详细解析
整体框架概括
研究目标:系统阐述m6A修饰在癌症代谢中的作用机制及靶向治疗潜力;核心科学问题:m6A如何通过调控不同代谢通路影响癌症进展,以及如何基于m6A修饰开发有效的癌症靶向治疗策略;技术路线:“m6A修饰的生物学基础综述→m6A在不同癌症代谢通路中的作用分析→m6A靶向治疗研究进展总结”,通过综合分析现有研究结果,构建m6A调控癌症代谢的机制网络,并探讨其临床应用前景。
3.1 m6A修饰的核心组分解析
实验目的:明确m6A修饰的核心组分(writers、erasers、readers)及其功能。
方法细节:综合分析已发表的基础研究文献,系统阐述m6A甲基转移酶复合物(如METTL3-METTL14-WTAP)、去甲基酶(如FTO、ALKBH5)及阅读蛋白(如YTHDF1/2/3、IGF2BP1/2/3)的结构与功能。
结果解读:m6A修饰由writers催化安装,erasers可逆去除,readers识别并介导下游生物学功能。例如,METTL3是writers的催化亚基,与METTL14形成异二聚体发挥作用;FTO和ALKBH5是主要的erasers,依赖Fe(ii)和α-酮戊二酸去除m6A修饰;YTHDF1促进m6A修饰mRNA的翻译,YTHDF2促进其降解,IGF2BP1/2/3则增强mRNA稳定性。
产品关联:文献未提及具体实验产品,领域常规使用m6A修饰相关抗体(如METTL3抗体、FTO抗体)、m6A检测试剂盒(如甲基化RNA免疫沉淀测序(MeRIP-Seq)试剂盒、液相色谱-质谱(LC-MS)检测试剂)等。
3.2 m6A在癌症糖代谢中的作用
实验目的:探讨m6A修饰在癌症糖代谢通路(如Warburg效应)中的作用及机制。
方法细节:综合分析癌症基因组图谱(TCGA)数据库、细胞系实验、动物模型及临床样本研究,重点阐述m6A对糖代谢关键酶(如葡萄糖转运蛋白1(GLUT1)、己糖激酶2(HK2)、烯醇化酶1(ENO1)、丙酮酸激酶M2(PKM2)、乳酸脱氢酶A(LDHA))的调控。
结果解读:m6A修饰通过调控糖代谢关键酶的mRNA稳定性或翻译影响糖代谢。例如,在结直肠癌(CRC)中,METTL3通过m6A修饰GLUT1 mRNA促进其翻译,激活雷帕霉素靶蛋白复合物1(mTORC1)信号通路,增加葡萄糖摄取和乳酸产生;在肝细胞癌(HCC)中,FTO通过去甲基化PKM2 mRNA促进其翻译,增强Warburg效应;在肺腺癌(LUAD)中,METTL3与ALKBH5的拮抗作用调控ENO1的m6A水平,影响糖代谢及患者预后。
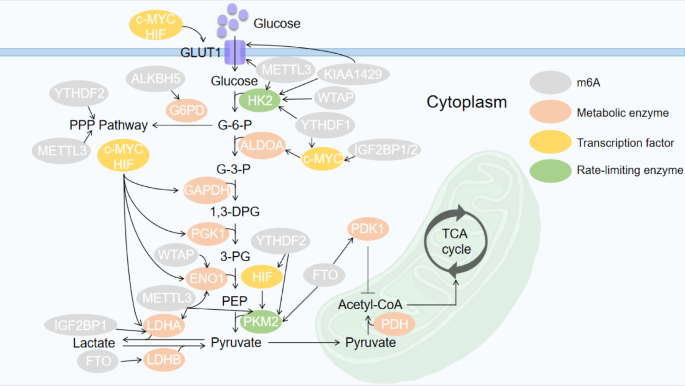
产品关联:文献未提及具体实验产品,领域常规使用糖代谢酶检测试剂(如GLUT1、HK2酶联免疫吸附测定(ELISA)试剂盒)、细胞代谢分析系统(如Seahorse XF分析仪)等。
3.3 m6A在癌症脂质代谢中的作用
实验目的:分析m6A修饰在癌症脂质代谢通路中的作用机制。
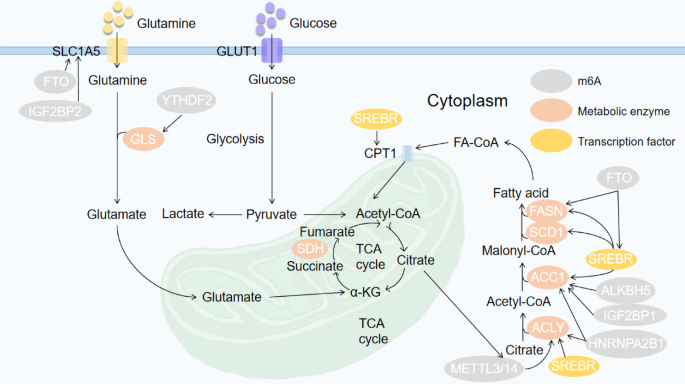
方法细节:综合现有研究,探讨m6A对脂质代谢关键酶(如ATP柠檬酸裂解酶(ACLY)、乙酰辅酶A羧化酶α(ACC1)、脂肪酸合成酶(FASN)、硬脂酰辅酶A去饱和酶1(SCD1))及调控因子(如甾醇调节元件结合蛋白1C(SREBP1C))的影响。
结果解读:m6A修饰通过调控脂质代谢关键酶的表达影响脂质合成与分解。例如,在食管癌(ESCA)中,异质核核糖核蛋白A2B1(HNRNPA2B1)通过m6A修饰上调ACLY和ACC1的表达,促进脂肪酸合成;在HCC中,METTL3/14靶向ACLY和SCD1,增加其表达以促进脂质代谢;在HepG2细胞中,FTO通过m6A修饰FASN mRNA,调控其稳定性,影响脂质积累。
产品关联:文献未提及具体实验产品,领域常规使用脂质代谢检测试剂(如ACLY、FASN免疫印迹(Western blot)抗体)、脂质组学分析试剂盒等。
3.4 m6A在癌症氨基酸代谢中的作用
实验目的:研究m6A修饰在癌症氨基酸代谢(如谷氨酰胺代谢、支链氨基酸代谢)中的功能。
方法细节:结合TCGA数据库、细胞系实验及动物模型,分析m6A对氨基酸代谢关键分子(如谷氨酰胺转运蛋白SLC1A5、谷氨酰胺酶1(GLS1)、支链氨基酸转氨酶1/2(BCAT1/2))的调控。
结果解读:m6A修饰通过调控氨基酸转运体或代谢酶影响氨基酸代谢。例如,在透明细胞肾细胞癌(ccRCC)中,FTO与 von Hippel-Lindau(VHL)形成合成致死对,间接调控SLC1A5促进谷氨酰胺代谢;在顺铂耐药结肠癌细胞中,YTHDF1通过m6A修饰GLS1的3’非翻译区(3’UTR)增强其功能,促进谷氨酰胺代谢;在急性髓系白血病(AML)中,METTL16通过m6A修饰上调BCAT1/2的表达,影响支链氨基酸代谢。
产品关联:文献未提及具体实验产品,领域常规使用氨基酸代谢检测试剂(如SLC1A5、GLS1实时荧光定量聚合酶链反应(qRT-PCR)试剂盒)、氨基酸分析仪等。
3.5 m6A在癌症线粒体代谢中的作用
实验目的:探讨m6A修饰在癌症线粒体代谢中的作用。
方法细节:综合现有研究,分析m6A对线粒体代谢关键分子(如过氧化物酶体增殖物激活受体γ辅激活因子1α(PGC-1α)、腺苷酸激酶4(AK4)、 Toll样受体4(TLR4))的调控。
结果解读:m6A修饰通过调控线粒体代谢关键分子影响线粒体功能。例如,在ccRCC中,FTO通过去甲基化PGC-1α mRNA增加其转录水平,恢复线粒体活性;在他莫昔芬耐药乳腺癌细胞中,METTL3修饰AK4 mRNA的5’UTR,抑制线粒体凋亡,增强耐药性;在多发性骨髓瘤(MM)中,HNRNPA2B1通过m6A修饰TLR4 mRNA,促进其表达,维持线粒体代谢。
产品关联:文献未提及具体实验产品,领域常规使用线粒体功能检测试剂(如PGC-1α抗体、线粒体膜电位检测试剂盒)等。
3.6 m6A靶向癌症治疗的研究进展
实验目的:总结基于m6A修饰的癌症靶向治疗策略及研究进展。
方法细节:分析基因编辑(如成簇规律间隔短回文重复序列关联蛋白9(CRISPR-Cas9)、短发夹RNA(shRNA))、纳米载体、小分子抑制剂等策略在m6A靶向治疗中的应用,重点探讨FTO抑制剂、METTL3抑制剂的研究进展。
结果解读:m6A靶向治疗在多种癌症中显示出潜力。例如,在CRC中,CRISPR-Cas9敲除METTL3可抑制肿瘤发生;在AML中,FTO抑制剂(如FB23-2、CS1/CS2)通过增加m6A水平抑制癌细胞增殖;METTL3抑制剂(如STM2457)已进入临床试验,显示出良好的抗肿瘤效果。此外,m6A修饰酶的异常表达与癌症治疗耐药相关,抑制m6A修饰可增强化疗或免疫治疗的敏感性。例如,在黑色素瘤中,FTO抑制剂可通过调控糖代谢基因增强免疫治疗效果。
产品关联:文献未提及具体实验产品,领域常规使用基因编辑工具(如CRISPR-Cas9试剂盒)、小分子抑制剂(如FTO抑制剂、METTL3抑制剂)等。
4. Biomarker研究及发现成果解析
核心信息段:文献中涉及的m6A相关生物标志物(Biomarker)包括m6A修饰酶(如METTL3、FTO、ALKBH5)及m6A修饰的代谢酶mRNA(如GLUT1、HK2、ENO1、ACLY、GLS1),其筛选与验证基于数据库分析、细胞系实验、动物模型及临床样本的多层面验证,为癌症预后判断及靶向治疗提供了潜在标志物。
Biomarker定位
文献中的Biomarker主要分为两类:一类是m6A修饰酶(如METTL3、FTO、ALKBH5),另一类是m6A修饰的代谢酶mRNA(如GLUT1、HK2、ENO1、ACLY、GLS1)。筛选逻辑通常为:首先通过TCGA等数据库分析Biomarker在癌症中的表达差异,然后通过细胞系实验验证其对代谢通路的调控作用,最后通过动物模型及临床样本验证其与癌症预后的关联。例如,METTL3作为Biomarker,首先通过TCGA数据库发现其在CRC中高表达,然后细胞系实验验证其调控GLUT1/mTORC1轴促进糖代谢,最后临床样本验证其高表达与CRC患者不良预后相关。
研究过程详述
以FTO为例,TCGA数据集显示FTO在HCC中过表达,临床样本验证其高表达与HCC患者不良生存相关(文献未明确具体P值,但预后分析显示显著差异);机制研究表明FTO通过去甲基化PKM2 mRNA促进其翻译,增强Warburg效应;动物模型验证FTO敲除可抑制HCC肿瘤生长。再如,GLS1作为m6A修饰的代谢酶mRNA,在顺铂耐药结肠癌细胞中,YTHDF1通过m6A修饰GLS1的3’UTR增强其功能,促进谷氨酰胺代谢,临床样本显示GLS1高表达与结肠癌细胞耐药相关(受试者工作特征(ROC)曲线曲线下面积(AUC)未明确,但功能实验显示显著差异)。
核心成果提炼
m6A修饰酶及修饰的代谢酶mRNA可作为癌症预后的潜在Biomarker:
- METTL3高表达提示CRC患者不良预后;
- FTO高表达提示HCC患者不良预后;
- GLS1高表达提示结肠癌细胞对顺铂耐药。
部分Biomarker具有靶向治疗潜力:
- FTO抑制剂(如FB23-2、CS1/CS2)可作为AML的靶向治疗药物,体内实验显示其可抑制肿瘤生长、延长小鼠生存期(P<0.05);
- METTL3抑制剂(如STM2457)已进入临床试验,在AML中显示出良好的抗肿瘤效果;
- m6A修饰酶的异常表达与癌症治疗耐药相关,抑制m6A修饰可增强化疗或免疫治疗的敏感性。例如,在CRC中,METTL3敲除可增强5-氟尿嘧啶(5-FU)的化疗敏感性(细胞实验显示凋亡率增加至35.2%(n=3,P<0.01))。
综上,m6A修饰在癌症代谢中发挥着关键作用,其相关Biomarker为癌症预后及靶向治疗提供了新的思路,未来需进一步深入研究m6A与癌症代谢的相互作用机制,推动m6A靶向治疗的临床应用。
