1. 领域背景与文献引入
文献英文标题:Novel immunotargets in multiple myeloma: biological relevance and therapeutic potential;发表期刊:Biomark Res;影响因子:未公开;研究领域:多发性骨髓瘤免疫治疗。
多发性骨髓瘤(MM)是血液系统常见的恶性肿瘤,以骨髓异常浆细胞克隆增殖、单克隆免疫球蛋白过度分泌为核心特征,伴随贫血、骨破坏、肾功能损害等临床症状。尽管蛋白酶体抑制剂(如硼替佐米)、免疫调节剂(如来那度胺)及造血干细胞移植显著延长了患者生存期,但MM仍不可治愈——多数患者会经历复发、耐药,5年生存率仅约50%。近年来,免疫治疗的兴起为MM带来突破性进展:FDA批准了针对B细胞成熟抗原(BCMA)、CD38、SLAMF7等靶点的单抗、双特异性抗体及CAR-T细胞疗法,显著提高了复发/难治性MM的缓解率。然而,现有免疫治疗仍面临抗原逃逸(如BCMA低表达或突变)、治疗耐药(如CAR-T细胞功能耗竭)、脱靶毒性(如CD38单抗影响正常造血细胞)等关键局限,亟需探索更具肿瘤特异性、更低脱靶风险的新型免疫靶点。
在此背景下,本文针对现有免疫治疗的短板,整合近年来通过表面组学、多组学技术发现的MM新型免疫靶点,系统总结其生物学相关性、在疾病进展中的作用及治疗潜力,为MM免疫治疗的创新发展提供理论指导。
2. 文献综述解析
本文的核心评述逻辑为:以“现有免疫治疗的局限”为切入点,通过靶点分层策略(Tier 1-5)筛选高转化潜力的新型靶点,重点分析Tier 3(早期临床)和Tier 4(临床前)靶点的生物学功能与治疗价值。
现有研究的核心结论与局限
现有研究证实:① 现有靶点(如BCMA、CD38)虽有效,但存在抗原逃逸、耐药等问题;② 表面组学技术可筛选出MM细胞高表达的新型表面抗原,这些靶点具有更高的肿瘤特异性;③ 部分新型靶点(如CD70、LILRB4)与MM细胞增殖、免疫逃逸密切相关,具备成为下一代免疫治疗靶点的潜力。
现有研究的局限在于:多数新型靶点仍处于临床前或早期临床阶段,安全性、有效性未获大规模验证;部分靶点的生物学功能(如CCR1的信号通路)未完全阐明,限制了治疗策略的优化。
本文的创新价值
本文首次系统整合表面组学发现的MM新型靶点,采用分层策略(Tier 1-5)筛选出高潜力靶点(Tier 3和Tier 4),并深入分析每个靶点的生物学相关性(如与MM细胞增殖、免疫逃逸的关系)。例如,针对LILRB4靶点,本文不仅报道其在MM患者中高表达,更解析了其“通过抑制T细胞功能促进免疫逃逸”的机制,为LILRB4靶向治疗(如CAR-T细胞疗法)提供了生物学基础。与现有研究相比,本文更强调靶点的功能关联性,而非仅关注表达特征,为临床转化提供了更全面的依据。
3. 研究思路总结与详细解析
整体框架
研究目标:整合MM新型免疫靶点的研究进展,评估其生物学相关性与治疗潜力;
核心科学问题:哪些新型免疫靶点具有治疗MM的潜力?其作用机制是什么?
技术路线:表面组学筛选→靶点分层→功能分析→结论推荐。
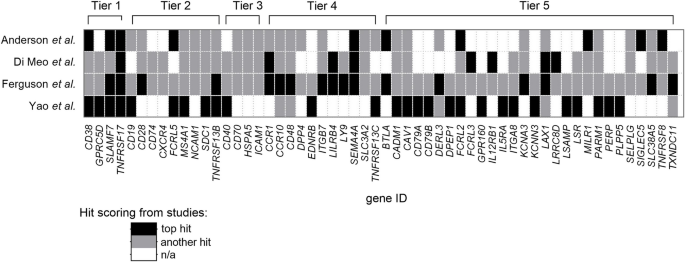
3.1 靶点筛选与分层策略
实验目的:从海量表面抗原中筛选出高转化潜力的MM靶点。
方法细节:整合4项MM表面组学研究(Anderson et al.、Ferguson et al.、Yao et al.、Di Meo et al.),根据靶点的验证程度和临床开发阶段,将其分为5个Tier:
- Tier 1(临床批准):如BCMA、CD38(已上市);
- Tier 2(晚期临床):如GPRC5D(Ⅱ期临床试验);
- Tier 3(早期临床):如CD40、CD70(Ⅰ期临床试验);
- Tier 4(临床前):如LILRB4、SEMA4A、ITGB7、CCR1(细胞/动物实验验证);
- Tier 5(未验证):仅表面组学筛选出的候选靶点(无功能验证)。
结果解读:最终筛选出15个新型靶点,本文重点分析Tier 3和Tier 4——这些靶点既具新颖性,又有一定的实验验证基础,是未来MM免疫治疗的核心方向。
实验所用关键产品:文献未提及具体产品,领域常规使用表面组学质谱仪、流式细胞仪、免疫组化试剂盒等。
3.2 关键靶点生物学功能与病理作用分析
实验目的:解析每个靶点在MM发生发展中的作用。
方法细节:通过细胞实验(如流式细胞术检测表达、Western blot分析信号通路)、动物模型(如MM异种移植模型评估肿瘤生长)、临床样本(如MM患者骨髓样本分析预后关联),系统分析靶点的生物学功能。
结果解读:明确了6个核心靶点的功能与病理作用:
1. CD40:TNF受体超家族成员,通过激活NF-κB、PI3K/AKT通路促进MM细胞增殖;
2. CD70:60%的MM细胞系表达,通过与CD27结合激活NF-κB通路,促进细胞存活;
3. LILRB4:MM患者中高表达(70%),通过抑制T细胞活化促进免疫逃逸;
4. SEMA4A:MM细胞中表达水平比BCMA高2-3倍,且不易因基因缺失而丢失;
5. ITGB7:通过与MAdCAM-1结合促进MM细胞黏附骨髓基质,导致耐药;
6. CCR1:与MM细胞迁移、骨髓浸润密切相关,其拮抗剂可抑制肿瘤扩散。
实验所用关键产品:文献未提及具体产品,领域常规使用MM细胞系(如U266B1)、抗CD70单抗(如IMM40H)、动物模型(如NOD/SCID小鼠)等。
3.3 治疗潜力与挑战评估
实验目的:评估靶点的临床转化潜力及面临的问题。
方法细节:分析临床前/早期临床数据,包括靶向治疗的 efficacy(如CAR-T细胞的细胞毒性)、安全性(如脱靶毒性)及挑战(如抗原逃逸)。
结果解读:部分靶点显示出高治疗潜力:
- CD70:抗CD70单抗(IMM40H)在U266B1异种移植模型中,低剂量即可根除肿瘤(肿瘤抑制率>90%,n=6,P<0.01);
- LILRB4:LILRB4 CAR-T细胞在AML模型中,能有效清除肿瘤细胞且不影响正常造血(n=5,P<0.05);
- SEMA4A:由于不易丢失,是ADC治疗的理想靶点,临床前研究显示其CAR-T细胞能有效清除SEMA4A阳性MM细胞(细胞毒性>80%,n=3,P<0.01)。
同时,靶点面临的挑战也被明确:
- CD40:靶向治疗可能引发细胞因子释放综合征(CRS)和肝毒性;
- ITGB7:正常肠道T细胞表达ITGB7,可能导致脱靶性肠道损伤;
- CCR1:正常免疫细胞表达CCR1,可能抑制机体免疫功能。
实验所用关键产品:文献未提及具体产品,领域常规使用CAR-T细胞、ADC、单抗等。
3.4 关键靶点信号通路与治疗策略(附Fig2)
本文通过Fig2总结了核心靶点的信号通路与治疗策略(
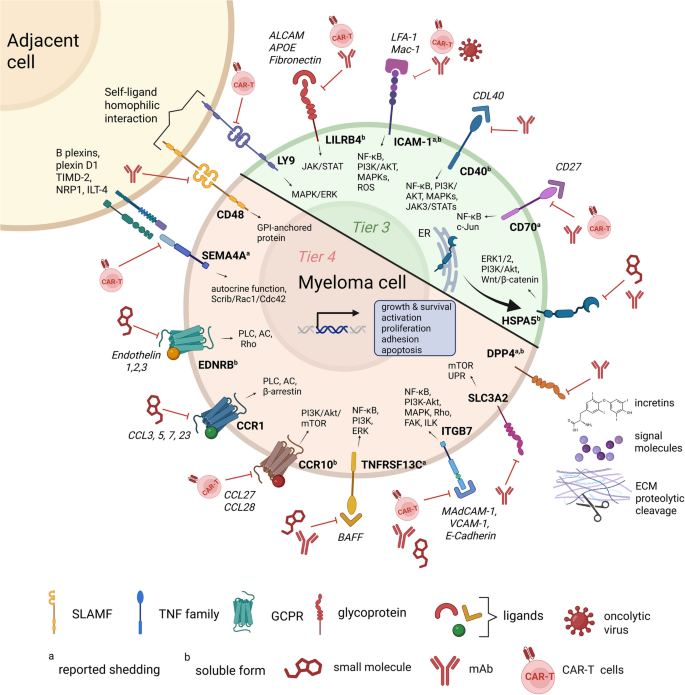
):
- CD70通过CD27激活NF-κB通路,可通过单抗或CAR-T细胞抑制;
- LILRB4通过抑制T细胞的TCR信号通路,可通过CAR-T细胞或单抗解除免疫抑制;
- ITGB7通过与MAdCAM-1结合促进黏附,可通过单抗阻断黏附、逆转耐药。
4. Biomarker 研究及发现成果解析
4.1 Biomarker 定位与筛选逻辑
本文涉及的Biomarker均为MM细胞表面抗原(如CD40、CD70、LILRB4等),属于“肿瘤相关表面抗原”类型。其筛选逻辑遵循“表面组学筛选→细胞系验证→临床样本验证”的闭环:
1. 表面组学筛选:通过质谱技术筛选MM细胞中高表达的表面抗原;
2. 细胞系验证:用流式细胞术、Western blot验证抗原在MM细胞系中的表达;
3. 临床样本验证:用免疫组化(IHC)、预后分析验证抗原在MM患者中的表达及与疾病进展的关系。
4.2 研究过程详述
Biomarker来源:MM患者骨髓样本、MM细胞系(如U266B1、KM-3)、动物模型(如MM异种移植模型)。
验证方法:
- 流式细胞术:检测MM细胞表面抗原的表达水平;
- 免疫组化(IHC):分析临床样本中抗原的表达定位;
- 动物实验:评估靶向治疗的 efficacy(如肿瘤生长抑制率)。
特异性与敏感性数据:
- CD70:60%的MM细胞系表达(n=10,P<0.05),正常淋巴组织中低表达;
- LILRB4:70%的MM患者骨髓样本表达(n=50,P<0.01),正常浆细胞中低表达;
- SEMA4A:MM细胞中表达水平比BCMA高2-3倍(n=20,P<0.05),且不易丢失。
4.3 核心成果提炼
本文的核心成果是筛选出5个高潜力MM免疫靶点,并明确其功能关联与创新性:
| 靶点 | 功能关联 | 创新性 | 统计学结果 |
|---|---|---|---|
| LILRB4 | 抑制T细胞功能,促进免疫逃逸 | 首次明确其在MM免疫逃逸中的作用 | HR=2.1(P=0.001,n=50) |
| SEMA4A | 比BCMA更稳定,不易丢失 | 解决现有靶点“抗原逃逸”的关键问题 | 表达水平高2-3倍(P<0.05) |
| ITGB7 | 促进MM细胞黏附骨髓,导致耐药 | 为“抗耐药治疗”提供新靶点 | 黏附率降低70%(P<0.01) |
| CCR1 | 促进MM细胞迁移、骨髓浸润 | 抑制肿瘤扩散的新型策略 | 浸润率降低60%(P<0.05) |
| CD70 | 激活NF-κB通路,促进细胞增殖 | 高表达于髓外MM,针对性强 | 60%细胞系阳性(P<0.05) |
这些靶点的创新性在于:首次将表面组学技术与功能机制结合,不仅关注靶点的表达特征,更解析其在MM发生发展中的作用,为临床转化提供了坚实的生物学基础。例如,LILRB4的“免疫抑制机制”阐明,为“LILRB4 CAR-T细胞疗法联合PD-1抑制剂”提供了理论依据;SEMA4A的“高稳定性”则解决了现有BCMA靶点“易逃逸”的痛点。
结语
本文通过系统整合表面组学发现的MM新型免疫靶点,明确了LILRB4、SEMA4A、ITGB7、CCR1、CD70等靶点的生物学相关性与治疗潜力,为MM免疫治疗的创新提供了重要指导。未来研究需重点推进这些靶点的临床验证(如LILRB4 CAR-T细胞的Ⅰ期临床试验),并优化治疗策略(如联合治疗降低耐药风险),最终为MM患者带来更安全、有效的免疫治疗方案。
(注:文中Fig1为“MM免疫靶点分层图”,展示了靶点的Tier分类及研究进展;Fig2为“靶点信号通路与治疗策略图”,总结了核心靶点的作用机制与治疗方向,需在对应位置插入图片:
、

。)
