1. 领域背景与文献引入
文献英文标题:Prognostic value and functional consequences of cell cycle inhibitor p27 Kip1 loss in medulloblastoma;发表期刊:Biomark Res;影响因子:未公开;研究领域:髓母细胞瘤分子标志物与预后研究。
髓母细胞瘤是儿童最常见的恶性脑肿瘤,约占儿童脑肿瘤的20%。尽管手术联合放化疗的综合治疗使5年生存率提升至70%~80%,但约20%的标准风险患者(年龄≥3岁、手术全切、无远处转移)仍会治疗失败,且放化疗会导致认知障碍、生长发育迟缓等长期毒性。当前预后分层主要依赖临床特征(年龄、手术切除程度、转移状态),缺乏精准的分子标志物,易导致“过度治疗”(低风险患者承受不必要的毒性)或“治疗不足”(高风险患者未获得强化治疗)。细胞周期抑制剂p27 Kip1(由CDKN1B基因编码)是重要的肿瘤抑制因子,通过抑制cyclin-CDK复合物活性阻滞细胞周期G1/S转换,在小鼠髓母细胞瘤模型中显示出肿瘤抑制功能,但在人类髓母细胞瘤中的预后价值及具体功能(影响肿瘤发生还是进展)尚未明确。因此,本研究通过基因工程小鼠模型和大样本临床队列,系统探讨p27 Kip1缺失对髓母细胞瘤的功能影响及作为预后标志物的可行性。
2. 文献综述解析
文献综述围绕“p27 Kip1的肿瘤抑制功能-其他癌症中的预后价值-髓母细胞瘤中的研究 gap”展开逻辑评述。现有研究表明:p27 Kip1是经典的细胞周期抑制剂,在Ptc1+/-、SmoA1等小鼠髓母细胞瘤模型中,p27 Kip1缺失会加速肿瘤发生,提示其肿瘤抑制功能;在乳腺癌、结肠癌、前列腺癌等实体瘤中,p27 Kip1低表达与不良预后密切相关,是潜在的预后标志物。然而,髓母细胞瘤中的前期研究仅纳入14例样本,虽发现p27 Kip1低表达与肿瘤高增殖相关,但未明确其预后价值,且未区分p27 Kip1缺失是影响肿瘤“发生”(肿瘤起始)还是“进展”(肿瘤侵袭、增殖)。
本研究针对上述未解决问题,创新性地将“基因工程小鼠模型(明确功能机制)”与“大样本临床队列(验证预后价值)”结合,同时回答p27 Kip1的“功能角色”(影响发生/进展)及“临床价值”(能否作为预后标志物),弥补了前期研究“样本量小、功能模糊”的局限性。
3. 研究思路总结与详细解析
本研究以“功能机制-临床价值”为核心逻辑,先通过基因工程小鼠模型明确p27 Kip1缺失对髓母细胞瘤发生与进展的影响,再利用两个独立临床队列验证其作为预后标志物的可行性。核心科学问题包括:p27 Kip1缺失是否影响髓母细胞瘤的发生?是否加速肿瘤进展?能否作为人类髓母细胞瘤的预后标志物?
3.1 基因工程小鼠模型构建与肿瘤发生分析
实验目的是明确在Smoothened(SmoA1)激活的髓母细胞瘤模型中,p27 Kip1杂合或纯合缺失对肿瘤发生的影响。方法上,将携带 constitutively激活SmoA1等位基因的小鼠与p27 Kip1杂合缺失(p27wt/-)或纯合缺失(p27-/-)小鼠交配,获得SmoA1+p27wt/wt(野生型对照)、SmoA1+p27wt/-(杂合缺失)、SmoA1+p27-/-(纯合缺失)三种基因型小鼠,在2个月龄(肿瘤症状出现前)处死,通过组织病理分析肿瘤发生率。结果显示,三种基因型小鼠的肿瘤发生率无显著差异:SmoA1+p27wt/wt为71.4%(n=35),SmoA1+p27wt/-为73.1%(n=52),SmoA1+p27-/-为60%(n=20),Fisher精确检验显示p值分别为1.0(与野生型对比)和0.55(纯合缺失与野生型对比)。这表明p27 Kip1缺失不影响髓母细胞瘤的发生。
实验所用关键产品未提及具体品牌,领域常规使用基因编辑小鼠构建试剂(如CRISPR-Cas9系统)及组织病理检测试剂(如苏木精-伊红染色试剂盒)。
3.2 小鼠肿瘤进展与增殖特征分析
实验目的是探讨p27 Kip1缺失对髓母细胞瘤进展的影响。方法上,对上述小鼠的肿瘤进行病理分级(非侵袭/无结构破坏、侵袭/结构破坏),并通过溴脱氧尿苷(BrdU)脉冲标记(100 mg/kg腹腔注射1小时后处死)结合免疫组化,检测肿瘤细胞增殖指数(计数5个高倍视野的BrdU阳性细胞数)。结果显示,SmoA1+p27wt/-小鼠中60.5%的肿瘤表现为侵袭/结构破坏,显著高于野生型(36.0%,p=0.04);SmoA1+p27-/-小鼠中这一比例为66.7%(p=0.08,接近显著)。增殖指数分析显示,SmoA1+p27wt/-和SmoA1+p27-/-肿瘤的BrdU阳性细胞数显著高于野生型(p=0.05和p=0.0001)。免疫组化进一步显示,进展期肿瘤(侵袭/破坏)中p27 Kip1表达降低,而cyclinD1(细胞周期促进因子)表达升高。
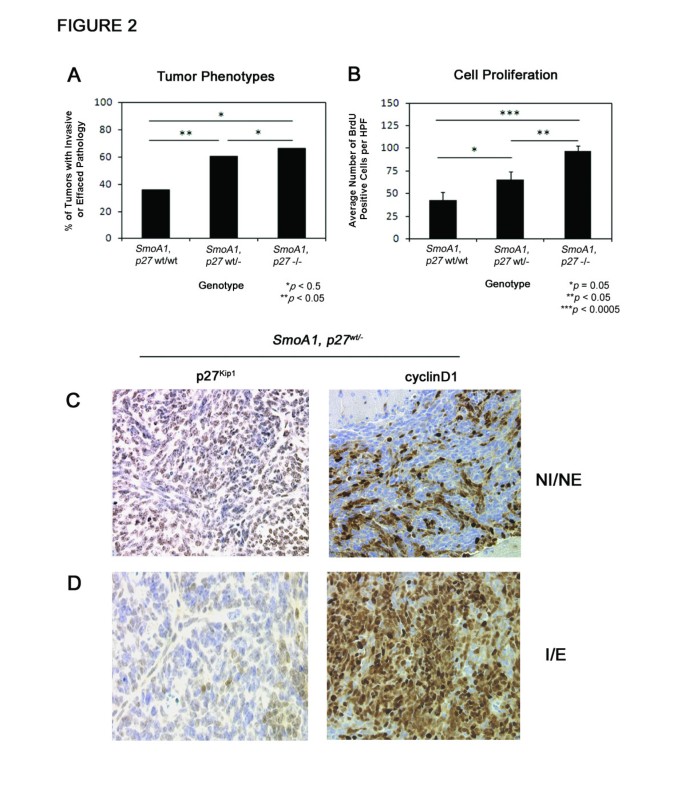
实验中使用的BrdU抗体、p27 Kip1和cyclinD1单克隆抗体未提及具体品牌,领域常规使用商品化免疫组化抗体(如Cell Signaling Technology、Abcam等品牌)。
3.3 临床队列p27 Kip1表达与预后关联分析
实验目的是验证p27 Kip1表达是否与人类髓母细胞瘤患者预后相关。方法上,首先纳入87例具有详细临床信息的髓母细胞瘤患者(训练集),通过免疫组化检测肿瘤组织中p27 Kip1阳性细胞比例,分析其与总生存的关联;随后在141例SIOP PNET03研究的患者(验证集)中重复该分析。结果显示,训练集(87例)中,p27 Kip1阳性细胞比例<1%的患者总生存显著更差(n=79,log-rank检验p=0.027);但在验证集(141例)中,即使将p27 Kip1阳性细胞比例的阈值放宽至<10%(合并<1%和1%-10%的患者),p27 Kip1表达与总生存仍无显著关联(log-rank检验p=0.67)。
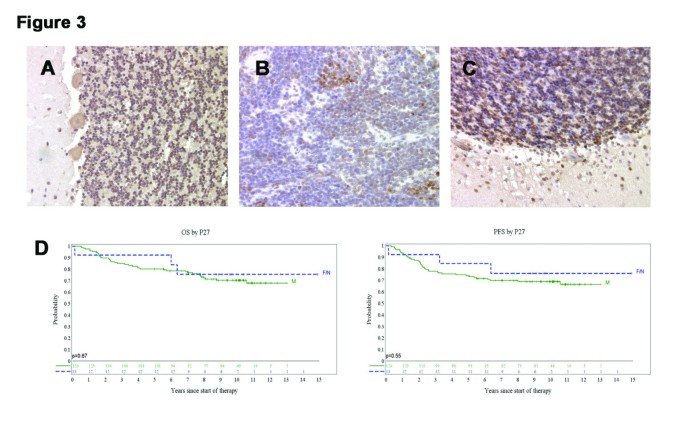
实验中免疫组化使用的p27 Kip1单克隆抗体未提及具体品牌,领域常规使用针对CDKN1B的特异性抗体。
4. Biomarker研究及发现成果解析
本研究关注的Biomarker为p27 Kip1(细胞周期抑制剂,CDKN1B基因编码产物),其筛选与验证逻辑为:先通过基因工程小鼠模型明确p27 Kip1缺失对肿瘤进展的功能影响,再通过临床队列(训练集→验证集)验证其作为预后标志物的价值。
Biomarker研究过程与结果
p27 Kip1的检测样本来自临床手术切除的髓母细胞瘤组织(训练集87例、验证集141例),检测方法为免疫组化(通过单克隆抗体识别p27 Kip1蛋白,计数阳性细胞比例)。训练集结果显示,p27 Kip1阳性细胞比例<1%的患者总生存显著缩短(n=79,p=0.027),但这一结果未在验证集(141例)中重复——即使将阈值放宽至<10%,p27 Kip1表达与总生存仍无显著关联(p=0.67)。
核心成果与创新性
小鼠模型研究发现:p27 Kip1缺失不影响肿瘤发生,但会加速肿瘤进展(侵袭性增强、增殖加快);临床研究显示:尽管训练集提示p27 Kip1低表达与不良预后相关,但验证集未支持这一结论,因此p27 Kip1不能作为髓母细胞瘤的预后标志物。
本研究的创新性在于:①首次通过大样本临床队列明确p27 Kip1在髓母细胞瘤中的预后价值有限,避免了将其误用于临床分层;②通过小鼠模型区分了p27 Kip1对肿瘤发生与进展的不同影响,纠正了前期研究中对其功能的模糊认识(前期认为p27 Kip1缺失影响肿瘤发生,本研究明确其仅影响进展)。
综上,本研究通过“基础-临床”双向验证,明确了p27 Kip1在髓母细胞瘤中的功能角色及预后价值,为后续分子标志物研究提供了重要参考。
