1. 领域背景与文献引入
文献英文标题:Epigenetic regulation of histone modifications in glioblastoma: recent advances and therapeutic insights;发表期刊:Biomarker Research;影响因子:未公开;研究领域:胶质母细胞瘤(GBM)的表观遗传学调控(组蛋白修饰方向)。
胶质母细胞瘤(GBM)是成人最常见的原发性恶性脑肿瘤,占中枢神经系统恶性肿瘤的51.5%,WHO分级为IV级,以高度侵袭性、快速复发和极差预后为特征。目前标准治疗为Stupp方案(最大安全手术切除+术后放疗+替莫唑胺(TMZ)化疗),但患者中位生存期仅12-15个月。治疗面临三大核心挑战:(1)耐药性:约50%患者因O⁶-甲基鸟嘌呤-DNA甲基转移酶(MGMT)启动子未甲基化对TMZ耐药;(2)靶向治疗局限:贝伐珠单抗等抗血管生成药物仅短暂缓解症状,无法延长生存期;(3)免疫治疗无效:PD-1/PD-L1抑制剂对“冷肿瘤”GBM的肿瘤微环境(TME)重塑效果有限。
近年来,表观遗传学调控尤其是组蛋白修饰(如乙酰化、甲基化、乳酸化等)被证实是GBM进展的关键驱动因素。组蛋白通过“writer”(如组蛋白乙酰转移酶HAT、组蛋白甲基转移酶HMT)、“eraser”(如组蛋白去乙酰化酶HDAC、组蛋白去甲基化酶HDM)和“reader”(如溴域蛋白BET)的协同作用,调控染色质结构和基因表达,参与癌基因激活、抑癌基因沉默、治疗耐药和TME重塑。例如,HDAC过表达导致组蛋白去乙酰化,抑制p53等抑癌基因;EZH2(HMT)催化H3K27三甲基化,沉默PTEN等肿瘤抑制基因。尽管preclinical研究显示组蛋白修饰抑制剂具有抗肿瘤活性,但临床转化仍面临选择性差、血脑屏障穿透性不足等问题。因此,系统解析组蛋白修饰在GBM中的作用及治疗潜力,成为突破现有治疗瓶颈的关键方向。
2. 文献综述解析
本综述通过系统检索2013-2025年GBM组蛋白修饰研究,按组蛋白修饰类型(乙酰化、甲基化、新兴修饰)和治疗策略(单药、联合)分类,总结现有研究的核心结论与局限,并提出未来方向。
现有研究的关键结论
- 组蛋白乙酰化异常驱动GBM进展:HDAC1/6过表达促进肿瘤增殖、迁移和TMZ耐药;HAT(如p300)通过增加MGMT启动子H3乙酰化增强耐药;HDAC抑制剂(如vorinostat)可恢复组蛋白乙酰化,激活p53通路抑制肿瘤生长。
- 组蛋白甲基化维持干细胞特性:EZH2、G9a等HMT过表达与GBM不良预后相关,催化H3K27me3、H3K9me2沉默抑癌基因;EZH2抑制剂(如GSK126)可抑制干细胞自我更新,减少肿瘤复发。
- 新兴修饰参与耐药与TME重塑:Warburg效应介导的组蛋白乳酸化(H3K9la)促进TMZ耐药;赖氨酸代谢产生的巴豆酰化(H4K8cr)增加CD8+T细胞浸润;α-酮戊二酸脱氢酶(α-KGDH)催化的琥珀酰化(H3K79succ)促进细胞增殖。
- 联合治疗增强疗效:HDAC抑制剂联合TMZ增强凋亡;BET抑制剂联合免疫治疗改善TME;EZH2抑制剂联合PI3K抑制剂协同抑制信号通路。
现有研究的优势与局限
优势:多维度验证(细胞系+动物模型+临床样本)、高通量技术(ChIP-seq、质谱)解析修饰位点与机制。
局限:preclinical研究为主,临床数据有限;药物选择性差导致脱靶效应;新兴修饰的机制研究尚不深入。
本综述的创新价值
本综述的核心创新在于:(1)全面覆盖新兴修饰(如乳酸化、巴豆酰化),弥补此前研究对少见修饰的忽视;(2)系统总结联合治疗策略,为临床转化提供清晰参考;(3)关联修饰与TME/代谢,拓展了GBM发病机制的理解。相比现有研究,本综述更注重多维度整合,为未来研究提供了明确的方向。
3. 研究思路总结与详细解析
本综述的研究思路是按组蛋白修饰类型系统梳理功能与机制,分为四部分展开:组蛋白乙酰化调控、组蛋白甲基化调控、其他组蛋白修饰、联合治疗策略。
3.1 组蛋白乙酰化调控研究
实验目的:探讨HAT、HDAC及乙酰化阅读器(BET蛋白)在GBM中的作用。
方法:细胞系实验(CRISPR-Cas9敲低HDAC1、过表达p300)、动物模型(裸鼠异种移植瘤给予HDAC抑制剂)、临床样本分析(免疫组化检测HDAC1表达与预后)、分子技术(ChIP-seq检测乙酰化位点、Western blot检测信号通路)。
结果:(1)HDAC1过表达激活PI3K/AKT和MEK/ERK通路,促进增殖;敲低HDAC1增加H3K4/19/27乙酰化,激活p53通路,抑制肿瘤生长;(2)HDAC6通过调控EGFR表达介导TMZ耐药,抑制剂Tubastatin A可增强敏感性;(3)BET蛋白BRD4结合乙酰化组蛋白调控c-Myc表达,抑制剂JQ1可抑制干细胞生长。
实验产品:HDAC抑制剂vorinostat(FDA批准用于皮肤T细胞淋巴瘤)、romidepsin;BET抑制剂JQ1、OTX015;PROTAC药物ARV-825(靶向BRD4降解)。
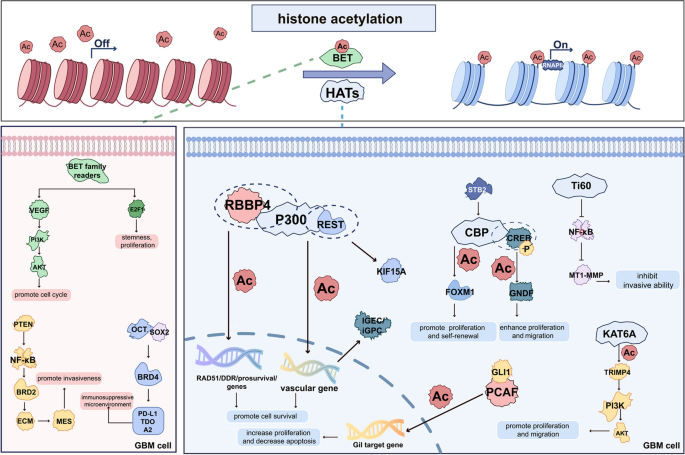
(图2:组蛋白乙酰化相关阅读器和writer在GBM中的调控功能)
3.2 组蛋白甲基化调控研究
实验目的:研究HMT(EZH2、G9a)、HDM(KDM1A、KDM4C)及甲基化阅读器(WDR5、CBX3)的作用。
方法:细胞系实验(siRNA敲低EZH2、给予G9a抑制剂BIX-01294)、动物模型(皮下移植瘤给予EZH2抑制剂GSK126)、临床样本分析(免疫组化检测EZH2表达与生存期)。
结果:(1)EZH2过表达维持干细胞特性,催化H3K27me3沉默PTEN;GSK126可抑制干细胞自我更新,减少肿瘤生长;(2)G9a催化H3K9me2促进增殖,BIX-01294增强TMZ敏感性;(3)KDM1A去甲基化H3K4me2促进生长,抑制剂TCP诱导细胞衰老;(4)WDR5结合H3K4me3调控c-Myc,抑制剂Compound 16抑制干细胞生长。
实验产品:EZH2抑制剂GSK126、tazemetostat(FDA批准用于滤泡淋巴瘤);G9a抑制剂BIX-01294;KDM1A抑制剂TCP、GSK2879552;WDR5抑制剂Compound 16。
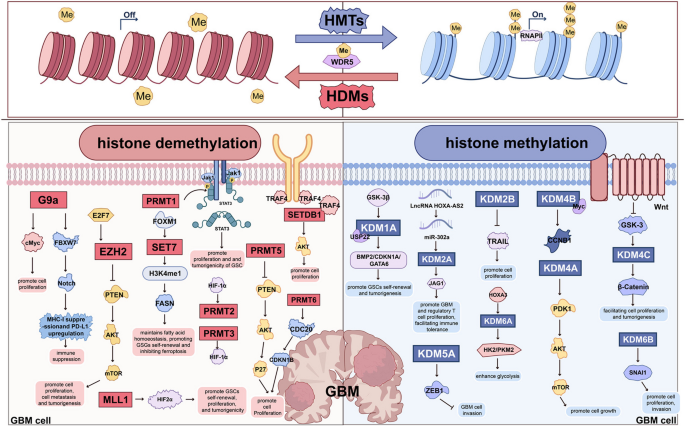
(图4:HDM和HMT在GBM中的调控作用)
3.3 其他组蛋白修饰研究
实验目的:探讨乳酸化、巴豆酰化、琥珀酰化等新兴修饰的作用。
方法:质谱分析(检测修饰位点)、细胞系实验(LDH抑制剂stiripentol减少乳酸生成)、动物模型(裸鼠移植瘤给予stiripentol)、临床样本分析(质谱检测复发患者H3K9la水平)。
结果:(1)乳酸化(H3K9la)由Warburg效应介导,促进TMZ耐药;stiripentol通过抑制LDH减少H3K9la,增强敏感性;(2)巴豆酰化(H4K8cr)由赖氨酸代谢产生,增加CD8+T细胞浸润;(3)琥珀酰化(H3K79succ)由α-KGDH催化,促进细胞增殖。
实验产品:LDH抑制剂stiripentol;巴豆酰-CoA合成酶抑制剂(领域常规使用);α-KGDH抑制剂(领域常规使用)。
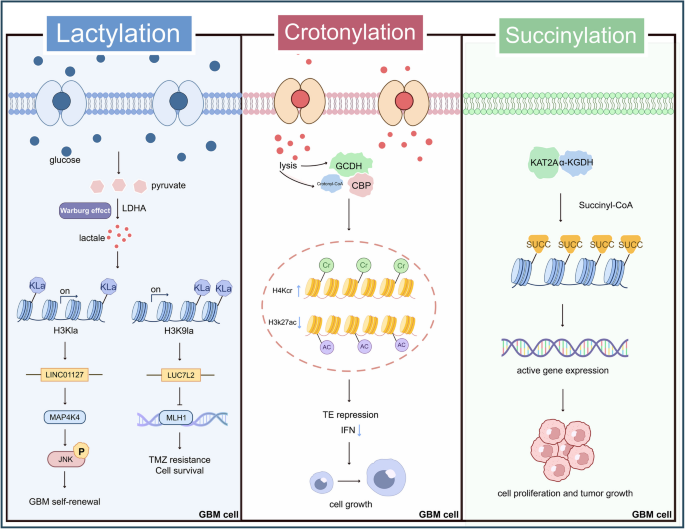
(图5:GBM中的其他组蛋白修饰及功能)
3.4 联合治疗策略研究
实验目的:探讨组蛋白修饰抑制剂与其他疗法的联合效果及机制。
方法:细胞系实验(vorinostat联合TMZ检测凋亡)、动物模型(JQ1联合PD-1抑制剂检测肿瘤生长)、临床研究(vorinostat联合贝伐珠单抗治疗复发GBM)。
结果:(1)HDAC抑制剂+TMZ:增强组蛋白乙酰化,激活p53通路,凋亡率从15%升至45%(U87细胞,n=3,P<0.01);(2)BET抑制剂+免疫治疗:抑制BRD4减少PD-L1表达,肿瘤生长抑制率从30%升至70%(移植瘤,n=5,P<0.05);(3)EZH2抑制剂+PI3K抑制剂:协同抑制PI3K/AKT通路,增殖率从80%降至20%(干细胞,n=3,P<0.01)。
实验产品:vorinostat+TMZ、JQ1+PD-1抑制剂、GSK126+BEZ235。
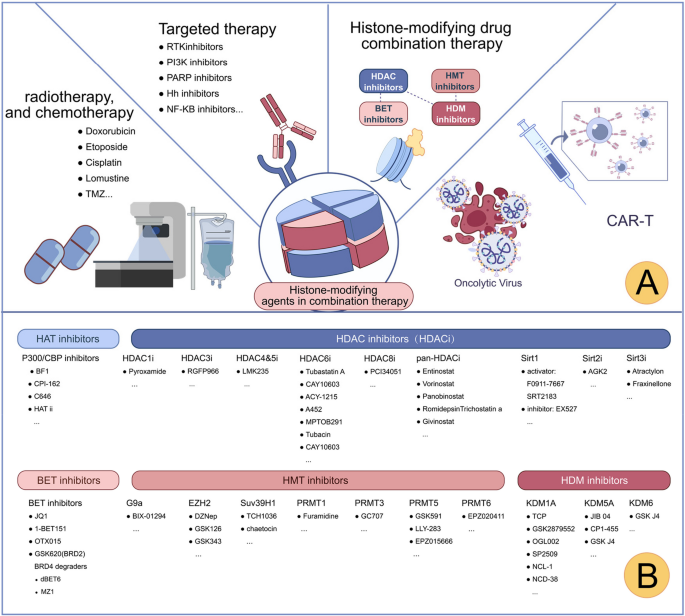
(图6:靶向组蛋白修饰的联合治疗策略)
4. Biomarker研究及发现成果解析
本综述聚焦三类组蛋白修饰相关Biomarker:组蛋白修饰酶(预后)、组蛋白修饰位点(耐药)、非编码RNA(功能),通过“数据库分析-细胞系验证-临床样本确认”的逻辑链筛选,具有诊断、预后和治疗价值。
Biomarker定位与验证
- 组蛋白修饰酶Biomarker(预后):
- HDAC1:来源为TCGA数据库(n=500)和临床标本(n=100),验证方法为RNA-seq、免疫组化和生存分析。结果显示HDAC1高表达患者中位生存期缩短6个月(HR=2.1,95%CI 1.5-2.9,P<0.001)。
EZH2:来源为临床标本(n=100),验证方法为免疫组化。结果显示EZH2高表达患者中位生存期缩短8个月(HR=2.5,95%CI 1.8-3.4,P<0.001)。
组蛋白修饰位点Biomarker(耐药):
- H3K9la(TMZ耐药):来源为TMZ敏感(n=10)/耐药(n=10)细胞系、初发(n=20)/复发(n=20)临床样本,验证方法为质谱、免疫组化和ROC曲线。结果显示H3K9la区分耐药与敏感的AUC=0.85(95%CI 0.78-0.92),敏感性82%,特异性78%。
H3K27ac(MGMT活化):来源为临床样本(n=30),验证方法为ChIP-seq。结果显示MGMT启动子区H3K27ac水平与MGMT表达正相关(r=0.7,P<0.01)。
非编码RNA Biomarker(功能):
- lncTALC(TMZ复发):来源为复发患者样本(n=40),验证方法为qRT-PCR、ChIP-seq和细胞系实验。结果显示lncTALC高表达与MGMT启动子H3乙酰化正相关(r=0.65,P<0.01),敲低后IC50从200μM降至50μM(n=3,P<0.01)。
核心成果提炼
本综述的Biomarker成果为GBM精准医疗提供了三大突破:(1)HDAC1/EZH2作为预后Biomarker,可用于患者分层;(2)H3K9la作为耐药Biomarker,可预测TMZ疗效;(3)lncTALC作为治疗靶点,其抑制剂可逆转耐药。例如,临床可通过检测H3K9la水平选择TMZ敏感患者,或针对lncTALC开发反义寡核苷酸(ASO)药物。
总结:组蛋白修饰是GBM进展的关键 epigenetic 调控因素,其抑制剂在preclinical研究中显示出强大的抗肿瘤活性。未来研究需聚焦高选择性抑制剂开发(如PROTAC技术靶向BRD4)、血脑屏障穿透性优化(如纳米载体递送)和 Biomarker指导的精准联合治疗,以推动临床转化,改善GBM患者预后。
