1. 领域背景与文献引入
文献英文标题:The evolving landscape of biomarkers for systemic therapy in advanced hepatocellular carcinoma;发表期刊:Biomark Res;影响因子:未公开;研究领域:晚期肝细胞癌系统治疗生物标志物。
肝细胞癌(HCC)是全球最常见的恶性肿瘤之一,也是癌症相关死亡的第三大原因,全球5年生存率仅5%-30%。随着分子靶向药物(如索拉非尼、仑伐替尼)和免疫检查点抑制剂(ICI,如纳武利尤单抗、帕博利珠单抗)的获批,尤其是ICI联合抗血管生成药物(如阿替利珠单抗联合贝伐珠单抗)的应用,晚期HCC(aHCC)的系统治疗格局愈发多样化。然而,当前系统治疗的疗效在aHCC患者中存在显著异质性——部分患者可获得长期缓解,而部分患者无应答甚至出现快速进展。因此,识别能够预测治疗应答、指导患者分层的生物标志物,成为aHCC精准治疗的迫切需求。尽管甲胎蛋白(AFP)、循环肿瘤DNA(ctDNA)等生物标志物已显示出潜力,但尚无单一生物标志物可用于临床决策,且生物标志物的检测标准化、疾病异质性等问题仍未解决。本综述系统梳理了aHCC系统治疗生物标志物的最新进展,为临床应用和未来研究提供了方向。
2. 文献综述解析
作者以“生物标志物来源与类型”为核心分类维度,将现有研究分为循环生物标志物(外周血来源)、液体活检(CTCs、ctDNA、miRNAs)、肿瘤组织驱动生物标志物(PD-L1、TME、基因特征)、肠道微生物群、AI赋能影像生物标志物五大类,并在此基础上提出多模态生物标志物策略。
现有研究的核心结论包括:(1)AFP是最广泛使用的血清肿瘤标志物,基线AFP≥400ng/mL可作为预后分层指标,但约30%-40%的HCC患者AFP无显著升高,且在肝炎、肝硬化等疾病中也会升高,敏感性(约70%)和特异性(约80%)不足;(2)液体活检(如CTCs、ctDNA)可动态监测肿瘤负荷和基因突变,克服组织活检的异质性,但检测技术未标准化,成本较高;(3)肿瘤微环境(TME)中的CD8+T细胞浸润是ICI疗效的关键预测因素,但TME的空间异质性(如免疫排斥型、免疫沙漠型)会影响结果;(4)PD-L1表达在HCC中存在显著异质性,且缺乏统一的检测标准(如抗体选择、阳性阈值),其预测价值仍有争议;(5)肠道微生物群通过代谢物(如短链脂肪酸)和免疫调节影响ICI疗效,但受饮食、环境等因素干扰,重复性较差;(6)AI影像生物标志物(如CT/MRI放射组学)可非侵入性评估肿瘤异质性,但需大样本验证模型的泛化能力。
现有研究的优势在于覆盖了生物标志物的多维度来源,从血液到组织、从分子到影像,全面反映了aHCC的生物学特征;局限性则包括:疾病异质性大(如病毒源性与非病毒源性HCC的生物标志物差异)、检测方法不统一(如PD-L1的IHC检测抗体有22C3、28-8等多种)、缺乏大样本前瞻性验证。作者强调,本综述的创新价值在于整合了多类型生物标志物的临床证据,并提出“多模态策略”(如AFP联合ctDNA、影像生物标志物联合基因签名)是克服单一生物标志物局限性的关键方向。
3. 研究思路总结与详细解析
本研究为综述性研究,核心目标是系统梳理aHCC系统治疗生物标志物的最新进展,明确各类生物标志物的临床价值与局限性。作者遵循“生物标志物来源→临床证据→局限性→未来方向”的逻辑框架,分模块解析不同类型的生物标志物:
3.1 循环生物标志物解析
循环生物标志物是aHCC最易获取的生物标志物类型,包括AFP、脱-γ-羧基凝血酶原(DCP)、循环血管生成相关因子(VEGF、Ang2)、细胞因子(IL-6、TGF-β)、系统炎症比(中性粒细胞与淋巴细胞比NLR、血小板与淋巴细胞比PLR)、循环免疫细胞(PD-1+T细胞、调节性T细胞Treg)。
- AFP:作为最经典的血清标志物,基线AFP≥400ng/mL是多数III期临床研究(如REFLECT、IMbrave150)的预后分层指标。治疗后AFP下降≥20%的患者,无进展生存期(PFS)和总生存期(OS)显著延长(n=多个临床研究合并分析,P<0.05)。但AFP的局限性在于约30%-40%的HCC患者无明显升高,且在肝炎活动期也会异常。
- DCP:在AFP阴性或低表达患者中具有高敏感性(约95%),基线DCP>1000mAU/mL是sorafenib治疗的不良预后因素(n=文献16的回顾性研究,P<0.05)。但DCP早期升高仅反映组织缺氧,不能直接预测疗效。
- 系统炎症比:NLR>3.1是sorafenib和安慰剂组患者不良OS的强预后因素(n=827,文献28,P<0.05);低NLR(<3.1)与ICI治疗的良好应答相关(n=文献29、30,P<0.05)。PLR>150也与不良预后相关,但单独使用诊断效能有限。
3.2 液体活检生物标志物解析
液体活检通过外周血检测循环肿瘤细胞(CTCs)、ctDNA、微小RNA(miRNAs),实现非侵入性动态监测。
- CTCs:CTCs的PD-L1高表达与anti-PD-1治疗的良好应答和PFS延长相关(n=Yue等的研究,P<0.05)。但CTCs检测的敏感性受肿瘤负荷影响,低负荷患者易漏检。
- ctDNA:ctDNA基线水平与肿瘤大小、血管侵犯正相关(n=文献40,P<0.05);治疗后ctDNA阴性的患者,无复发生存期(RFS)显著长于阳性患者(n=18,文献41,P<0.05)。ctDNA的优势在于反映肿瘤克隆进化,但检测成本较高。
- miRNAs:9种miRNAs(如miR30A、miR122)与regorafenib治疗后的OS相关(n=RESORCE试验,P<0.05),但miRNAs的稳定性(如血清中的降解)仍是挑战。
3.3 肿瘤组织驱动生物标志物解析
肿瘤组织是生物标志物的“金标准”来源,包括PD-L1表达、TME、肿瘤突变负荷(TMB)、基因突变(TERT、CTNNB1)。
- PD-L1表达:CheckMate 459试验显示,PD-L1阳性(≥1%)肿瘤对nivolumab的应答率高于阴性肿瘤(14% vs 9%),但CheckMate 040试验发现ORR与PD-L1表达无关(文献45、10)。PD-L1的异质性是主要问题——同一肿瘤的不同区域,PD-L1表达可能从0%到100%不等。
- TME:CD8+T细胞浸润密度高的患者,阿替利珠单抗联合贝伐珠单抗的OS和PFS显著更长(n=IMbrave150试验,P<0.05)。M1型巨噬细胞(CD68+CD163-)浸润与良好应答相关(n=文献47,P<0.05),而M2型巨噬细胞则促进免疫抑制。
- 基因突变:TERT启动子突变患者接受阿替利珠单抗联合贝伐珠单抗的生存获益更明显(OS:19.2个月 vs 13.8个月,n=IMbrave150试验,P<0.05);CTNNB1突变(WNT/β-catenin通路激活)与免疫排斥型TME相关,对ICI单药应答差,但联合贝伐珠单抗可改善疗效(n=文献51,P>0.05)。
3.4 肠道微生物群生物标志物解析
肠道微生物群通过“肠-肝轴”影响aHCC的免疫治疗疗效。应答者的肠道菌群中,Clostridia、Prevotella、Ruminococcaceae丰度更高,而非应答者中Ruminococcus gnavus占优(n=8,文献54,P<0.05)。粪便钙卫蛋白(肠道炎症标志物)和血清PD-L1水平在应答者中显著更低(n=文献55,P<0.05)。但肠道菌群受饮食(如高纤维饮食增加短链脂肪酸产生)、抗生素使用等因素影响,重复性较差。
3.5 AI赋能影像生物标志物解析
AI通过放射组学(提取肿瘤纹理、血管分布等特征)将医学影像转化为定量生物标志物。例如,基于增强CT的8特征放射组学模型,预测anti-PD-1治疗应答的曲线下面积(AUC)在训练集为0.894,验证集为0.883(n=58,文献58,P<0.05); pretreatment MRI的放射组学特征可预测仑伐替尼联合anti-PD-1治疗的PFS和OS(n=多中心研究,文献59,P<0.05)。AI影像的优势在于非侵入性、可重复,但需解决不同设备(如不同厂家CT机)的图像异质性问题。
3.6 多模态生物标志物策略解析
作者提出,多模态策略是克服单一生物标志物局限性的关键。例如:(1)AFP联合ctDNA:AFP反映肿瘤负荷,ctDNA反映基因突变,两者结合可提高复发预测准确性(n=文献62,P<0.05);(2)影像生物标志物联合基因签名:放射组学特征反映肿瘤形态异质性,基因签名(如5个免疫相关基因模型)反映分子特征,联合后AUC从0.85提升至0.92(文献52,P<0.05);(3)液体活检联合组织活检:CTCs动态监测PD-L1表达,组织活检检测TME浸润情况,两者结合可指导ICI治疗调整。
4. Biomarker 研究及发现成果解析
本综述覆盖了12类aHCC系统治疗生物标志物,以下为核心成果解析:
4.1 循环生物标志物:经典与新兴的结合
- AFP:定位为“最常用的血清肿瘤标志物”,筛选逻辑为“临床研究分层→动态变化与疗效相关”。研究显示,基线AFP≥400ng/mL的患者,OS较<400ng/mL者缩短3-6个月(n=多个III期试验,P<0.05);治疗后AFP下降≥50%的患者,ORR(客观缓解率)达35%(n=文献11,P<0.05)。局限性:敏感性不足,需联合DCP、AFP-L3(岩藻糖化AFP)提高准确性(联合后敏感性>85%,文献14)。
- NLR:定位为“系统炎症状态的替代标志物”,筛选逻辑为“炎症驱动肿瘤进展→NLR反映免疫抑制”。研究显示,NLR<3.1的患者,ICI治疗的OS较>3.1者延长6-8个月(n=文献29、30,P<0.05)。优势:检测简便(血常规即可),成本低。
4.2 液体活检:动态监测的核心工具
- CTCs:定位为“循环肿瘤细胞的PD-L1表达监测”,筛选逻辑为“CTCs是肿瘤转移的‘种子’→PD-L1表达反映免疫逃逸”。研究显示,基线PD-L1高表达(≥1%)的CTCs患者,anti-PD-1治疗的PFS延长4.2个月(n=文献38,P<0.05)。优势:可动态监测,每2-3个月检测一次,及时调整治疗。
- ctDNA:定位为“肿瘤基因突变与负荷的实时反映”,筛选逻辑为“ctDNA来自肿瘤细胞凋亡→突变谱反映克隆进化”。研究显示,治疗后ctDNA阴性的患者,无复发生存期(RFS)达18个月,而阳性者仅6个月(n=18,文献40,P<0.05)。优势:克服组织活检的异质性,适用于无法手术的aHCC患者。
4.3 肿瘤组织:精准治疗的“金标准”
- CD8+T细胞浸润:定位为“TME免疫活性的标志”,筛选逻辑为“CD8+T细胞是主要的抗肿瘤效应细胞→浸润密度反映免疫应答能力”。研究显示,CD8+T细胞密度高(≥50个/高倍视野)的患者,ICI治疗的ORR达40%,而密度低者仅15%(n=IMbrave150试验,P<0.05)。优势:直接反映肿瘤局部免疫状态,是ICI疗效的强预测因子。
- TERT突变:定位为“端粒酶激活的标志”,筛选逻辑为“TERT突变促进肿瘤无限增殖→与免疫治疗疗效相关”。研究显示,TERT突变患者接受阿替利珠单抗联合贝伐珠单抗的OS达19.2个月,而野生型仅13.8个月(n=IMbrave150试验,P<0.05)。优势:突变率高(约60%的HCC患者存在),是潜在的分层标志物。
4.4 生物标志物驱动的疗法:未来的方向
本综述还总结了5类生物标志物驱动的aHCC系统疗法:
- CAR-T细胞治疗:靶向GPC3(糖蛋白3,HCC特异性抗原)的CAR-T细胞,在I期试验中ORR达20%(n=文献67,P<0.05)。优势:特异性强,适用于GPC3阳性的aHCC患者。
- 双特异性抗体(BsAb):PD-1/CTLA4双特异性抗体AK104联合仑伐替尼,作为一线治疗的ORR达44.4%,DCR(疾病控制率)达77.8%(n=18,文献71,P<0.05)。优势:同时阻断两个免疫检查点,增强抗肿瘤免疫。
- MET抑制剂:选择性MET抑制剂tepotinib,治疗MET高表达(IHC 3+)的aHCC患者,ORR达25%(n=文献77,P<0.05)。优势:针对MET/HGF轴激活的患者,精准性高。
4.5 核心结论
本综述的关键发现包括:(1)单一生物标志物无法满足临床需求,多模态策略是未来趋势;(2)血液和液体活检生物标志物(如AFP、ctDNA)是aHCC患者的首选,尤其适用于无法获取组织的晚期患者;(3)TME和基因特征(如CD8+T细胞浸润、TERT突变)是ICI治疗的核心预测因子;(4)生物标志物驱动的疗法(如CAR-T、BsAb)是aHCC精准治疗的未来方向。
结语
本综述系统梳理了aHCC系统治疗生物标志物的最新进展,明确了各类生物标志物的临床价值与局限性。未来研究需聚焦生物标志物的标准化检测(如PD-L1的统一抗体与阈值)、动态监测技术(如ctDNA的液态活检自动化)、多组学模型(整合基因组、转录组、影像组学),以实现aHCC的精准分层与治疗。生物标志物驱动的疗法(如CAR-T、双特异性抗体)将成为aHCC系统治疗的“新引擎”,为患者带来更长的生存获益。

(Fig1:aHCC系统治疗的格局与序贯策略)
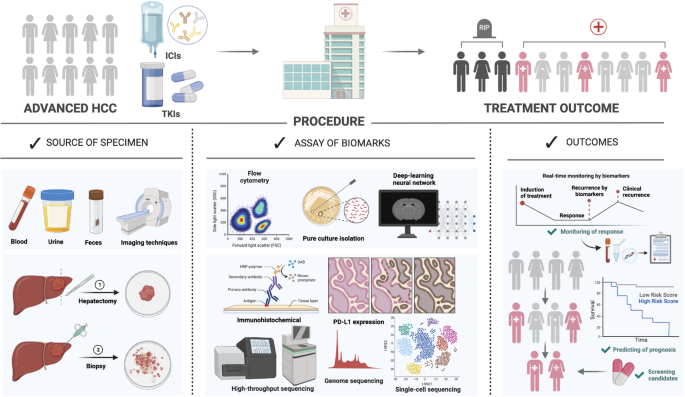
(Fig2:aHCC系统治疗生物标志物的探索流程)
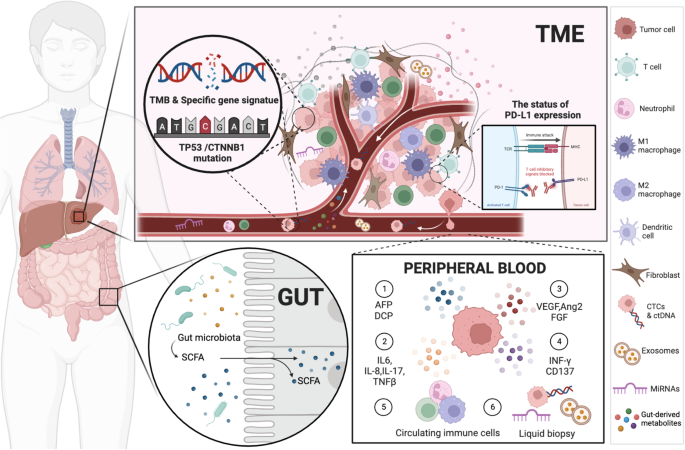
(Fig3:aHCC系统治疗生物标志物的全景图)
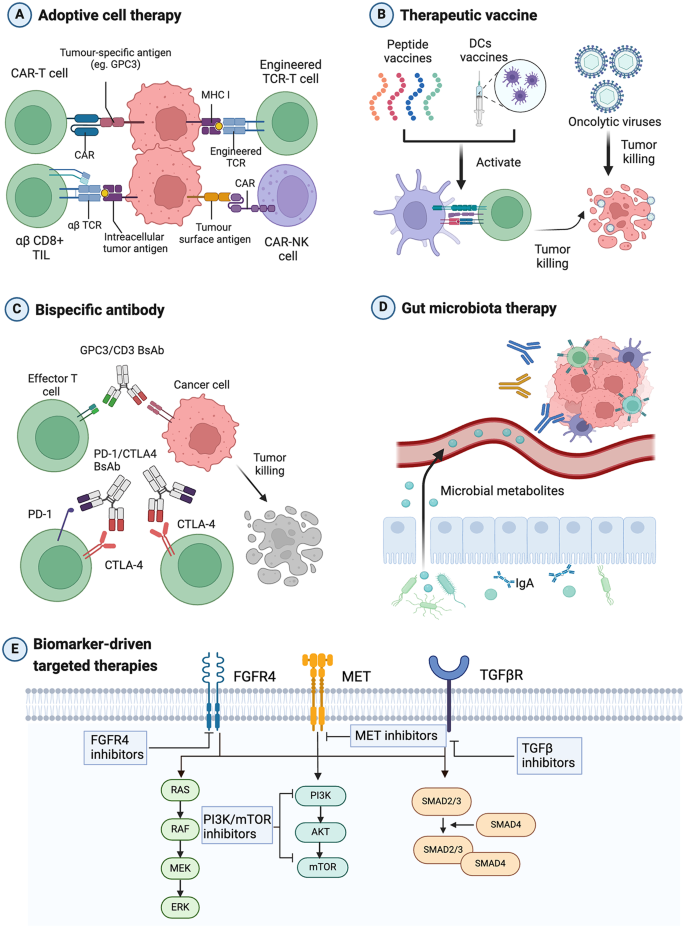
(Fig4:生物标志物驱动的aHCC系统疗法 overview)
