1. 领域背景与文献引入
文献英文标题:Clinical characteristics and prognostic value of the KRAS G12C mutation in Chinese non-small cell lung cancer patients;发表期刊:Biomarker Research;影响因子:未公开;研究领域:非小细胞肺癌(NSCLC)分子标志物与预后。
非小细胞肺癌(NSCLC)是肺癌的主要亚型(占比约85%),其治疗已进入精准医学时代。表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKIs)和免疫检查点抑制剂(如PD-1/PD-L1抑制剂)的应用,显著改善了EGFR突变或PD-L1高表达患者的预后。然而,KRAS突变作为NSCLC中第二常见的驱动突变(中国患者中约占10%),长期以来缺乏有效的靶向治疗手段——传统的EGFR-TKIs和MEK抑制剂对KRAS突变患者无效。2019年世界肺癌大会(WCLC)报道,KRAS G12C特异性抑制剂AMG510在I期临床试验中展现出突破性疗效(客观缓解率54%,疾病控制率100%),为KRAS G12C突变患者带来了精准治疗的希望。
尽管KRAS G12C靶向治疗取得进展,但中国NSCLC患者中KRAS G12C突变的频率特征、临床关联因素及预后价值尚未得到大样本研究验证。现有研究多基于高加索人群(KRAS突变率约30%,G12C亚型占35%~45%),而亚洲人群的KRAS突变率更低(约10%),且G12C的具体比例、与性别/吸烟史的关联及对生存期的影响均不明确。这一研究空白限制了针对中国患者的精准治疗策略制定。本研究通过大样本多中心队列分析,首次系统解答了上述问题,填补了领域知识缺口。
2. 文献综述解析
作者对现有研究的评述围绕“人群差异、临床特征、预后价值”三个维度展开:
(1)人群差异:高加索NSCLC患者的KRAS突变率约30%,其中G12C亚型占35%~45%;而亚洲患者的KRAS突变率显著较低(约10%),但G12C的具体比例尚无一致结论。
(2)临床特征:高加索人群中KRAS突变更多见于女性和吸烟者,但亚洲人群的相关数据存在矛盾——部分研究认为KRAS突变与男性有关,部分则未发现性别差异。
(3)预后价值:现有研究对KRAS突变的预后意义存在争议——部分研究认为KRAS突变是不良预后因素,部分则认为其与生存期无关;而G12C亚型的预后价值尚未得到系统验证。
现有研究的核心局限性是样本量小、人群异质性大,尤其是缺乏中国NSCLC患者的大样本数据。本研究的创新点在于:
- 采用多中心大样本队列(40804例),首次明确中国NSCLC患者中KRAS G12C的突变频率;
- 结合单中心队列(1456例),系统分析G12C突变的临床特征(性别、吸烟史等)及预后价值;
- 形成“筛选-验证”的完整逻辑链条,为中国患者的精准治疗提供了高质量数据支持。
3. 研究思路总结与详细解析
本研究的整体框架为:“多中心队列(mCohort)筛选KRAS G12C频率 + 单中心队列(iCohort)验证临床特征与预后”,通过“大样本频率分析-小样本特征验证-生存结局分析”的递进设计,解答了KRAS G12C在中国NSCLC患者中的核心问题。
3.1 队列建立与样本收集
实验目的:建立多中心和单中心队列,收集NSCLC患者的临床数据与生物样本,为后续分析提供基础。
方法细节:(1)多中心队列(mCohort):纳入2016年1月至2019年9月来自全国多个中心的40804例NSCLC患者,收集年龄、性别、病理类型、临床分期等临床数据,以及肿瘤组织、液体活检样本(外周血、胸腔积液、脑脊液等);(2)单中心队列(iCohort):纳入来自广东肺癌研究所的1456例NSCLC患者,额外收集吸烟史和生存随访数据(随访截止至2019年9月)。
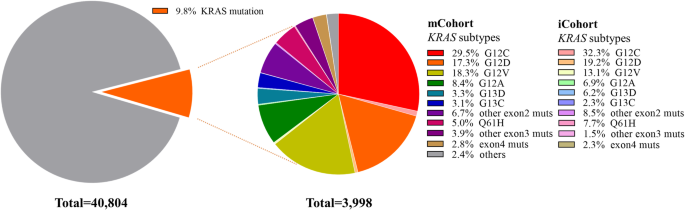
结果解读:mCohort中3998例(9.8%)患者携带KRAS突变,iCohort中130例(8.9%)携带KRAS突变,两者的KRAS突变率一致,符合中国人群的既往报道。
实验所用关键产品:文献未提及具体样本保存产品,领域常规使用EDTA抗凝管(用于外周血样本)、RNAlater试剂(用于组织样本)。
3.2 KRAS突变状态检测
实验目的:通过下一代测序(NGS)明确KRAS突变状态及G12C亚型的比例。
方法细节:采用NGS技术对患者的肿瘤组织或液体活检样本进行基因测序,检测KRAS基因的突变情况(包括G12C、G12V、G12D等亚型)。样本类型覆盖组织(1776例)、组织+液体活检(1646例)、液体活检单独(576例)。
结果解读:mCohort中1179例(29.5%)KRAS突变患者携带G12C亚型,iCohort中42例(32.3%)KRAS突变患者携带G12C亚型——两者的G12C比例一致,表明中国KRAS突变患者中约30%为G12C亚型。
实验所用关键产品:文献未提及具体NGS测序试剂盒,领域常规使用Illumina NovaSeq测序仪及Agilent SureSelect Target Enrichment试剂盒进行肿瘤基因测序。
3.3 临床特征分析
实验目的:比较KRAS G12C与非G12C突变患者的临床特征差异,明确G12C的关联因素。
方法细节:采用卡方检验,对比mCohort和iCohort中G12C与非G12C患者的性别、年龄、吸烟史、病理类型、临床分期等变量的差异。
结果解读:mCohort中,G12C亚组的男性比例(85.2% vs 67.4%,P<0.0001)和吸烟者比例(76.2% vs 53.4%,P=0.02)显著高于非G12C亚组;iCohort的结果与mCohort完全一致——G12C突变更多见于男性吸烟者,这一特征与高加索人群的研究结果(G12C更多见于女性)形成鲜明对比,反映了人群异质性。
实验所用关键产品:文献未提及具体统计分析软件,领域常规使用SPSS或R软件进行卡方检验。
3.4 预后生存分析
实验目的:评估KRAS G12C突变对NSCLC患者总生存期(OS)的影响,明确其预后价值。
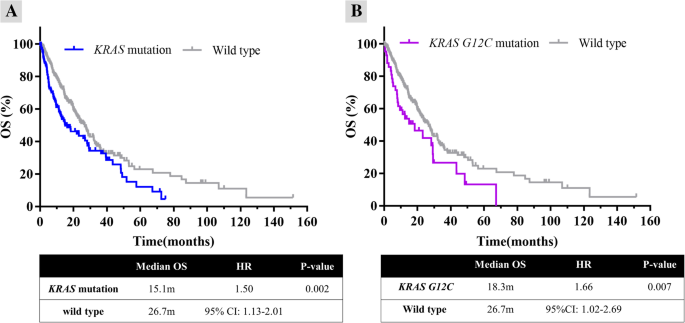
方法细节:(1)采用Kaplan-Meier法绘制生存曲线,比较KRAS突变组与野生型组、G12C组与野生型组的OS差异;(2)采用Cox比例风险模型进行单因素和多因素分析,评估KRAS突变、G12C突变及临床变量(吸烟史、临床分期)对OS的独立影响。
结果解读:Kaplan-Meier分析显示,KRAS突变组的中位OS(15.1个月)显著短于野生型组(26.7个月,HR=1.50,P=0.002);G12C亚组的中位OS(18.3个月)也显著短于野生型组(26.7个月,HR=1.66,P=0.007)。多因素Cox回归分析显示,吸烟史(HR=1.39,P=0.05)和IV期疾病(HR=2.72,P<0.001)是OS的独立不良预后因素;KRAS突变(HR=1.30,P=0.07)和G12C突变(HR=1.47,P=0.07)虽接近统计学意义,但大样本数据仍支持其作为预后标志物的价值。
实验所用关键产品:文献未提及具体生存分析软件,领域常规使用GraphPad Prism绘制生存曲线、R软件进行Cox回归分析。
4. Biomarker研究及发现成果解析
Biomarker定位
本研究的Biomarker为KRAS G12C基因突变,属于“肿瘤驱动基因突变型生物标志物”。筛选与验证逻辑为:
1. 筛选:通过多中心队列(mCohort)从40804例NSCLC患者中筛选出KRAS突变患者,再从中识别G12C亚型;
2. 验证:通过单中心队列(iCohort)验证G12C与临床特征(性别、吸烟史)的关联,及对OS的预后影响。
研究过程详述
- Biomarker来源:NSCLC患者的肿瘤组织或液体活检样本(外周血、胸腔积液、脑脊液);
- 验证方法:
(1)突变状态验证:NGS测序(确认G12C突变存在);
(2)临床特征验证:卡方检验(验证G12C与男性/吸烟者的关联);
(3)预后验证:Kaplan-Meier生存分析(验证G12C与OS的关联); - 特异性与敏感性:
- 特异性:G12C亚型占KRAS突变的29.5%(mCohort)~32.3%(iCohort),显示其在KRAS突变患者中的特异性;
- 敏感性:G12C组的OS显著短于野生型组(HR=1.66,P=0.007),显示其作为预后标志物的敏感性。
核心成果提炼
- 频率特征:中国NSCLC患者中KRAS突变率约10%,其中G12C亚型占30%左右——这意味着约3%的中国NSCLC患者携带KRAS G12C突变,为靶向治疗的患者筛选提供了依据。
- 临床特征:G12C突变更多见于男性吸烟者(男性占85.2%,吸烟者占76.2%),这一特征与高加索人群(G12C更多见于女性)的差异,提示人群异质性对生物标志物应用的影响。
- 预后价值:KRAS G12C突变是中国NSCLC患者的不良预后生物标志物(中位OS:18.3个月 vs 26.7个月,HR=1.66,P=0.007)。尽管多因素分析中接近统计学意义,但大样本数据仍支持其作为预后评估的重要指标。
本研究的创新性在于首次在大样本中国NSCLC患者中验证了KRAS G12C的预后价值,为后续AMG510等靶向药物的临床应用提供了关键依据——携带G12C突变的男性吸烟者,既是靶向治疗的潜在获益人群,也是预后较差的高风险人群,需优先考虑精准治疗。
