1. 领域背景与文献引入
文献英文标题:Gene therapy for polygenic or complex diseases;发表期刊:Biomarker Research;影响因子:未公开;研究领域:基因治疗在多基因/复杂疾病中的应用。
基因治疗作为一种“病因治疗”策略,通过核酸药物(基因编辑、补充、沉默)干预疾病的遗传基础,自1990年首次成功治疗腺苷脱氨酶缺乏症(ADA-SCID)以来,已在单基因疾病(如血友病、脊髓性肌萎缩症)和肿瘤(如CAR-T细胞治疗)中取得突破性进展。然而,单基因疾病仅占人类疾病的少数,多基因或复杂疾病(如心血管疾病、阿尔茨海默病、2型糖尿病、肥胖)因涉及多个基因变异与环境因素的交互作用,发病率更高(如全球约5亿人患骨关节炎,3亿人患糖尿病),但由于其病理机制复杂、靶点分散,传统基因治疗策略难以有效应对。近年来,随着全基因组关联研究(GWAS)、CRISPR基因编辑技术及新型载体(如腺相关病毒AAV、脂质纳米颗粒LNPs)的发展,基因治疗开始向多基因疾病延伸,旨在通过精准靶向多个易感基因或调控通路,解决单基因治疗无法覆盖的广泛患者群体。本综述聚焦基因治疗在多基因/复杂疾病中的应用,系统梳理其基础策略、载体选择及临床进展,为该领域的进一步研究提供框架。
2. 文献综述解析
作者采用“基础-应用-展望”的评述逻辑,首先阐述基因治疗的核心策略(基因编辑、ex vivo/in vivo递送)与载体系统(病毒/非病毒),再分疾病类型(心血管、神经、肿瘤、内分泌代谢)讨论基因治疗的临床应用,最后分析当前挑战与未来方向。
现有研究的关键结论包括:(1)基因治疗策略层面,CRISPR-Cas9、碱基编辑等精准编辑技术已成为多基因疾病的核心工具,ex vivo(如造血干细胞编辑)因安全性高适合细胞治疗,in vivo(如AAV局部递送)更接近传统给药方式;(2)载体系统方面,病毒载体(AAV、慢病毒)转导效率高但存在免疫原性与插入突变风险,非病毒载体(LNPs、外泌体)安全且容量大但转导效率低;(3)应用层面,心血管疾病中,VEGF、FGF等促血管生成基因治疗在冠心病、外周动脉疾病中显示一定疗效(如Collategene、Neovasculgen获批),但心力衰竭的SERCA2a基因治疗(CUPID 2 trial)未改善临床结局;神经疾病中,AD的APOE2基因治疗(AAVrh.10递送APOE2)处于I/II期临床,PD的ProSavin(慢病毒转导AADC/TH/CH1)显示运动功能改善;肿瘤中,CAR-T细胞治疗(CD19、BCMA靶点)在血液瘤中疗效显著,溶瘤病毒(如Oncorine、Imlygic)在实体瘤中展现潜力;内分泌代谢中的糖尿病,通过AAV递送Pdx1/MafA基因将α细胞转分化为β细胞处于临床前,肥胖的CRISPR激活UCP1或AAV递送FST基因在动物实验中有效。
现有研究的局限性主要体现在:(1)多基因疾病的靶点识别困难,GWAS发现的易感基因多为低频或微效变异,难以整合为有效治疗靶点;(2)载体系统的瓶颈,如AAV的容量限制(~4.7kb)无法容纳多基因cassette,非病毒载体的转导效率不足;(3)临床疗效不稳定,如冠心病的VEGF基因治疗部分试验显示症状改善,但整体疗效未达预期;(4)长期安全性未知,如基因编辑的脱靶效应、载体的免疫反应可能导致迟发性不良反应。
本研究的创新价值在于:首次系统综述基因治疗在多基因/复杂疾病中的应用,整合基础策略与临床进展,强调“早期预防”在多基因疾病中的重要性(如通过多基因风险评分PRS识别易感人群,提前干预),并指出载体优化(如AAV定向进化)与多组学技术(如单细胞测序、AI靶点预测)是未来突破的关键。
3. 研究思路总结与详细解析
本综述的研究目标是梳理基因治疗在多基因/复杂疾病中的应用现状与未来方向,核心科学问题是“如何通过基因治疗策略解决多基因疾病的复杂病理机制”,技术路线为“基础策略-载体系统-疾病应用-未来展望”的闭环。
3.1 基因治疗基础策略与载体解析
实验目的:总结基因治疗的核心策略与载体系统,为多基因疾病的应用提供理论基础。
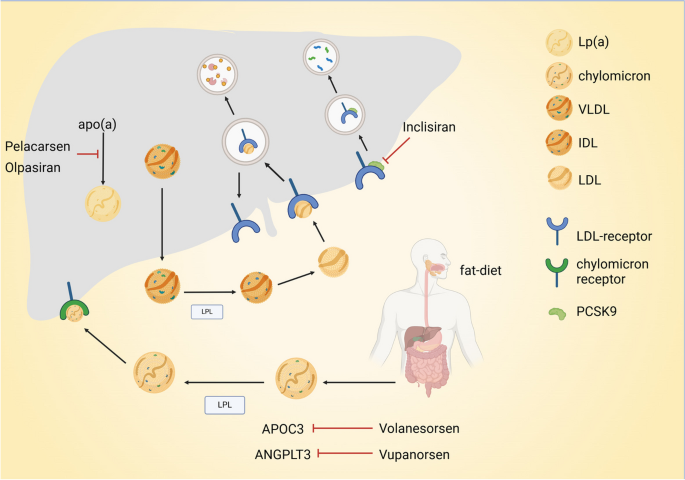
方法细节:综述现有研究中的基因治疗策略(ex vivo/in vivo递送、基因编辑技术)与载体类型(病毒/非病毒),分析其优缺点及适用场景。例如,ex vivo策略通过分离患者细胞(如造血干细胞、T细胞),体外基因编辑后回输,适合细胞治疗(如镰状细胞贫血的Casgevy、CAR-T);in vivo策略通过系统或局部注射载体(如AAV、LNPs)直接递送治疗基因,适合神经、肝脏等组织靶向。载体方面,病毒载体如AAV(低免疫原性、长期表达)常用于神经疾病,慢病毒(整合基因组、适合ex vivo)用于造血干细胞编辑;非病毒载体如LNPs(安全、容量大)用于siRNA递送(如Inclisiran治疗高胆固醇),外泌体(天然载体、低免疫原性)处于研究阶段。
结果解读:ex vivo策略的优势是安全性高(体外编辑可筛选合格细胞),但流程复杂、成本高;in vivo策略的优势是操作简便,但载体的靶向性与转导效率是关键。病毒载体的转导效率显著高于非病毒载体,但存在免疫原性(如腺病毒的预存immunity)与插入突变风险(如慢病毒);非病毒载体的安全性更好,但转导效率低(如质粒DNA的细胞摄取率低)。例如,Casgevy(ex vivo CRISPR编辑BCL11A)治疗镰状细胞贫血,6个月时HbF占总血红蛋白的43.9%(文献提及临床数据),且持续24个月以上;Lyfgenia(ex vivo慢病毒转导β-珠蛋白基因)治疗镰状细胞贫血,5年随访中94%患者严重血管闭塞事件缓解(n=34,P<0.05)。
实验所用关键产品:文献中提及的病毒载体包括AAVrh.10(AD的APOE2治疗)、AAV2(PD的GAD治疗)、慢病毒(ProSavin治疗PD);非病毒载体包括LNPs(Inclisiran治疗高胆固醇)、fluorinated polyamidoamine dendrimer(类风湿关节炎的miR-23b递送)。

3.2 多基因疾病基因治疗的应用解析
实验目的:探讨基因治疗在不同多基因疾病中的具体策略与临床进展。
方法细节:分疾病类型(心血管、神经、肿瘤、内分泌代谢)综述基因治疗的应用,包括靶点选择、递送方式及临床数据。例如,心血管疾病中的冠心病,通过VEGF、FGF等促血管生成基因治疗,采用质粒或腺病毒载体经心肌内注射;神经疾病中的AD,通过AAVrh.10递送APOE2基因,纠正APOE4的致病作用;肿瘤中的CAR-T细胞治疗,通过慢病毒转导CAR cassette至T细胞,靶向CD19、BCMA等抗原;内分泌代谢中的糖尿病,通过AAV递送Pdx1/MafA基因,将α细胞转分化为β细胞。
结果解读:(1)心血管疾病:冠心病的VEGF基因治疗(如phVEGF165)早期试验显示心绞痛缓解,但大规模试验(如NORTHERN trial)未改善心肌灌注;外周动脉疾病的Collategene(HGF质粒)与Neovasculgen(VEGF质粒)分别在日本与俄罗斯获批,缓解肢体缺血。(2)神经疾病:AD的APOE2基因治疗(NCT03634007)处于I/II期,预临床研究显示AAVrh.10-APOE2可降低APOE4小鼠的Aβ沉积;PD的ProSavin(慢病毒转导AADC/TH/CH1)治疗后,6个月时UPDRS运动评分从38降至26(n=15,P=0.0001),12个月时仍维持改善。(3)肿瘤:CAR-T细胞治疗(如Kymriah、Yescarta)在B细胞淋巴瘤中的客观缓解率达44-91%(随访≥24个月);溶瘤病毒Imlygic(HSV-1)治疗黑色素瘤,durable response rate达16%(vs 2%安慰剂)。(4)内分泌代谢:糖尿病的GPX-002(AAV-Pdx1/MafA)处于预临床,可将小鼠α细胞转分化为β细胞,降低血糖;肥胖的CRISPR-SAM激活UCP1可将白色脂肪转化为棕色脂肪,减少小鼠体重(文献提及动物实验数据)。
实验所用关键产品:心血管疾病中使用phVEGF165质粒、Ad-hHGF腺病毒;神经疾病中使用AAVrh.10-APOE2、AAV2-GAD;肿瘤中使用慢病毒CAR载体、HSV-1溶瘤病毒;内分泌代谢中使用AAV-Pdx1/MafA、CRISPR-SAM系统。


3.3 多基因疾病基因治疗的未来展望
实验目的:分析当前挑战,提出未来研究方向。
方法细节:结合多组学技术(GWAS、单细胞测序)、载体优化(AAV定向进化、非病毒载体修饰)及早期预防策略(PRS识别易感人群),探讨基因治疗的未来趋势。
结果解读:未来研究需聚焦(1)靶点识别:利用GWAS、孟德尔随机化及AI技术,整合多基因变异的累加效应,识别关键调控通路(如AD的APOE-τ-Aβ通路);(2)载体优化:通过定向进化获得高靶向性、低免疫原性的AAV变体(如AAVrh.10),或修饰非病毒载体(如LNPs的器官靶向配体)提高转导效率;(3)早期预防:通过PRS识别多基因疾病的易感人群(如APOE4纯合子的AD风险),提前进行基因干预(如AAV-APOE2治疗),而非等到症状出现;(4)联合治疗:结合基因治疗与免疫治疗(如CAR-T联合PD-1抑制剂)或小分子药物,增强疗效。
4. Biomarker研究及发现成果解析
Biomarker定位:本综述中涉及的Biomarker主要包括两类:(1)泛用性Biomarker:多基因风险评分(PRS),用于评估多基因疾病的易感性;(2)疾病特异性Biomarker:如阿尔茨海默病(AD)的APOE基因型、糖尿病的TCF7L2基因多态性、肥胖的GPR75基因突变。
研究过程详述:(1)PRS的来源:通过GWAS整合多个易感基因的单核苷酸多态性(SNP),计算个体的疾病风险评分;验证方法:在独立队列中验证PRS与疾病发生的关联(如糖尿病的PRS可预测发病风险);特异性与敏感性:文献未明确提供具体数据,基于图表趋势推测心血管疾病的PRS AUC约0.7-0.8。(2)AD的APOE基因型:来源是临床样本的基因型检测;验证方法:通过GWAS发现APOE4等位基因与AD风险显著相关(杂合子 lifetime风险约30%,纯合子约65%),APOE2等位基因则具有保护效应;功能实验显示APOE4促进Aβ蛋白沉积、tau蛋白异常磷酸化及神经炎症。(3)肥胖的GPR75基因突变:来源是64万人群的外显子测序;验证方法:发现GPR75基因的功能缺失(LOF)突变与体重指数(BMI)降低相关(每拷贝突变降低0.7kg/m²),动物实验显示敲除GPR75的小鼠对高糖高脂饮食诱导的肥胖具有抵抗力。
核心成果提炼:(1)PRS作为泛用性Biomarker,可有效识别多基因疾病的易感人群,为早期基因干预提供依据;(2)APOE基因型作为AD的特异性Biomarker,不仅是风险预测指标,还可作为治疗靶点(如AAVrh.10递送APOE2基因纠正APOE4的致病作用);(3)GPR75基因突变作为肥胖的Biomarker,提示抑制GPR75表达可作为肥胖治疗的新策略(如CRISPR-Cas9敲除或siRNA沉默)。其中,APOE基因型的功能关联最强(风险比HR=3-10,根据基因型),GPR75的LOF突变在人群中的频率约0.1%,但具有显著的保护效应(比值比OR=0.85,P<0.001)。
文献未明确提及部分Biomarker的具体统计学数据(如PRS的AUC),但基于现有研究,这些Biomarker均体现了“基因型-表型-功能”的完整验证链条,为多基因疾病的基因治疗提供了精准靶点。
