1. 领域背景与文献引入
文献英文标题:Overexpression and cytoplasmic localization of caspase-6 is associated with lamin A degradation in set of ovarian cancers;发表期刊:Biomarker Research;影响因子:未公开;研究领域:卵巢癌分子生物学。
卵巢癌是全球范围内最致命的妇科恶性肿瘤,也是女性癌症相关死亡的主要原因之一。其治疗复杂且预后极差——约90%的病例会出现治疗失败,根本原因在于诊断时肿瘤多已扩散至卵巢外,而现有治疗难以针对早期分子异常进行干预。领域共识:卵巢癌的发生与一系列分子异常密切相关,其中核纤层蛋白A/C(lamin A/C)的丢失是重要事件之一,可先于核变形、染色体数目不稳定、多倍体等卵巢癌特征性改变出现。已知lamin A是半胱天冬酶-6(caspase-6)的底物,后者通常由caspase-3激活并定位于细胞核内,通过降解lamin A参与细胞凋亡。然而,卵巢癌中常存在caspase-3缺失,且caspase-6的细胞质定位与lamin A降解的非凋亡关联尚未被探讨。因此,本研究旨在揭示卵巢癌细胞中caspase-6的过表达及细胞质定位与lamin A降解的关联,为理解卵巢癌早期分子机制提供新线索。
2. 文献综述解析
作者对现有研究的评述逻辑围绕“lamin A/C与卵巢癌的关系”“caspase-6的功能及激活机制”“卵巢癌中凋亡通路异常”三大维度展开。现有研究表明:(1)lamin A/C的丢失是卵巢癌早期分子异常,与核结构破坏、染色体不稳定直接相关;(2)caspase-6是lamin A的特异性蛋白酶,在凋亡过程中由caspase-3激活,定位于细胞核内降解lamin A;(3)卵巢癌中常存在caspase-3缺失,导致经典凋亡通路受阻,但caspase-6的亚细胞定位及与lamin A降解的非凋亡关联未被研究。
现有研究的局限性在于未明确卵巢癌中caspase-6的细胞质定位对lamin A降解的作用,而本文的创新点在于:通过Western blot、免疫荧光、流式细胞术、免疫组化(IHC)等多技术手段,系统验证卵巢癌细胞系及临床组织中caspase-6的过表达、细胞质定位与lamin A降解的关联,填补了“卵巢癌中caspase-6非凋亡功能”的研究空白。
3. 研究思路总结与详细解析
本研究的核心目标是探讨卵巢癌中caspase-6过表达及细胞质定位与lamin A降解的关联,核心科学问题是“caspase-6的细胞质定位是否参与lamin A降解”,技术路线遵循“细胞模型比较→蛋白表达/定位分析→活性检测→功能验证→组织样本验证”的闭环逻辑。
3.1 细胞模型构建与差异分析
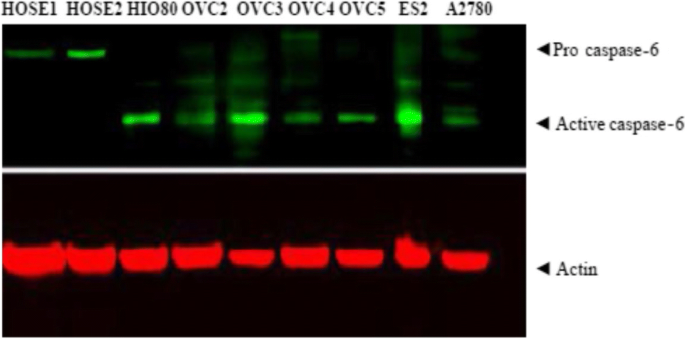
实验目的是比较正常卵巢上皮细胞、永生化细胞及癌细胞中lamin A/C与caspase-6的表达差异。方法细节:培养正常人类卵巢表面上皮细胞(HOSE)、永生化卵巢表面上皮细胞(HIO,由HOSE转染SV40 T抗原建立)及7种卵巢癌细胞系(如OVCAR3、OVCAR5、A2780);HOSE用含15%胎牛血清(FBS)的105+199培养基培养,癌细胞系用含10%FBS的DMEM培养基培养。结果解读:正常HOSE细胞高表达lamin A/C、低表达活性caspase-6;永生化HIO细胞及癌细胞系则相反——高表达活性caspase-6、低表达lamin A/C(Fig.1)。实验所用关键产品:Sigma-Aldrich的caspase-6抗体、Transduction Lab的lamin A/C抗体、Bio-Rad的细胞培养基组分。
3.2 蛋白表达与亚细胞定位检测
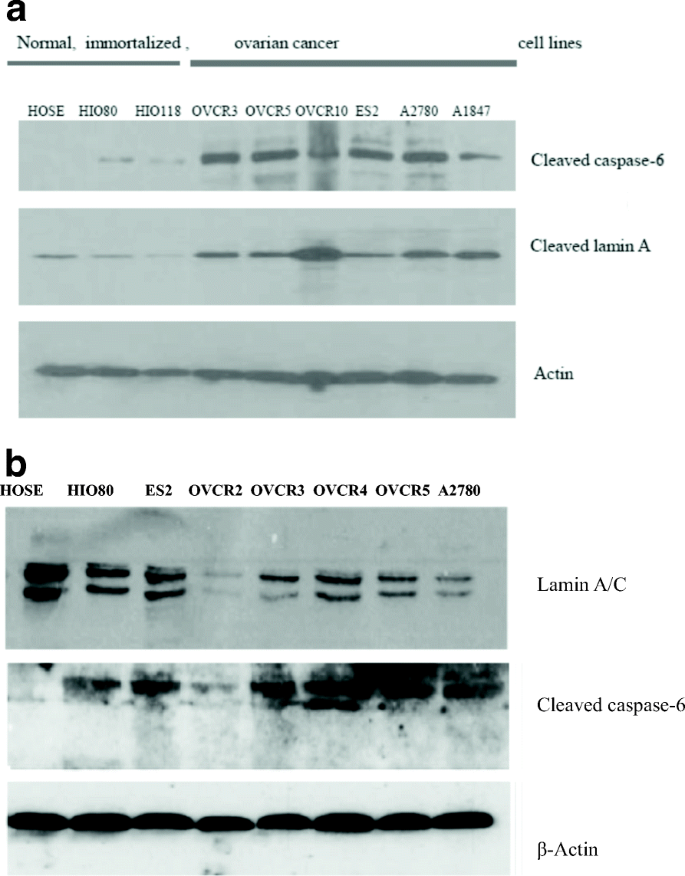
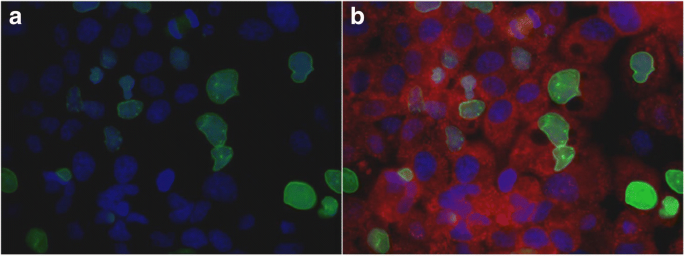
实验目的是明确caspase-6与lamin A的表达水平及亚细胞定位。方法细节:(1)Western blot:用RIPA缓冲液裂解细胞,4-12%梯度凝胶电泳分离蛋白,转膜后用lamin A/C、caspase-6一抗孵育,HRP二抗检测;(2)免疫荧光:细胞固定后用lamin A(绿色)、活性caspase-6(p20,红色)抗体双染,DAPI染核后荧光显微镜观察。结果解读:Western blot显示癌细胞系(如OVCAR3)的活性caspase-6水平显著高于正常细胞,而lamin A/C水平显著降低(Fig.2);免疫荧光显示OVCAR3细胞中活性caspase-6定位于细胞质,且多数细胞丢失lamin A(Fig.6)。实验所用关键产品:Cell Signaling的lamin A抗体、Santa-Cruz的caspase-6(p20)抗体、Invitrogen的AlexaFluor荧光二抗。
3.3 caspase-6活性量化分析
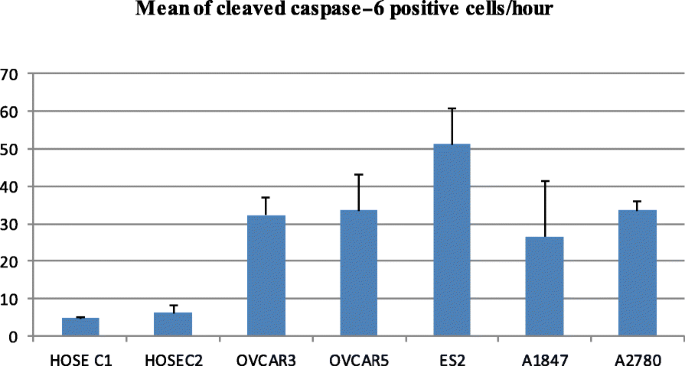
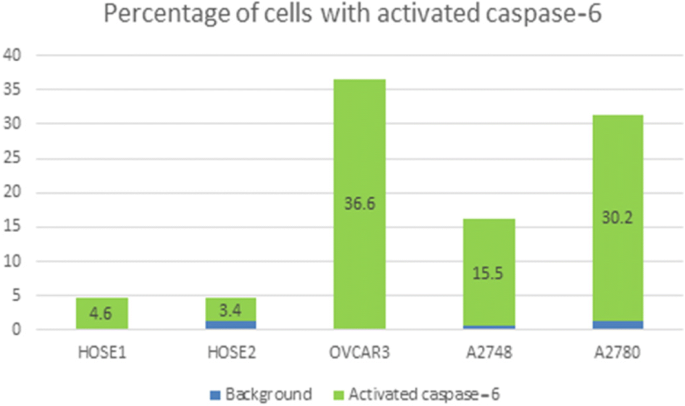
实验目的是量化正常与癌细胞中caspase-6的活性差异。方法细节:使用APO LOGIX Carboxyfluorescein caspase-6检测试剂盒(FAM-VEID-FMK),细胞孵育试剂盒2小时后,通过荧光显微镜计数100个细胞中的绿色荧光细胞(活性caspase-6阳性),或用BD LSR Fortessa流式细胞仪检测10000个细胞的荧光强度。结果解读:所有癌细胞系的活性caspase-6阳性率显著高于正常HOSE细胞——HOSEC1为5±0.14%、HOSEC2为6.2±1.97%,而OVCAR3为32.2±4.80%、ES2为51.2±9.61%(Fig.3、Fig.4)。实验所用关键产品:APO LOGIX的caspase-6检测试剂盒、BD的LSR Fortessa流式细胞仪。
3.4 抑制剂与siRNA功能验证
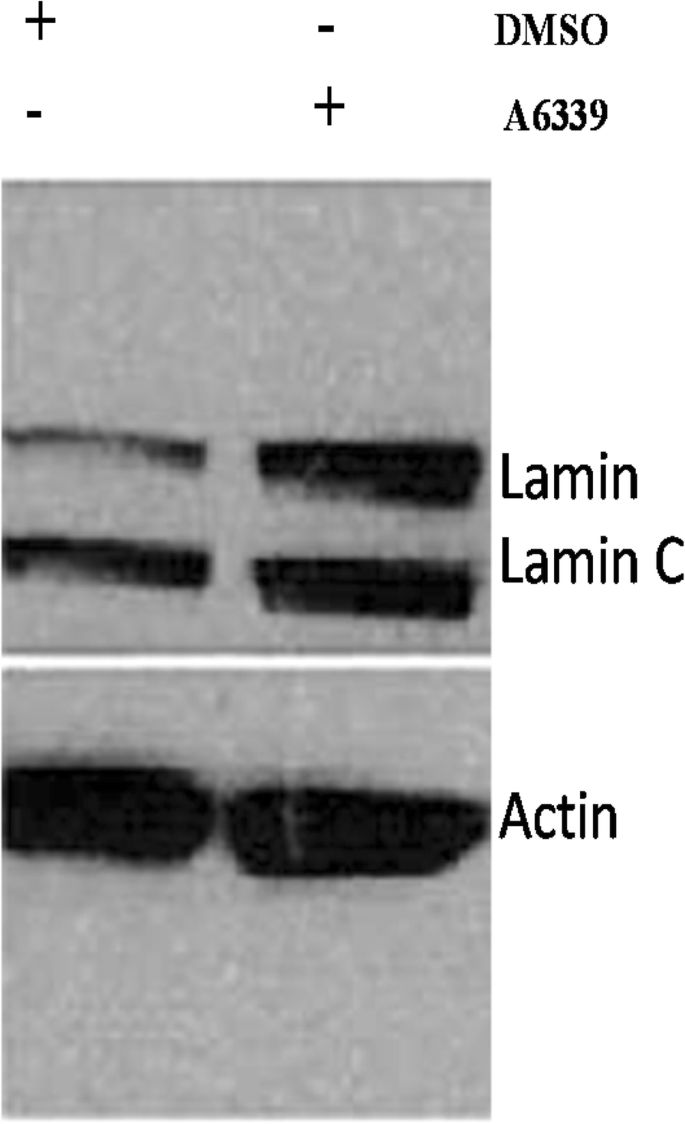
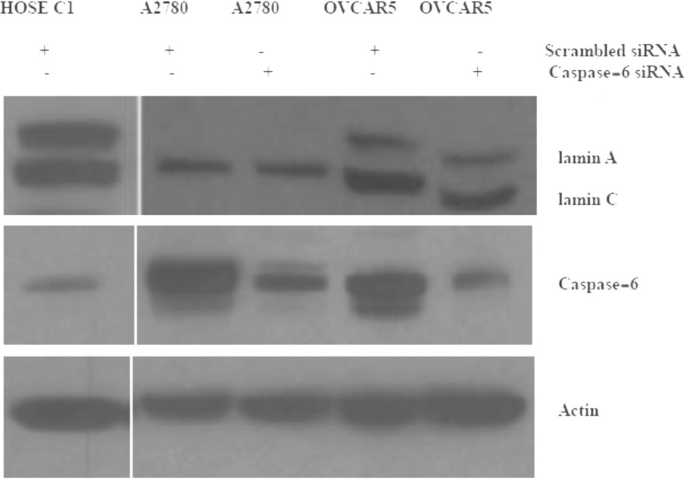
实验目的是验证caspase-6对lamin A降解的直接作用。方法细节:(1)抑制剂实验:用caspase-6特异性抑制剂A6339处理OVCAR3细胞24小时;(2)siRNA实验:用caspase-6 siRNA转染OVCAR5、A2780细胞72小时;均通过Western blot检测lamin A/C表达。结果解读:A6339抑制caspase-6活性后,OVCAR3细胞的lamin A表达显著增加(Fig.5);但siRNA抑制caspase-6后,OVCAR5、A2780细胞的lamin A/C未恢复(Fig.12),提示部分细胞系中lamin A降解可能依赖其他途径(如激酶磷酸化)。实验所用关键产品:Sigma-Aldrich的A6339抑制剂、Santacruz的caspase-6 siRNA、Invitrogen的Lipofectamine 2000转染试剂。
3.5 临床组织样本验证
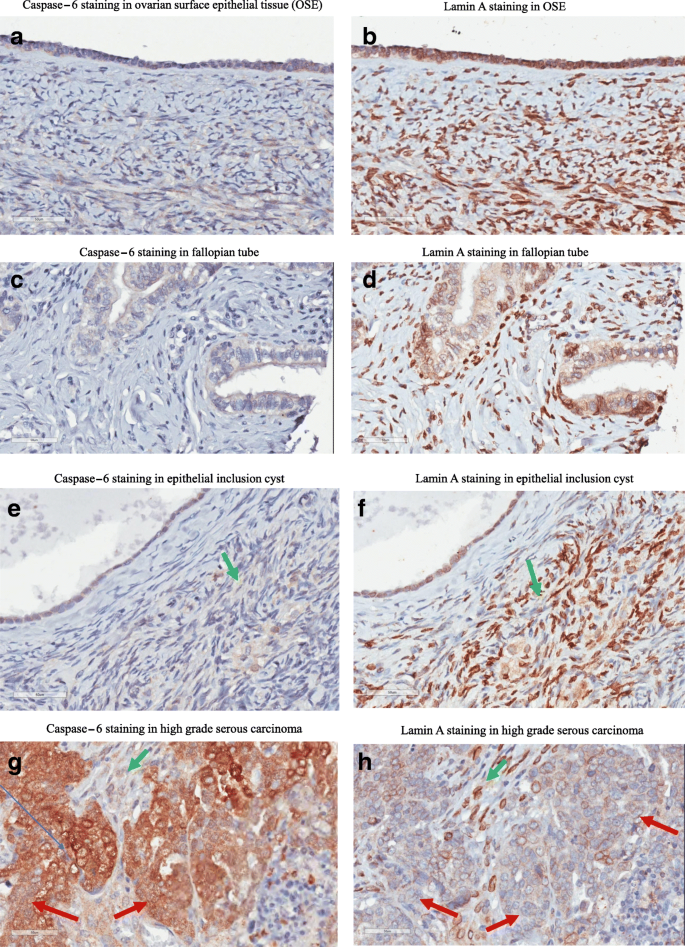
实验目的是在人卵巢组织中验证caspase-6与lamin A的关联。方法细节:使用Fox Chase癌症中心提供的卵巢癌组织芯片(120个肿瘤组织、5个正常对照)及20个预防性卵巢切除样本,通过免疫组化(IHC)染色活性caspase-6和lamin A,采用DAKO Envision TM+系统及DAB试剂盒检测。结果解读:正常卵巢上皮、输卵管细胞无活性caspase-6表达但高表达lamin A;而高级别浆液性癌组织中,活性caspase-6过表达于细胞质,且多数细胞丢失lamin A(Fig.9)。实验所用关键产品:DAKO的Envision TM+系统、DAB试剂盒。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本研究聚焦的Biomarker为“细胞质定位的活性caspase-6”,属于“功能型分子 Biomarker”。其筛选与验证逻辑遵循“细胞系差异筛选→功能实验验证→组织样本确认”的完整链条:先通过正常/永生化/癌细胞系比较发现caspase-6的过表达及细胞质定位与lamin A降解相关,再用抑制剂验证其功能,最后通过临床组织样本确认关联。
研究过程与数据解读
Biomarker来源包括细胞系(HOSE、HIO、卵巢癌细胞)与临床组织(卵巢癌组织芯片、预防性切除样本)。验证方法涵盖:(1)Western blot与免疫荧光检测蛋白表达及定位;(2)流式细胞术与荧光试剂盒量化活性;(3)免疫组化验证组织表达。特异性与敏感性数据显示:癌细胞系中活性caspase-6阳性率显著高于正常细胞(如OVCAR3为32.2±4.80% vs HOSEC1为5±0.14%,n=3,趋势显著);临床组织中,正常上皮无活性caspase-6表达,而癌组织过表达(免疫组化显示差异)。
核心成果与创新价值
本研究的核心成果是“细胞质定位的活性caspase-6与卵巢癌细胞及组织中lamin A降解密切相关”,其创新性体现在:首次报道卵巢癌中caspase-6的细胞质定位参与lamin A降解的非凋亡过程,为理解卵巢癌核异常(如核变形、染色体不稳定)的发生机制提供了新视角。此外,细胞质定位的活性caspase-6有望成为卵巢癌早期诊断或治疗的潜在靶点——其过表达可提示lamin A降解及核异常,为针对性干预提供分子依据。
综上,本研究通过多维度实验验证了caspase-6与lamin A的关联,填补了卵巢癌分子机制的研究空白,为后续 Biomarker 开发及治疗靶点探索奠定了基础。
