1. 领域背景与文献引入
文献英文标题:Single-cell RNA sequencing identifies a subtype of FN1 + tumor-associated macrophages associated with glioma recurrence and as a biomarker for immunotherapy;发表期刊:Biomarker Research;影响因子:未公开;研究领域:胶质瘤免疫微环境与复发机制。
胶质瘤是颅内最常见的原发性恶性肿瘤,标准治疗方案(最大范围手术切除联合术后放化疗,辅以电场治疗、免疫治疗等新兴疗法)下患者预后仍极差,5年生存率不足10%,复发是导致患者死亡的主要原因。现有研究表明,胶质瘤异质性极强,间质型胶质瘤因预后最差、复发间隔最短,成为研究重点——复发时肿瘤分子分型常向间质型转化,伴随免疫微环境的动态改变,尤其是肿瘤相关巨噬细胞(TAMs)的浸润增加。TAMs包括脑 resident小胶质细胞(MG)和骨髓来源巨噬细胞(BMDM),其表型可塑性强,传统M1/M2二分法已无法描述其异质性;单细胞RNA测序(scRNA-seq)虽揭示了TAMs更复杂的表型(如Gpnmb高表达的TAMs抑制T细胞活化),但与胶质瘤复发直接相关的TAMs亚型及分子机制仍不明确。
针对这一空白,本研究聚焦“胶质瘤复发相关TAMs亚型”这一核心问题,通过单细胞测序结合多组学分析,鉴定与复发相关的FN1+TAMs亚型,探索其在肿瘤微环境中的功能及临床价值,为胶质瘤复发的早期预测和精准治疗提供新靶点与生物标志物。
2. 文献综述解析
作者对现有研究的分类维度主要围绕“TAMs的来源与异质性”“TAMs在胶质瘤进展中的作用”“单细胞测序在TAMs研究中的应用”展开:
现有研究的关键结论与局限
- TAMs的异质性与功能:TAMs是胶质瘤微环境中最丰富的免疫细胞,参与肿瘤增殖、侵袭及免疫抑制,但传统M1/M2分类过于简化——单细胞测序揭示TAMs存在更复杂的表型(如Gpnmb高表达的TAMs通过Cxcl16-Cxcr6通路抑制T细胞活化);
- TAMs与胶质瘤复发的关联:复发胶质瘤中TAMs浸润增加(如CD68+TAMs),但具体哪些亚型驱动复发尚不明确;
- 技术方法的优势与局限:单细胞测序和空间转录组能高分辨率解析TAMs的异质性与空间分布,但现有研究多关注TAMs的表型描述,缺乏对其与复发、免疫治疗响应的系统性关联分析。
文献创新价值
本研究的核心创新在于:首次通过单细胞RNA测序鉴定出与胶质瘤复发直接相关的FN1+TAMs亚型,突破了传统TAMs研究的局限性;并系统揭示其“缺氧微环境富集→免疫抑制微环境调控→免疫治疗耐药”的功能轴,同时验证其作为复发预测及免疫治疗响应的生物标志物价值,为胶质瘤复发的机制研究和临床转化提供了新视角。
3. 研究思路总结与详细解析
整体框架
研究目标:鉴定与胶质瘤复发相关的TAMs亚型,解析其生物学功能、空间分布及临床意义;
核心科学问题:FN1+TAMs如何调控胶质瘤复发及免疫微环境?能否作为复发预测与免疫治疗响应的生物标志物?
技术路线:复发相关基因签名(RRS)构建→单细胞数据筛选高RRS的TAMs亚型→FN1+TAMs的临床相关性验证→空间分布与缺氧微环境关联分析→免疫微环境调控作用研究→免疫治疗响应预测价值验证→PRIMEG数据库构建。
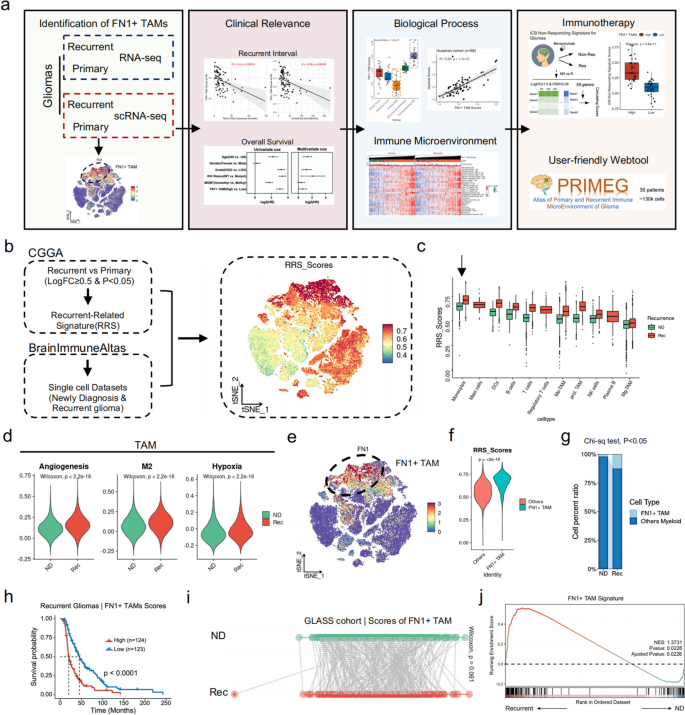
3.1 复发相关基因签名(RRS)构建与FN1+TAMs鉴定
实验目的:筛选与胶质瘤复发相关的基因签名,定位到驱动复发的TAMs亚型。
方法细节:
1. 利用中国胶质瘤基因组 atlas(CGGA)的复发与原发性胶质瘤RNA-seq数据,通过limma包筛选“log₂FC≥0.5、调整后P值<0.05”的上调基因,定义为“复发相关基因签名(RRS)”;
2. 下载BrainImmuneAltas单细胞数据集(含原发性与复发性胶质瘤的免疫细胞),通过Seurat包的AddModuleScore函数计算每个细胞的RRS得分,定位高RRS的免疫细胞亚型;
3. 分析高RRS TAMs的差异表达基因(DEGs),鉴定其标志性分子。
结果解读:
- RRS在单核细胞中表达最高,且复发性胶质瘤的单核细胞RRS得分显著高于原发性(P<0.05);
- 高RRS的TAMs亚型显著高表达FN1(纤维连接蛋白1),命名为“FN1+TAMs”;
- FN1+TAMs的RRS得分显著高于其他TAMs亚型(P<0.01),且复发性胶质瘤中FN1+TAMs的比例显著高于原发性(图1)。
实验所用关键产品:文献未提及具体实验产品,领域常规使用limma、Seurat等R包进行生信分析。
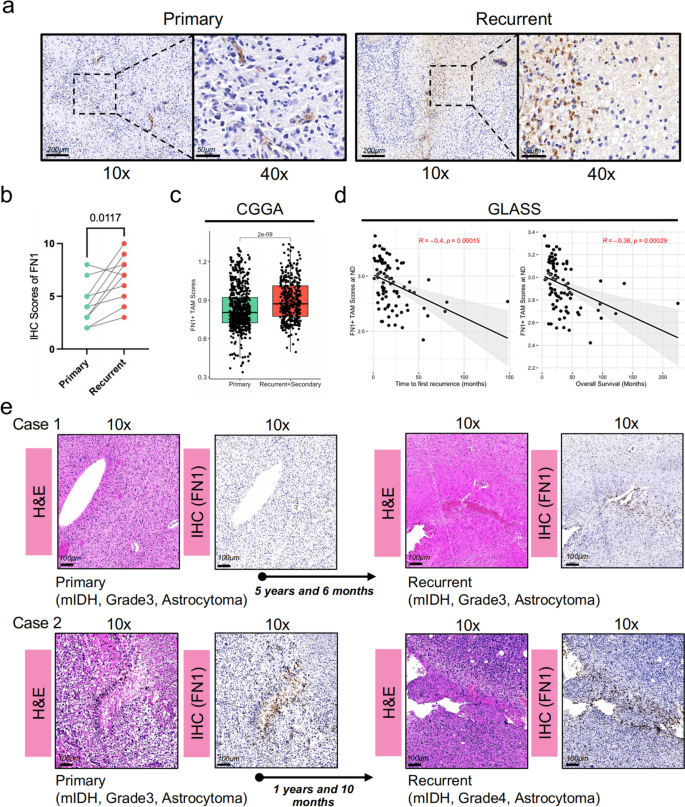
3.2 FN1+TAMs与胶质瘤复发及预后的临床验证
实验目的:验证FN1+TAMs与胶质瘤复发间隔、预后的相关性。
方法细节:
1. 免疫组化验证:收集华山医院8对原发性与复发性胶质瘤样本,用4%多聚甲醛固定、石蜡包埋,切片后用CST的FN1抗体(货号26836,1:100稀释)进行免疫组化染色,ImageJ定量分析FN1表达;
2. 数据库分析:利用GLASS队列(配对原发性与复发性胶质瘤)的RNA-seq数据,通过ssGSEA计算FN1+TAMs得分,分析其与复发间隔的相关性;
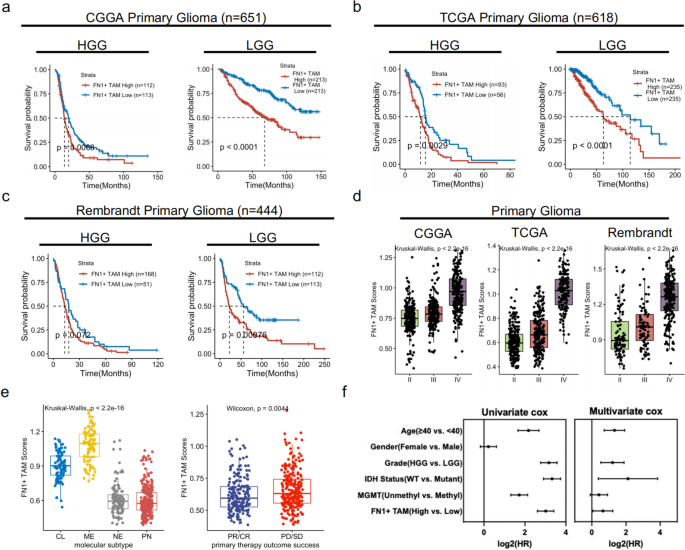
3. 生存分析:纳入CGGA、TCGA、Rembrandt数据库的1713例原发性胶质瘤患者,通过survival包分析高/低FN1+TAMs得分组的总生存期差异;
4. 独立预后因素验证:通过Cox回归分析(调整年龄、性别、病理分级、IDH突变等因素),验证FN1+TAMs得分的独立预后价值。
结果解读:
- 免疫组化显示,复发性胶质瘤的FN1蛋白表达显著高于原发性(n=8,P<0.05,图2a-b);
- GLASS队列中,原发性胶质瘤的FN1+TAMs得分与复发间隔(R=-0.4,P<0.01)、总生存期(R=-0.38,P<0.01)均呈显著负相关(图2d);
- 1713例原发性胶质瘤患者中,高FN1+TAMs得分组的总生存期显著缩短(HR=1.5,95%CI 1.3-1.7,P<0.001,图3a-c);
- Cox回归显示,FN1+TAMs得分是原发性胶质瘤的独立预后因素(P<0.01,图3f)。
实验所用关键产品:Fibronectin/FN1(E5H6X)Rabbit mAb #26836(CST)。
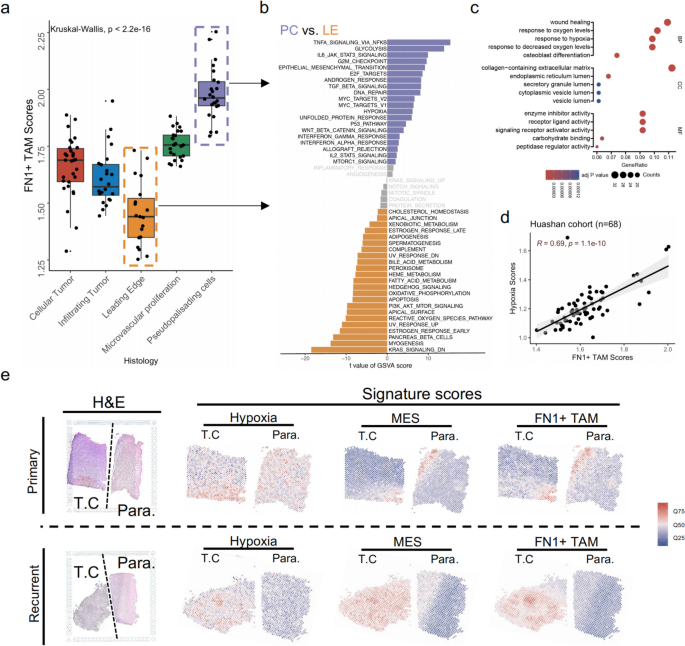
3.3 FN1+TAMs的空间分布与缺氧微环境关联
实验目的:解析FN1+TAMs在胶质瘤中的空间分布及与微环境的关系。
方法细节:
1. 空间分布分析:利用Ivy Glioblastoma Atlas的胶质瘤生态位(假栅栏细胞区PC、前沿区LE)转录组数据,分析FN1+TAMs得分在不同区域的差异;
2. 微环境特征分析:通过GSVA算法比较PC区与LE区的Hallmark 50信号通路差异;
3. 缺氧相关性验证:收集华山医院68例胶质瘤样本的RNA-seq数据,通过ssGSEA计算缺氧得分,分析其与FN1+TAMs得分的相关性;
4. 空间共定位验证:利用Mei等研究的空间转录组数据,分析FN1+TAMs与缺氧、间质信号的空间分布关系。
结果解读:
- FN1+TAMs得分在PC区最高、LE区最低(P<0.01,图4a);
- PC区高表达缺氧、TNF-α/NFκB、IL6/JAK/STAT3等信号(图4b),GO富集显示其功能与“缺氧响应”“伤口愈合”相关(图4c);
- 华山医院样本中,FN1+TAMs得分与缺氧得分呈显著正相关(R=0.69,P<0.001,图4d);
- 空间转录组显示,FN1+TAMs与缺氧信号、间质信号在复发性胶质瘤中显著共定位(图4e)。
实验所用关键产品:文献未提及具体实验产品,领域常规使用GSVA、Ivy Glioblastoma Atlas等资源。
3.4 FN1+TAMs对免疫抑制微环境的调控
实验目的:探索FN1+TAMs在胶质瘤免疫微环境中的作用。
方法细节:
1. 免疫细胞浸润分析:通过ssGSEA计算28种免疫细胞的浸润得分,分析其与FN1+TAMs得分的相关性;
2. 肿瘤免疫周期分析:利用TIP数据库的免疫周期基因集,分析FN1+TAMs得分与免疫周期各步骤(如T细胞激活、肿瘤杀伤)的关联;
3. 免疫通路分析:通过GSVA分析FN1+TAMs得分与25条免疫相关通路(如IFNγ、PDL1信号)的相关性。
结果解读:
- FN1+TAMs得分与T细胞、髓源性抑制细胞(MDSCs)浸润呈显著正相关(R=0.5,P<0.01,图5a);
- 肿瘤免疫周期中,FN1+TAMs得分与“免疫细胞招募(步骤4)”“T细胞识别(步骤6)”正相关,但与“肿瘤杀伤(步骤7)”无显著关联(图5e左下);
- FN1+TAMs得分与IFNγ、PDL1信号、慢性炎症等免疫抑制通路显著正相关(R=0.6,P<0.01,图5e右上)。
实验所用关键产品:文献未提及具体实验产品,领域常规使用ssGSEA、TIP数据库等工具。
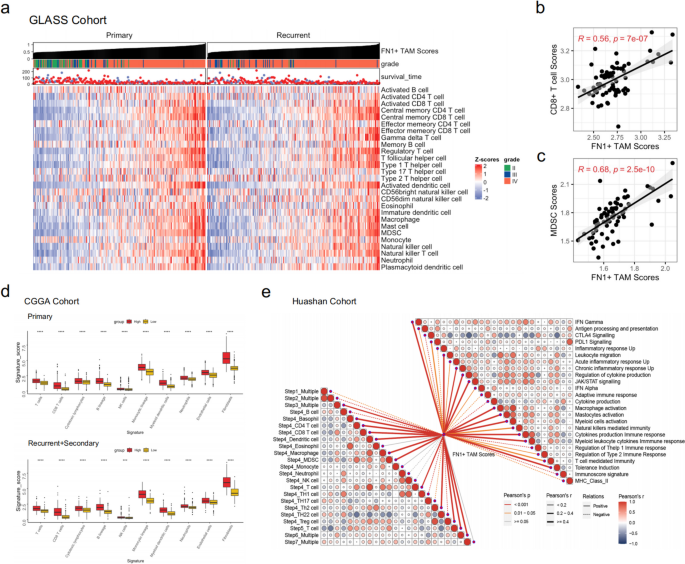
3.5 FN1+TAMs作为免疫治疗响应生物标志物的验证
实验目的:验证FN1+TAMs对胶质瘤免疫治疗响应的预测价值。
方法细节:
1. 免疫治疗队列分析:下载GSE79671队列(36例接受免疫治疗的胶质瘤患者)的RNA-seq数据,分析高/低FN1+TAMs得分组的治疗响应(R=响应、NR=无响应)差异;
2. 单细胞验证:利用Mei等研究的免疫治疗患者单细胞数据,比较NR组与R组髓系细胞的FN1+TAMs得分及FN1表达差异;
3. 治疗敏感性预测:通过SubMap算法,比较FN1+TAMs亚组与免疫治疗响应患者的表达谱相关性。
结果解读:
- NR组的FN1+TAMs得分显著高于R组(P<0.05,图6b);
- 单细胞数据显示,NR组髓系细胞的FN1+TAMs得分(P<0.01)及FN1表达(P<0.05)均高于R组(图6g-h);
- SubMap分析显示,低FN1+TAMs亚组对anti-PD1(P=0.033)、anti-CTLA4(P=0.021)治疗更敏感(图6j)。
实验所用关键产品:文献未提及具体实验产品,领域常规使用SubMap算法。
3.6 PRIMEG数据库构建
实验目的:构建原发性与复发性胶质瘤免疫微环境的单细胞数据库,促进领域研究。
方法细节:
1. 数据整合:整合BrainImmuneAtlas和Mei等研究的单细胞数据(共35例患者、~130,000个免疫细胞);
2. 批次校正:通过Harmony算法去除不同数据集的批次效应;
3. 可视化与功能开发:用Seurat和SCP包进行细胞聚类与可视化,通过Shiny和Cirrocumulus构建在线平台。
结果解读:
PRIMEG数据库(http://www.szflab.site/PRIMEG/)提供“基因表达分析”“细胞亚群注释”“免疫微环境特征查询”等功能,是首个聚焦原发性与复发性胶质瘤免疫微环境的单细胞数据库(图7)。
实验所用关键产品:文献未提及具体实验产品,领域常规使用Harmony、Shiny等工具。
4. Biomarker研究及发现成果解析
Biomarker定位
本研究的核心Biomarker是FN1+肿瘤相关巨噬细胞(FN1+TAMs)——即高表达FN1的TAMs亚型。其筛选与验证逻辑为:
1. 筛选:通过CGGA数据库构建复发相关基因签名(RRS),结合BrainImmuneAtlas单细胞数据定位高RRS的TAMs亚型;
2. 鉴定:通过差异表达基因分析,确定该亚型高表达FN1;
3. 验证:多数据库(GLASS、CGGA、TCGA)+临床样本(华山医院8对配对样本、68例样本)验证其与复发、预后的关联;
4. 功能验证:空间转录组+免疫微环境分析,解析其生物学功能。
研究过程详述
- Biomarker来源:胶质瘤组织中的肿瘤相关巨噬细胞(TAMs);
- 验证方法:
- 蛋白水平:免疫组化检测FN1蛋白表达(CST抗体,货号26836);
- 细胞水平:单细胞测序分析FN1表达的细胞亚群;
- 临床水平:ssGSEA计算FN1+TAMs得分,关联复发间隔、总生存期、免疫治疗响应;
- 特异性与敏感性数据:
- 在GLASS队列中,FN1+TAMs得分与复发间隔的相关性为R=-0.4(P<0.01);
- 在1713例原发性胶质瘤患者中,高FN1+TAMs得分组的总生存期显著缩短(HR=1.5,95%CI 1.3-1.7,P<0.001);
- 在免疫治疗队列中,NR组的FN1+TAMs得分显著高于R组(P<0.05)。
核心成果提炼
- 预后价值:FN1+TAMs是胶质瘤复发的独立预后因素,其得分与复发间隔(R=-0.4,P<0.01)、总生存期(R=-0.38,P<0.01)负相关;
- 免疫治疗预测价值:低FN1+TAMs得分的胶质瘤患者对anti-PD1/CTLA4治疗更敏感(SubMap分析P=0.033/0.021);
- 创新性:首次揭示FN1+TAMs在胶质瘤复发中的关键作用,及其“缺氧微环境富集→免疫抑制→治疗耐药”的功能轴,为胶质瘤复发的精准干预提供了新靶点。
本研究通过多组学整合分析,系统性解析了FN1+TAMs在胶质瘤复发中的作用及临床价值,不仅填补了“复发相关TAMs亚型”的研究空白,也为胶质瘤的早期复发预测和免疫治疗精准选择提供了重要生物标志物。
