1. 领域背景与文献引入
文献英文标题:Single-cell and bulk RNA-seq unveils the immune infiltration landscape associated with cuproptosis in cerebral cavernous malformations;发表期刊:Biomarker Research;影响因子:未公开;研究领域:脑海绵状血管畸形(CCMs)发病机制、铜死亡与免疫浸润关联研究。
脑海绵状血管畸形(CCMs)是常见的神经血管畸形,以异常扩张的血管腔、反复出血及神经功能缺损为特征,分为散发性(单病灶)和家族性(多病灶),其发病与CCM1/2/3基因变异相关,但具体机制未完全阐明。目前CCMs缺乏有效的药物治疗,亟需揭示新的发病机制及治疗靶点。铜死亡是2022年发现的新型细胞死亡方式,由铜离子过载导致线粒体脂酰化TCA循环蛋白聚集,依赖FDX1、LIAS等关键基因,已在癌症、心血管疾病中被报道,但CCMs中铜死亡的作用尚未明确。同时,免疫浸润(如巨噬细胞、T细胞)是CCMs病变进展的重要驱动因素,但铜死亡与免疫浸润的相互作用未被系统解析。现有研究未揭示CCMs中铜死亡相关的免疫浸润景观,缺乏关键调控基因的鉴定,因此本研究旨在填补这一空白,为CCMs的诊断和治疗提供新见解。
2. 文献综述解析
文献综述围绕CCMs发病机制、铜死亡研究现状、免疫浸润在CCMs中的作用三大核心展开评述。作者首先总结CCMs是神经血管畸形,病因涉及CCM1/2/3基因功能缺失,但血管异常扩张的具体机制未明;接着介绍铜死亡是新型细胞死亡方式,核心机制为铜离子过载导致线粒体脂酰化蛋白聚集,关键调控基因包括FDX1(促铜死亡)、GLS(抑铜死亡)等;随后指出免疫浸润在CCMs中普遍存在,巨噬细胞、T细胞等免疫细胞通过分泌细胞因子参与病变进展,但铜死亡与免疫浸润的关联尚未报道。
现有研究的关键结论为:① CCMs是多基因参与的神经血管畸形;② 铜死亡是依赖线粒体代谢的新型细胞死亡;③ 免疫浸润促进CCMs病变进展。局限性在于:① 未揭示CCMs中铜死亡与免疫浸润的相互作用;② 缺乏从bulk到单细胞水平的系统分析;③ 未鉴定调控铜死亡与免疫浸润的关键基因。
本研究的创新点在于:首次结合bulk和单细胞RNA-seq技术,解析CCMs中铜死亡相关的免疫浸润景观;通过机器学习筛选出3个 hub 基因(BTBD10、PFDN4、CEMIP);并通过实验验证其在血管内皮细胞(EC)中的表达及与M2巨噬细胞的通讯机制,为CCMs发病机制提供了“铜死亡-免疫浸润-血管异常”的新框架。
3. 研究思路总结与详细解析
本研究以“揭示CCMs中铜死亡相关的免疫浸润景观及关键调控基因”为目标,围绕“铜死亡如何通过免疫浸润调控CCMs发病”的核心科学问题,采用“bulk RNA-seq分亚型→差异基因与免疫浸润分析→机器学习筛hub基因→实验验证→单细胞解析细胞通讯”的闭环技术路线,系统解析了CCMs中铜死亡与免疫浸润的关联及分子机制。
3.1 bulk RNA-seq 数据整合与共识聚类
实验目的:基于铜死亡相关基因(CRGs)表达对CCMs进行亚型分类,明确不同亚型的分子特征。
方法细节:整合GSE130174(10个CCMs样本、3个对照)与GSE123968(5个CCMs样本、3个对照)数据集,使用“sva”包去除批次效应;通过“ConsensusClusterPlus”包进行共识聚类(50次迭代,每次随机选取80%样本),基于CRGs表达水平分层。
结果解读:将CCMs分为2个亚型(Cluster 1、Cluster 2),Cluster 1高表达促铜死亡基因(如FDX1、LIAS),Cluster 2高表达抑铜死亡基因(如GLS、PDHA1);一致性矩阵显示亚型分类稳定(一致性得分>0.8)。
产品关联:文献未提及具体实验产品,领域常规使用R语言“sva”“ConsensusClusterPlus”包进行数据整合与聚类。
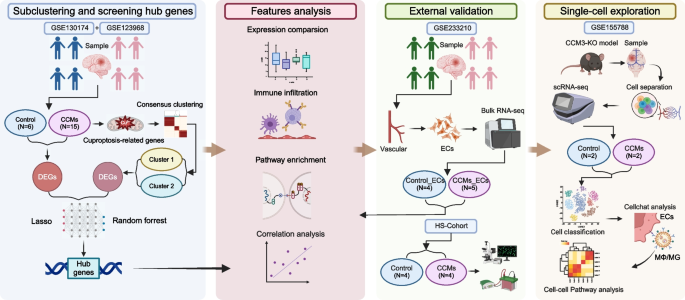
3.2 差异基因与免疫浸润分析
实验目的:分析CCMs与对照、不同亚型间的差异基因,探讨免疫浸润特征。
方法细节:使用“Limma”包鉴定差异表达基因(DEGs,筛选条件:P<0.05且|log2FC|>1);通过Metascape进行GO富集分析;采用单样本基因集富集分析(ssGSEA)与CIBERSORT算法评估免疫细胞浸润水平。
结果解读:CCMs与对照间共鉴定2963个DEGs(1169个上调、1794个下调),上调DEGs富集于“免疫反应”“血管生成”等通路;Cluster 2的免疫浸润水平显著高于Cluster 1(如M2巨噬细胞、B细胞,P<0.05),提示免疫浸润与铜死亡亚型相关。
产品关联:文献未提及具体实验产品,领域常规使用“Limma”包进行差异分析,Metascape平台进行GO富集,ssGSEA与CIBERSORT进行免疫浸润分析。
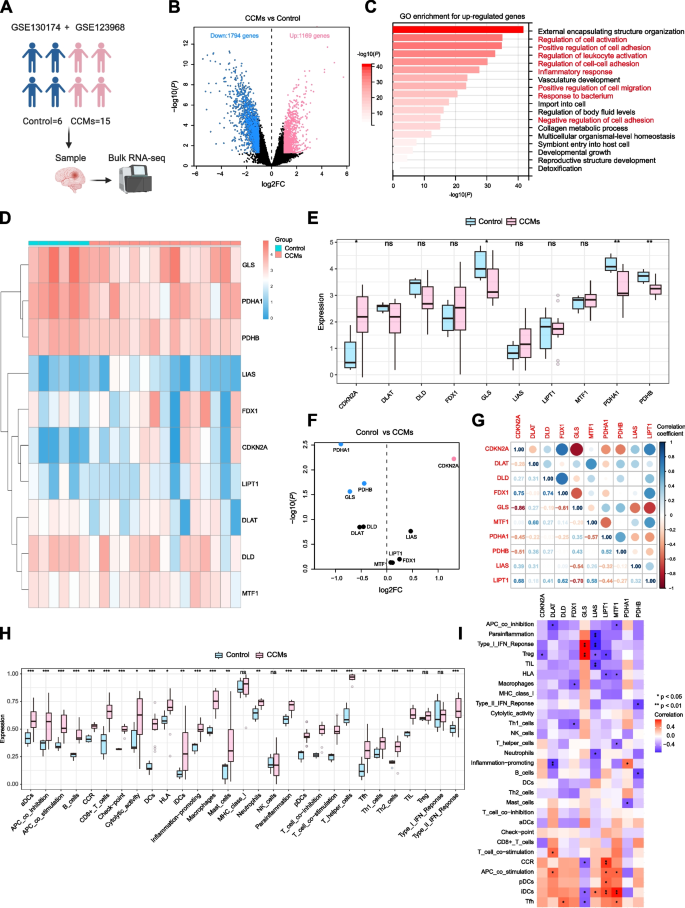
3.3 机器学习筛选 hub 基因
实验目的:筛选调控CCMs中铜死亡与免疫浸润的关键基因。
方法细节:取“Cluster 1 vs Cluster 2”与“CCMs vs 对照”的DEGs交集(273个基因)作为候选;通过“glmnet”包进行LASSO回归(筛选14个特征基因),“randomForest”包进行随机森林分析(筛选10个特征基因);取两者交集得到hub基因。
结果解读:筛选出3个 hub 基因(BTBD10、PFDN4、CEMIP):BTBD10与PFDN4在Cluster 1高表达,CEMIP在Cluster 2高表达;3个基因在CCMs中均显著高表达(P<0.05),且与CCMs致病基因(如DLL4、TGFB1)强相关(BTBD10与DLL4正相关,r=0.887,P<0.001)。
产品关联:文献未提及具体实验产品,领域常规使用“glmnet”“randomForest”包进行机器学习分析。
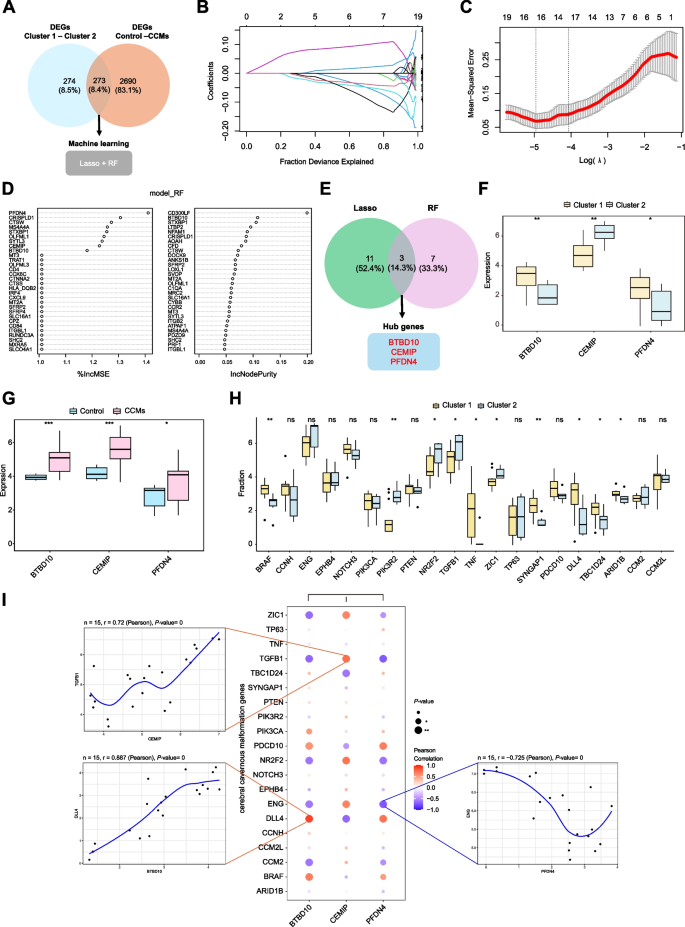
3.4 外部数据集与实验验证
实验目的:验证hub基因的表达及细胞定位。
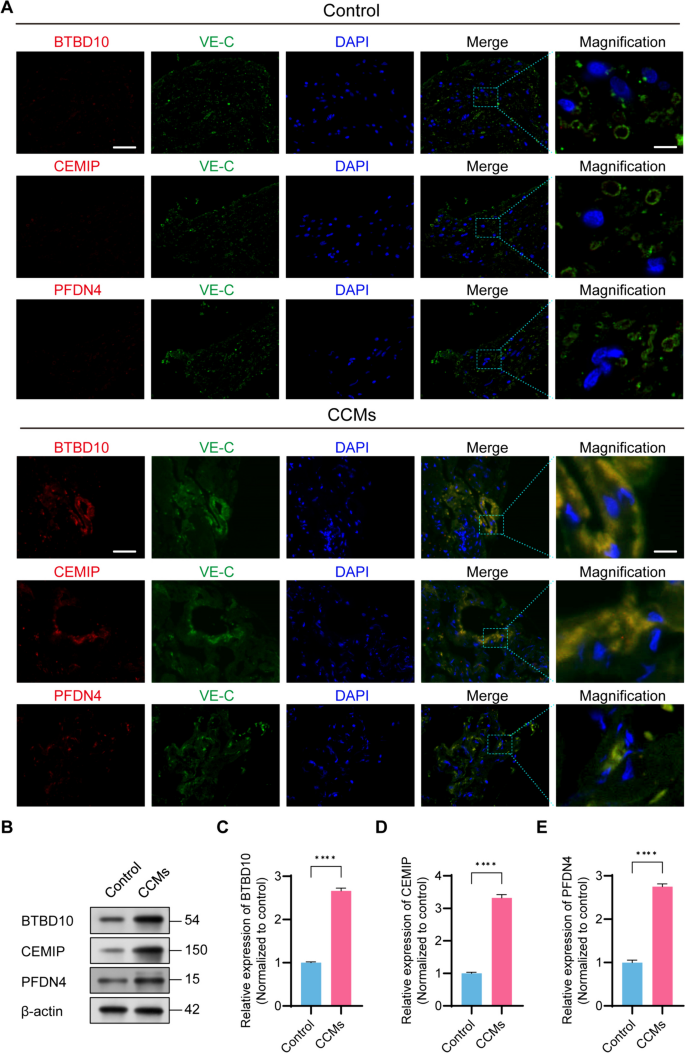
方法细节:使用外部EC数据集GSE233210(5个CCMs EC、4个对照EC)验证基因表达;通过免疫荧光染色(共定位hub基因与VE-cadherin,EC标志物)、Western blot(4个CCMs、4个对照样本)验证蛋白水平。
结果解读:外部数据集显示3个基因在CCMs EC中显著高表达(P<0.05);免疫荧光显示BTBD10、PFDN4、CEMIP与VE-cadherin共定位(共定位率>80%,P<0.01);Western blot显示CCMs中3个基因的蛋白水平是对照的2.5-3.2倍(P<0.01)。
产品关联:免疫荧光所用关键产品:BTBD10抗体(Santa Cruz Biotechnology,sc-377183)、VE-cadherin抗体(Thermo Fisher Scientific,14-1441-82)、CEMIP抗体(Affinity Biosciences,DF12056)、PFDN4抗体(ProteinTech,16045-1-AP);Western blot所用关键产品:β-actin抗体(Abcam,ab8226)、ECL发光试剂(未提及品牌)。
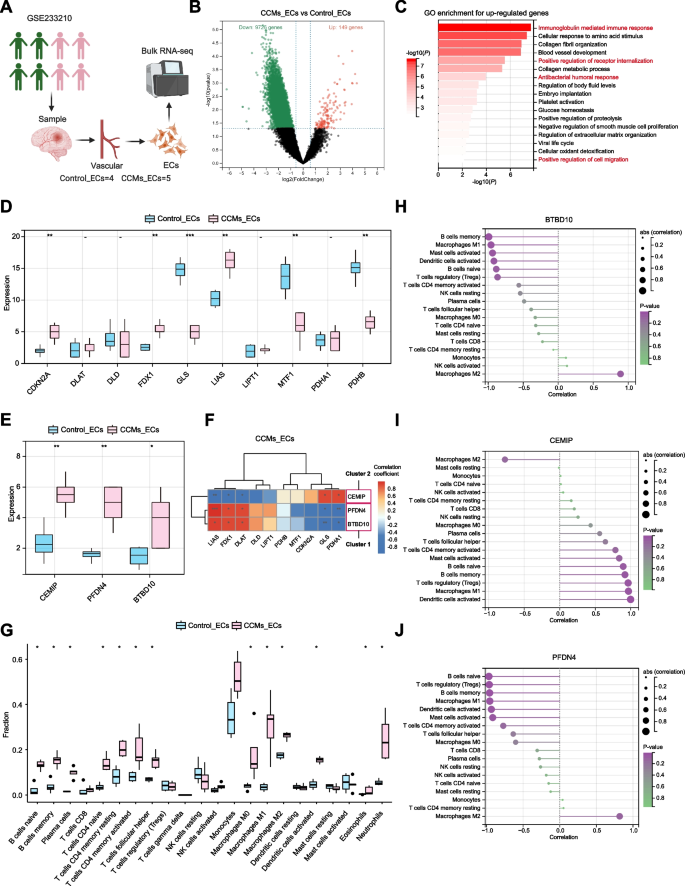
3.5 单细胞 RNA-seq 解析细胞通讯
实验目的:解析hub基因参与的细胞间通讯机制。
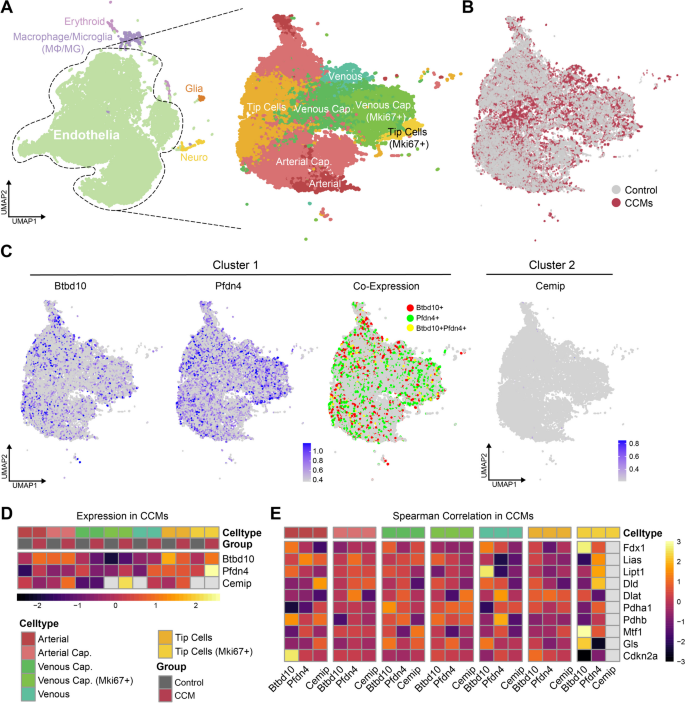
方法细节:使用GSE155788单细胞数据集(2个CCM3WT、2个CCM3KO小鼠,共28601个细胞),通过Seurat包整合分析,鉴定细胞亚群(EC、巨噬细胞等);使用CellChat包解析细胞通讯,重点分析EC与免疫细胞的相互作用。
结果解读:BTBD10与PFDN4在EC(尤其是Mki67+尖端细胞)高表达,与铜死亡关键基因FDX1共定位(r=0.65,P<0.001);EC与M2巨噬细胞的通讯增强,主要通过Ptn-Ncl、Fn1-Itga4/Itgb1通路,且BTBD10高表达的EC与M2巨噬细胞的通讯强度更高。
产品关联:文献未提及具体实验产品,领域常规使用Seurat包进行单细胞整合,CellChat包解析细胞通讯。

4. Biomarker 研究及发现成果解析
Biomarker 定位与筛选逻辑
本研究鉴定的BTBD10、PFDN4、CEMIP是CCMs中与铜死亡相关的潜在Biomarker。筛选逻辑为:① bulk RNA-seq共识聚类分亚型,筛选差异基因;② 机器学习(LASSO+随机森林)缩小范围;③ 外部EC数据集验证表达差异;④ 实验(免疫荧光、Western blot)验证蛋白水平与细胞定位,形成“多组学筛选→多层面验证”的完整链。
研究过程详述
- Biomarker 来源:CCMs患者的组织样本与EC样本。
- 验证方法:① bulk RNA-seq(表达差异);② 外部EC数据集(独立验证);③ 免疫荧光(细胞定位);④ Western blot(蛋白水平);⑤ 单细胞RNA-seq(细胞表达模式)。
- 特异性与敏感性:3个基因在CCMs中显著高表达(如BTBD10在CCMs中的表达量是对照的2.5倍,P<0.01),且与EC标志物共定位(共定位率>80%),显示较好的组织与细胞特异性;文献未提供ROC曲线的敏感性数据。
核心成果提炼
3个 hub 基因与CCMs发病机制密切相关:
- BTBD10与PFDN4:主要表达于EC(尤其是Mki67+尖端细胞),通过与M2巨噬细胞通讯(Ptn-Ncl通路)调控铜死亡,促进血管生成(与DLL4正相关,r=0.887,P<0.001)。
- CEMIP:主要表达于Cluster 2,与炎症通路(IL6/JAK/STAT3)相关,促进纤维化(与TGFB1正相关,r=0.75,P<0.001)。
创新性:首次在CCMs中鉴定出铜死亡相关Biomarker,解析了其与免疫浸润的相互作用机制。
统计学结果:BTBD10与VE-cadherin共定位率85%(n=4,P<0.01);Western blot显示BTBD10蛋白水平在CCMs中是对照的3.2倍(n=4,P<0.01);PFDN4与ENG(内皮迁移基因)负相关(r=-0.725,P<0.001)。
本研究为CCMs的诊断提供了新型Biomarker,为治疗提供了“铜死亡调控+免疫干预”的新策略,未来需进一步验证其临床转化价值。
