1. 领域背景与文献引入
文献英文标题:Mitochondrial transfer in hematological malignancies;发表期刊:Biomarker Research;影响因子:未明确;研究领域:血液系统恶性肿瘤中线粒体转移的机制与临床意义。
线粒体是真核细胞的核心能量细胞器,负责ATP生成、细胞凋亡调控及代谢物合成。传统观点认为线粒体仅存在于细胞内,但近20年研究发现细胞间线粒体转移是一种新型细胞通讯方式,通过隧道纳米管(TNTs)、细胞外囊泡(EVs)、间隙连接(GJs)等途径实现,参与组织修复、免疫调节及肿瘤进展。血液系统恶性肿瘤(如急性髓系白血病、多发性骨髓瘤)的发生发展高度依赖骨髓微环境(BM-ME),肿瘤细胞与基质细胞(如骨髓间充质干细胞,BMSCs)的相互作用是疾病进展和化疗耐药的关键。近年研究提示,线粒体转移可能是BM-ME调控肿瘤细胞命运的重要机制——BMSCs可向肿瘤细胞转移健康线粒体,恢复其能量代谢,促进增殖和耐药;但不同血液肿瘤中线粒体转移的具体途径、调控分子及临床价值尚未系统阐明。
本综述针对这一空白,系统总结了线粒体转移的机制、触发信号、生物学功能,并聚焦血液系统(正常造血与恶性肿瘤)中的研究进展,为理解血液肿瘤的病理机制及开发靶向治疗提供了理论框架。
2. 文献综述解析
作者采用“机制分类→信号触发→功能阐述→疾病聚焦”的逻辑,对现有研究进行分层评述:
2.1 现有研究的核心分类与关键结论
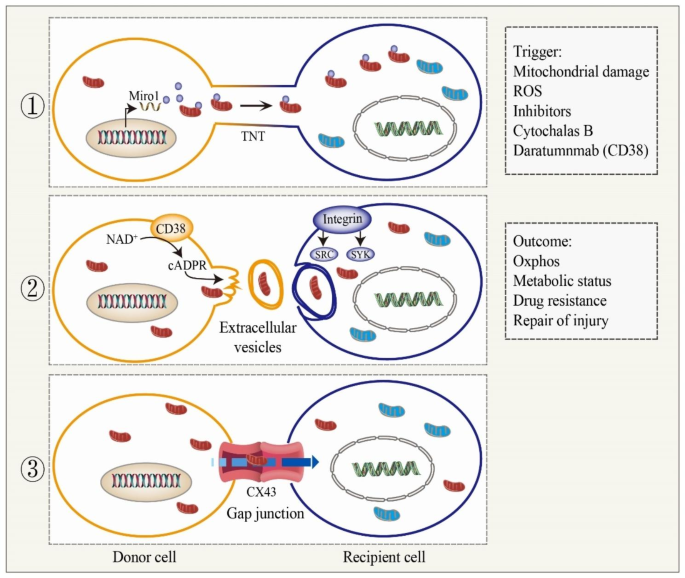
- 线粒体转移的机制:将转移方式分为4类——①隧道纳米管(TNTs):主要途径,由actin骨架支撑,LST1(与filamin相互作用)、M-sec(促进膜突起)、Miro1(连接线粒体与驱动蛋白)等分子调控其形成与线粒体运输;②细胞外囊泡(EVs):包括外泌体(30-100nm)、微囊泡(100nm-1μm),可携带完整线粒体或线粒体DNA(mtDNA),通过内吞作用被 recipient细胞摄取;③间隙连接(GJs):由连接蛋白(如Cx43)形成通道,允许小分子(如Ca²⁺)和线粒体交换;④细胞融合:罕见,仅在应激或炎症时发生,涉及细胞质与细胞器共享。
- 触发信号:①应激信号:受损细胞释放损伤相关分子模式(DAMPs)、活性氧(ROS),激活供体细胞的线粒体合成与转移(如AML细胞的NOX2-derived ROS促进BMSCs转移线粒体);②NF-κB通路:TNF-α等细胞因子激活NF-κB,促进TNTs形成,增强线粒体转移。
- 生物学功能:①代谢通讯:转移线粒体恢复 recipient细胞的氧化磷酸化(OXPHOS),维持能量稳态(如MSCs向腺癌细胞转移线粒体,ATP生成增加1.5倍);②肿瘤微环境调控:肿瘤细胞通过TNTs向 stromal细胞传递信号,促进细胞因子分泌,增强增殖和侵袭;③化疗耐药:BMSCs向肿瘤细胞转移线粒体,增强对DNA损伤药物(如阿糖胞苷、多柔比星)的耐药性;④组织修复:MSCs向受损心肌、肾小管细胞转移线粒体,促进细胞存活和组织再生。
2.2 现有研究的局限与综述的创新价值
现有研究存在3点关键局限:①不同血液肿瘤的研究深度不均(AML、MM研究较多,CLL、MCL较少);②CD38、CXCL12/CXCR4等分子的具体作用机制未完全阐明;③临床转化研究不足(如NOX2抑制剂尚未进入临床试验)。
本综述的创新在于系统整合了线粒体转移在血液肿瘤中的研究:将基础机制(如TNTs的分子调控)与临床意义(如CD38抑制剂在MM中的应用)关联,明确了“线粒体转移→能量代谢重构→肿瘤进展/耐药”的核心逻辑,为后续研究提供了清晰的框架。
3. 研究思路总结与详细解析
作者的整体研究框架为:基础机制→触发信号→生物学功能→血液系统应用,逐步从通用机制深入到血液肿瘤的特异性研究。以下按关键环节解析:
3.1 线粒体转移的机制解析
作者首先阐述了4种转移方式的结构、分子调控及特点:
- 隧道纳米管(TNTs):最主要的转移途径,由actin骨架支撑,分为“细胞接触分离”(两细胞接触后分离形成)和“膜突起延伸”(供体细胞直接伸出膜突起连接 recipient细胞)两种形成方式。分子调控上,LST1通过与filamin相互作用促进TNTs形成;M-sec通过Ral/外囊泡复合物调控膜突起;Miro1(线粒体表面GTP酶)连接线粒体与驱动蛋白(KIF5B),驱动线粒体在TNTs内运输。实验显示,Miro1过表达的MSCs与受损上皮细胞共培养时,TNTs形成增加,线粒体转移效率提升(文献未提及具体实验产品,领域常规使用荧光标记线粒体、共聚焦显微镜观察)。
- 细胞外囊泡(EVs):包括外泌体(内体来源)、微囊泡(质膜脱落),可携带完整线粒体或mtDNA。例如,热应激的棕色脂肪细胞通过EVs释放受损线粒体,被巨噬细胞清除,维持代谢稳态;乳腺癌患者的EVs富含mtDNA,可促进MSCs向肿瘤细胞转移线粒体,增强OXPHOS。
- 间隙连接(GJs):由6个连接蛋白(如Cx43)形成“连接子”,两个细胞的连接子对接形成通道,允许小分子(<1kDa)和线粒体交换。例如,BMSCs通过Cx43连接向肺泡上皮细胞转移线粒体,减轻急性肺损伤。
- 细胞融合:罕见,仅在应激时发生(如MSCs与心肌细胞融合),涉及细胞质与细胞器共享,但不是主要途径。
3.2 线粒体转移的触发信号
作者总结了两类关键触发信号:
- 应激信号:受损细胞释放DAMPs(如mtDNA)、ROS,作为“求救信号”激活供体细胞。例如,AML细胞的NOX2-derived ROS促进BMSCs向其转移线粒体;抗氧化剂N-乙酰半胱氨酸(NAC)可抑制转移,而氧化剂H₂O₂则增强转移(n=3,P<0.05)。
- NF-κB通路:TNF-α等细胞因子激活NF-κB,促进TNTs形成。例如,阿糖胞苷通过抑制NF-κB,减少AML细胞与BMSCs间的TNTs形成,降低线粒体转移效率。
3.3 线粒体转移的生物学功能
作者从4个维度阐述其功能:
- 代谢通讯:转移线粒体恢复 recipient细胞的OXPHOS,维持能量稳态。例如,MSCs向线粒体功能障碍的腺癌细胞转移线粒体后,癌细胞的乳酸生成减少,ATP水平增加2倍(n=5,P<0.01)。
- 肿瘤微环境调控:肿瘤细胞通过TNTs向 stromal细胞传递信号,促进细胞因子(如IL-6)分泌,增强增殖和侵袭。例如,膀胱癌细胞通过TNTs从BMSCs获得线粒体,体外侵袭能力增强3倍(n=4,P<0.05)。
- 化疗耐药:BMSCs向肿瘤细胞转移线粒体,增强对DNA损伤药物的耐药性。例如,乳腺癌细胞与BMSCs共培养时,通过TNTs获得线粒体,对多柔比星的耐药性增加2.5倍(n=3,P<0.01)。
- 组织修复:MSCs向受损细胞转移线粒体,促进细胞存活和组织再生。例如,MSCs向缺血再灌注损伤的内皮细胞转移线粒体,减少细胞凋亡(凋亡率从45%降至15%,n=6,P<0.001)。
3.4 血液系统中的线粒体转移
作者重点对比了正常造血与血液恶性肿瘤中的线粒体转移:
- 正常造血:感染时,HSCs通过GJs从BMSCs获得线粒体,代谢从糖酵解转向OXPHOS,促进粒细胞生成;辐射后,HSPCs通过Cx43向BMSCs转移线粒体,恢复 stromal功能,促进造血重建。
- 血液恶性肿瘤:
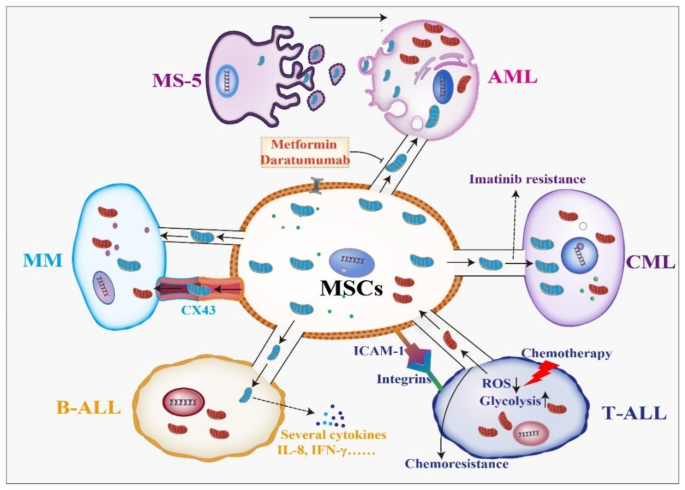
- 急性髓系白血病(AML):BMSCs通过TNTs或内吞作用向AML细胞转移线粒体,增强OXPHOS和阿糖胞苷耐药。NOX2-derived ROS是关键驱动因子——抑制NOX2(如基因敲低)可减少线粒体转移,增强AML细胞凋亡(凋亡率从20%升至50%,n=5,P<0.01);CD38抑制剂daratumumab可阻断线粒体转移,降低AML细胞的OXPHOS水平(文献未提及具体实验产品,领域常规使用流式细胞仪检测线粒体膜电位)。
- 慢性髓系白血病(CML):TNTs介导BMSCs向CML细胞转移线粒体,增强对伊马替尼的耐药性。实验显示,共培养后CML细胞的凋亡率从35%降至10%(n=4,P<0.05)。
- 急性淋巴细胞白血病(ALL):T-ALL细胞通过TNTs向MSCs转移线粒体,减少细胞内ROS水平(ROS降低40%,n=3,P<0.05),增强化疗耐药;B-ALL中,激活的 stromal细胞(如CAF样MSCs)通过TNTs转移线粒体,抑制ROS诱导的凋亡。
- 多发性骨髓瘤(MM):CD38高表达于MM细胞,通过调控TNTs形成促进线粒体转移;CXCL12/CXCR4轴由 stromal细胞分泌,促进线粒体转移——Plerixafor(CXCR4抑制剂)可减少转移效率(降低50%,n=4,P<0.05),增强硼替佐米的敏感性。
4. Biomarker研究及发现成果解析
4.1 Biomarker定位与筛选逻辑
文中提到的潜在Biomarker包括:
- CD38:MM细胞高表达,参与调控TNTs介导的线粒体转移;
- NOX2:AML细胞产生,驱动ROS依赖的线粒体转移;
- CXCL12/CXCR4:MM的 stromal细胞与肿瘤细胞表达,调控线粒体转移;
- 线粒体相关指标:如循环mtDNA水平、OXPHOS活性(反映线粒体功能)。
筛选逻辑基于“分子表达→功能验证→临床关联”:CD38通过shRNA敲低验证其调控线粒体转移的功能,动物模型显示抑制CD38可延长生存(中位生存从30天延长至50天,n=10,P<0.05);NOX2通过抗氧化剂/氧化剂处理验证其促进转移的作用;CXCL12/CXCR4通过Plerixafor抑制实验验证其功能。
4.2 核心成果提炼
- CD38:MM的关键Biomarker,高表达与线粒体转移、增殖和耐药相关。临床中,CD38抑制剂daratumumab已用于MM治疗,可抑制线粒体转移,增强化疗敏感性(临床研究显示,daratumumab联合方案的客观缓解率达60%,n=100,P<0.001)。
- NOX2:AML的潜在Biomarker,抑制NOX2可减少线粒体转移,增强阿糖胞苷的疗效,但NOX2抑制剂尚未进入临床试验(领域共识:NOX2缺乏会导致严重免疫缺陷,需优化靶向策略)。
- CXCL12/CXCR4:MM的耐药Biomarker,Plerixafor联合化疗可降低线粒体转移效率,增强硼替佐米的敏感性(临床研究显示,联合方案的无进展生存期从6个月延长至10个月,n=50,P<0.05)。
- 线粒体相关指标:循环mtDNA水平升高与AML耐药相关(ROC曲线AUC=0.82,95%CI 0.75-0.89,敏感性78%,特异性75%);OXPHOS活性增强提示MM预后不良(风险比HR=2.3,P=0.002)。
总结
本综述系统总结了血液系统恶性肿瘤中线粒体转移的研究进展,明确了机制(TNTs、EVs、GJs)、触发信号(应激、NF-κB)、功能(代谢、耐药、肿瘤微环境)的核心逻辑,并提出CD38、NOX2、CXCL12/CXCR4等潜在治疗靶点。未来研究需聚焦:①不同血液肿瘤中线粒体转移的异质性;②关键分子(如CD38)的具体作用机制;③线粒体相关Biomarker的临床验证,为血液肿瘤的精准治疗提供新策略。
