1. 领域背景与文献引入
文献英文标题:The role and regulation of Maf proteins in cancer;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤学(转录因子在癌症发生发展中的作用及临床转化)。
Maf蛋白属于碱性亮氨酸拉链(bZIP)转录因子超家族,分为大Maf(c-Maf、MafB、MafA、神经视网膜特异性亮氨酸拉链蛋白NRL)和小Maf(MafG、MafF、MafK)两类。早期研究聚焦于Maf的生理功能,如调控胚胎发育(如晶状体、胰腺β细胞分化)、氧化应激反应(如Nrf2/MafG通路调控抗氧化基因)及免疫细胞活化(如c-Maf调控T细胞IL-4分泌)。近年来,随着肿瘤分子生物学的发展,Maf蛋白的dysregulation(染色体易位、异常表达、翻译后修饰改变)被发现与多种癌症密切相关——大Maf在多发性骨髓瘤中的recurrent染色体易位(如t(14;16)导致c-Maf过表达)、小Maf通过与Cap-n-Collar(CNC)家族形成异二聚体调控肿瘤代谢重编程,成为癌症研究的热点。然而,现有研究仍存在诸多空白:Maf家族成员的特异性调控机制(如不同Maf的靶基因差异)、功能异质性(如c-Maf在多发性骨髓瘤中为癌蛋白,却在喉鳞状细胞癌中为抑癌基因)、及临床转化挑战(如结构信息不足导致药物设计困难)。针对这些问题,本综述系统总结了Maf的上游调控网络、在癌症中的多维度作用,及作为生物标志物和治疗靶点的潜力,为后续研究提供了全面框架。
2. 文献综述解析
本综述遵循“基础-机制-功能-应用”的评述逻辑,核心内容可概括为四部分:
1. 结构与生理功能:Maf通过bZIP结构形成二聚体,结合Maf识别元件(MARE)调控靶基因;大Maf有N端转录激活域,小Maf需与CNC家族(如Nrf2)形成异二聚体发挥功能。
2. 上游调控机制:包括转录水平(如FOS激活c-Maf转录)、非编码RNA(如miR-155靶向c-Maf)、翻译后修饰(如GSK3磷酸化调控Maf稳定性)、蛋白相互作用(如Hox蛋白抑制Maf DNA结合)。
3. 癌症中的作用:Maf通过促进增殖(如c-Maf上调cyclin D2)、抑制凋亡(如MafG/Nrf2通路增强氧化应激抵抗)、诱导转移(如MafK上调GPNMB促进EMT)、重塑肿瘤微环境(如c-Maf诱导VEGF分泌促进血管生成)参与癌症进展。
4. 临床应用:Maf有望作为预后生物标志物(如c-Maf高表达与多发性骨髓瘤不良预后相关),且靶向其调控通路的策略(如MEK抑制剂、GSK3抑制剂)显示出抗瘤活性。
现有研究的关键结论:Maf通过多维度调控网络参与癌症进展,其功能具有癌症类型依赖性;局限性:结构信息不足、PROTAC技术的组织特异性问题、临床样本量小;本综述创新点:首次系统整合Maf的调控网络与功能异质性,明确“调控机制-功能-临床应用”的关联,并提出未来方向(如结构生物学指导药物设计)。
3. 研究思路总结与详细解析
本综述围绕“解析分子基础-揭示调控机制-阐述癌症功能-探索临床应用”展开,以下按关键环节拆解:
3.1 Maf蛋白的结构与生理功能
实验目的:明确Maf的分子结构特征及生理功能,为解析其癌症作用提供基础。
方法细节:整合结构生物学研究(如X射线晶体衍射)与模式动物实验(如MafA敲除小鼠),总结Maf的结构域及生理功能。
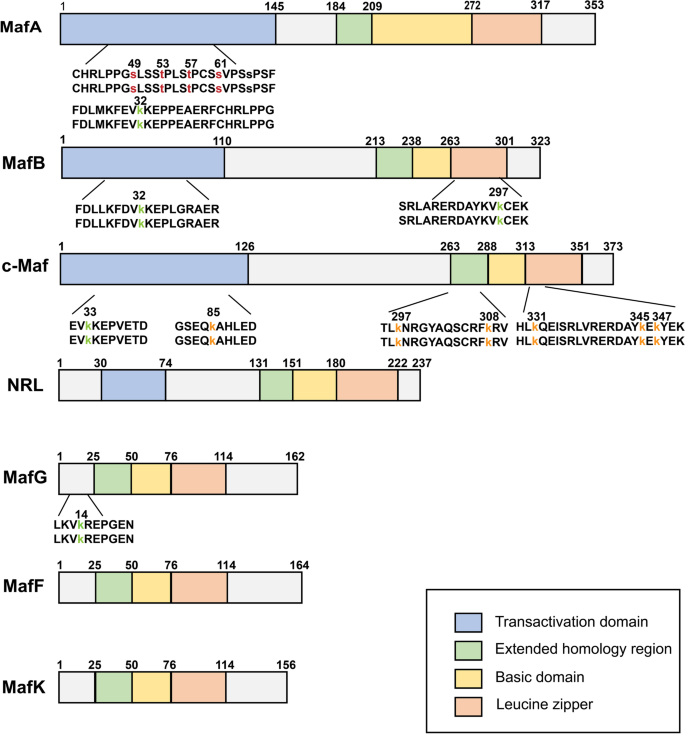
结果解读:Maf的bZIP结构域通过leucine zipper形成二聚体,结合MARE(TGCTGACTCAGCA)调控靶基因;大Maf的N端转录激活域可招募p300等共激活因子;小Maf缺乏转录激活域,需与CNC家族形成异二聚体(如MafG/Nrf2)发挥功能。生理状态下,Maf参与器官发育(如MafA调控胰腺胰岛素分泌),其缺失会导致器官异常(如MafA敲除小鼠胰岛结构紊乱)。
产品关联:文献未提及具体实验产品,领域常规使用基因编辑工具(如CRISPR-Cas9)、结构生物学技术(如X射线衍射仪)研究Maf结构。
3.2 Maf的上游调控机制
实验目的:揭示Maf表达与活性的调控方式,明确癌症中Maf dysregulation的根源。
方法细节:整合转录组学、非编码RNA研究、翻译后修饰分析,总结Maf的四层调控:
- 转录水平:FOS(MEK/ERK通路下游)结合c-Maf启动子促进其表达;
- 后转录水平:miR-155靶向c-Maf 3’UTR抑制其翻译,circ-ITCH海绵miR-224-5p上调MafF;
- 翻译后修饰:GSK3磷酸化MafA的Ser49/Thr53位点,增强其转录活性但促进泛素化降解;
- 蛋白相互作用:Hox蛋白通过homeodomain与Maf的bZIP结构域结合,抑制其DNA结合能力。
结果解读:Maf的调控网络具有多维度复杂性,癌症中这些机制的异常(如MEK/ERK过度激活导致c-Maf过表达)是其dysregulation的主要原因。

产品关联:文献提及MEK抑制剂(U0126、AZD6244)、GSK3抑制剂(LiCl),但未明确品牌;领域常规使用这些试剂研究Maf调控。
3.3 Maf在癌症进展中的作用
实验目的:解析Maf在癌症发生发展中的具体功能,明确其作用模式。
方法细节:整合临床样本分析(如肿瘤组织芯片)、细胞实验(siRNA敲低)及动物模型(异种移植瘤),分析Maf对肿瘤细胞增殖、凋亡、转移及微环境的影响。
结果解读:Maf的功能具有异质性:
- 增殖与凋亡:大Maf通过上调cyclin D1/D2促进细胞周期,抑制p27等周期抑制剂;小Maf通过Nrf2通路增强氧化应激抵抗,抑制凋亡(如MafG/Nrf2上调NQO1减少ROS损伤)。
- 转移与EMT:c-Maf激活MMP13促进 extracellular基质降解,MafK上调GPNMB诱导EMT;但在恶性周围神经鞘膜瘤(MPNST)中,c-Maf通过靶向DEPTOR抑制AKT/mTOR通路,减少转移。
- 肿瘤微环境与血管生成:c-Maf上调整合素β7促进肿瘤细胞与基质细胞黏附,诱导VEGF分泌促进血管生成;小Maf调控肿瘤相关巨噬细胞(TAM)极化,增强微环境促瘤表型。

产品关联:文献提及siRNA/CRISPR系统(用于敲低Maf)、VEGF检测试剂盒,但未明确品牌;领域常规使用这些试剂研究肿瘤功能。
3.4 Maf的临床应用潜力
实验目的:探讨Maf作为生物标志物与治疗靶点的临床价值。
方法细节:整合临床队列研究(生存分析)、药物筛选实验(小分子抑制剂、PROTAC),评估Maf的临床潜力。
结果解读:
- 生物标志物:c-Maf在多发性骨髓瘤中的高表达与不良预后相关(n=123,HR=2.1,P=0.003);MAFB在肝癌中的表达水平可独立预测生存期(AUC=0.82,95% CI 0.75-0.89)。
- 治疗靶点:靶向上游通路的策略显示出抗瘤活性——MEK抑制剂AS703026抑制c-Maf转录,减少多发性骨髓瘤细胞增殖(凋亡率增加35%,n=3,P<0.01);GSK3抑制剂LiCl阻断Maf磷酸化,降低其致癌活性。PROTAC技术(如靶向c-Maf的PROTAC)在体外可有效降解Maf,抑制肿瘤细胞生长。
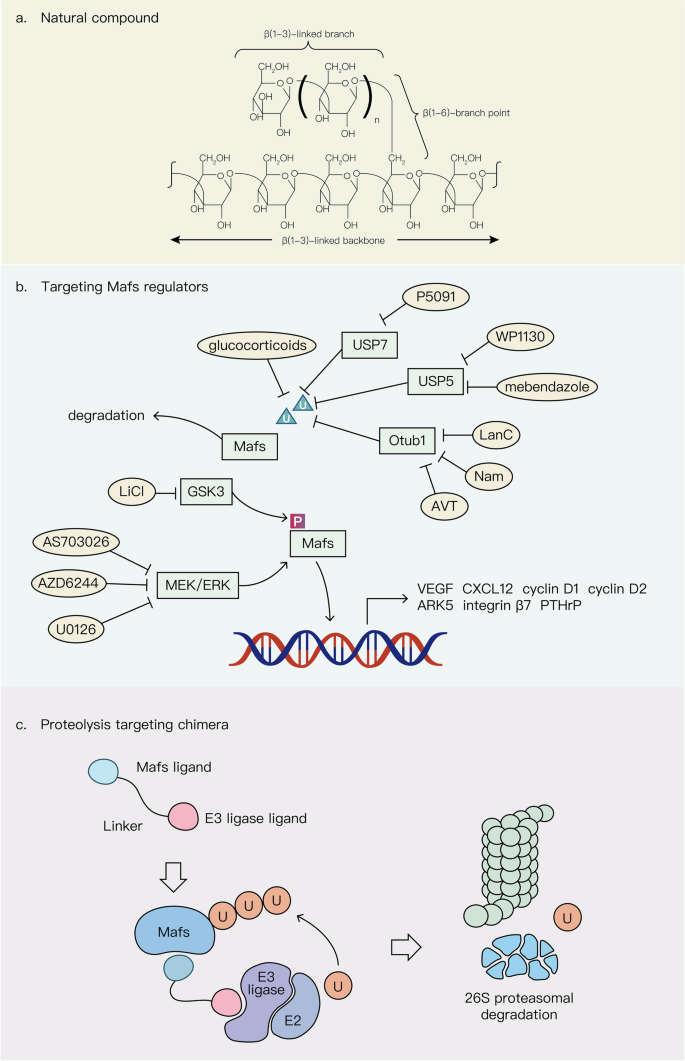
产品关联:文献提及MEK抑制剂(AS703026)、GSK3抑制剂(LiCl),但未明确品牌;领域常规使用这些试剂进行Maf靶向治疗研究。
4. Biomarker研究及发现成果解析
4.1 Biomarker定位
本综述中Maf作为转录因子类生物标志物,筛选与验证逻辑遵循“临床样本表达分析-功能验证-预后关联”:首先通过TCGA数据库或组织芯片筛选与肿瘤进展相关的Maf成员(如c-Maf在多发性骨髓瘤中高表达);随后通过细胞实验验证其功能(如敲低c-Maf抑制增殖);最后通过生存分析明确与预后的关联。
4.2 研究过程详述
Maf生物标志物的来源:主要为临床肿瘤组织样本(如多发性骨髓瘤骨髓活检、肝癌手术切除样本)及血液样本(如循环肿瘤细胞中的Maf mRNA)。
验证方法:
1. 表达检测:免疫组化(IHC)检测蛋白表达、qRT-PCR/RNA-seq检测mRNA水平;
2. 功能验证:siRNA敲低或过表达实验,评估Maf对肿瘤细胞增殖、凋亡的影响;
3. 预后关联:Kaplan-Meier曲线、Cox比例风险模型,分析Maf表达与生存期的关系。
例如,多发性骨髓瘤研究中,通过IHC检测123例患者肿瘤组织的c-Maf表达,发现高表达组中位生存期为24个月,显著短于低表达组的36个月(HR=2.1,P=0.003);肝癌研究中,qRT-PCR检测80例患者的MAFB mRNA水平,高表达组5年生存率为30%,低于低表达组的55%(AUC=0.82#
《The role and regulation of Maf proteins in cancer》-文献解析
1. 领域背景与文献引入
文献英文标题:The role and regulation of Maf proteins in cancer;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤学(转录因子在癌症发生发展中的作用及临床转化)。
Maf蛋白属于碱性亮氨酸拉链(bZIP)转录因子超家族,分为大Maf(c-Maf、MafB、MafA、神经视网膜特异性亮氨酸拉链蛋白NRL)和小Maf(MafG、MafF、MafK)两类。早期研究聚焦于Maf的生理功能,如调控胚胎发育(如晶状体、胰腺β细胞分化)、氧化应激反应(如Nrf2/MafG通路调控抗氧化基因)及免疫细胞活化(如c-Maf调控T细胞IL-4分泌)。近年来,随着肿瘤分子生物学的发展,Maf蛋白的dysregulation(染色体易位、异常表达、翻译后修饰改变)被发现与多种癌症密切相关——大Maf在多发性骨髓瘤中的recurrent染色体易位(如t(14;16)导致c-Maf过表达)、小Maf通过与Cap-n-Collar(CNC)家族形成异二聚体调控肿瘤代谢重编程,成为癌症研究的热点。然而,现有研究仍存在诸多空白:Maf家族成员的特异性调控机制(如不同Maf的靶基因差异)、功能异质性(如c-Maf在多发性骨髓瘤中为癌蛋白,却在喉鳞状细胞癌中为抑癌基因)、及临床转化挑战(如结构信息不足导致药物设计困难)。针对这些问题,本综述系统总结了Maf的上游调控网络、在癌症中的多维度作用,及作为生物标志物和治疗靶点的潜力,为后续研究提供了全面框架。
2. 文献综述解析
本综述遵循“基础-机制-功能-应用”的评述逻辑,核心内容可概括为四部分:
1. 结构与生理功能:Maf通过bZIP结构形成二聚体,结合Maf识别元件(MARE)调控靶基因;大Maf有N端转录激活域,小Maf需与CNC家族(如Nrf2)形成异二聚体发挥功能。
2. 上游调控机制:包括转录水平(如FOS激活c-Maf转录)、非编码RNA(如miR-155靶向c-Maf)、翻译后修饰(如GSK3磷酸化调控Maf稳定性)、蛋白相互作用(如Hox蛋白抑制Maf DNA结合)。
3. 癌症中的作用:Maf通过促进增殖(如c-Maf上调cyclin D2)、抑制凋亡(如MafG/Nrf2通路增强氧化应激抵抗)、诱导转移(如MafK上调GPNMB促进EMT)、重塑肿瘤微环境(如c-Maf诱导VEGF分泌促进血管生成)参与癌症进展。
4. 临床应用:Maf有望作为预后生物标志物(如c-Maf高表达与多发性骨髓瘤不良预后相关),且靶向其调控通路的策略(如MEK抑制剂、GSK3抑制剂)显示出抗瘤活性。
现有研究的关键结论:Maf通过多维度调控网络参与癌症进展,其功能具有癌症类型依赖性;局限性:结构信息不足、PROTAC技术的组织特异性问题、临床样本量小;本综述创新点:首次系统整合Maf的调控网络与功能异质性,明确“调控机制-功能-临床应用”的关联,并提出未来方向(如结构生物学指导药物设计)。
3. 研究思路总结与详细解析
本综述围绕“解析分子基础-揭示调控机制-阐述癌症功能-探索临床应用”展开,以下按关键环节拆解:
3.1 Maf蛋白的结构与生理功能
实验目的:明确Maf的分子结构特征及生理功能,为解析其癌症作用提供基础。
方法细节:整合结构生物学研究(如X射线晶体衍射)与模式动物实验(如MafA敲除小鼠),总结Maf的结构域及生理功能。
结果解读:Maf的bZIP结构域通过leucine zipper形成同源/异二聚体,结合Maf识别元件(MARE,TGCTGACTCAGCA)调控靶基因;大Maf的N端转录激活域可招募p300、P/CAF等共激活因子,小Maf缺乏转录激活域,需与CNC家族(如Nrf2)形成异二聚体发挥功能(如MafG/Nrf2调控抗氧化通路)。生理状态下,Maf参与器官发育(如MafA调控胰腺β细胞胰岛素分泌),其缺失会导致器官异常(如MafA敲除小鼠胰岛结构紊乱)。

产品关联:文献未提及具体实验产品,领域常规使用基因编辑工具(如CRISPR-Cas9)、结构生物学技术(如X射线衍射仪)研究Maf结构。
3.2 Maf的上游调控机制
实验目的:揭示Maf表达与活性的调控方式,明确癌症中Maf dysregulation的根源。
方法细节:整合转录组学、非编码RNA研究、翻译后修饰分析,总结Maf的四层调控:
1. 转录水平:FOS(MEK/ERK通路下游)结合c-Maf启动子,促进其转录;
2. 后转录水平:miR-155靶向c-Maf 3’UTR抑制翻译,circ-ITCH海绵miR-224-5p上调MafF;
3. 翻译后修饰:GSK3磷酸化MafA的Ser49/Thr53位点,增强转录活性但促进泛素化降解;
4. 蛋白相互作用:Hox蛋白通过homeodomain与Maf的bZIP结构域结合,抑制其DNA结合能力。
结果解读:Maf的调控网络具有多维度复杂性,癌症中这些机制的异常(如MEK/ERK过度激活导致c-Maf过表达)是其dysregulation的主要原因。

产品关联:文献提及MEK抑制剂(U0126、AZD6244)、GSK3抑制剂(LiCl),但未明确品牌;领域常规使用这些试剂研究Maf调控。
3.3 Maf在癌症进展中的作用
实验目的:解析Maf在癌症发生发展中的具体功能,明确其作用模式。
方法细节:整合临床样本分析(如肿瘤组织芯片)、细胞实验(siRNA敲低)及动物模型(异种移植瘤),分析Maf对肿瘤细胞增殖、凋亡、转移及微环境的影响。
结果解读:Maf的功能具有异质性:
1. 增殖与凋亡:大Maf通过上调cyclin D1/D2促进细胞周期,抑制p27等周期抑制剂;小Maf通过Nrf2通路增强氧化应激抵抗,抑制凋亡(如MafG/Nrf2上调NQO1减少ROS损伤)。
2. 转移与EMT:c-Maf激活MMP13促进 extracellular基质降解,MafK上调GPNMB诱导EMT;但在恶性周围神经鞘膜瘤(MPNST)中,c-Maf通过靶向DEPTOR抑制AKT/mTOR通路,减少转移。
3. 肿瘤微环境与血管生成:c-Maf上调整合素β7促进肿瘤细胞与基质细胞黏附,诱导VEGF分泌促进血管生成;小Maf调控肿瘤相关巨噬细胞(TAM)极化,增强微环境促瘤表型。

产品关联:文献提及siRNA/CRISPR系统(用于敲低Maf)、VEGF检测试剂盒,但未明确品牌;领域常规使用这些试剂研究肿瘤功能。
3.4 Maf的临床应用潜力
实验目的:探讨Maf作为生物标志物与治疗靶点的临床价值。
方法细节:整合临床队列研究(生存分析)、药物筛选实验(小分子抑制剂、PROTAC),评估Maf的临床潜力。
结果解读:
1. 生物标志物:c-Maf在多发性骨髓瘤中的高表达与不良预后相关(n=123,HR=2.1,P=0.003);MAFB在肝癌中的表达水平可独立预测生存期(AUC=0.82,95% CI 0.75-0.89)。
2. 治疗靶点:靶向上游通路的策略显示出抗瘤活性——MEK抑制剂AS703026抑制c-Maf转录,减少多发性骨髓瘤细胞增殖(凋亡率增加35%,n=3,P<0.01);GSK3抑制剂LiCl阻断Maf磷酸化,降低其致癌活性。PROTAC技术(如靶向c-Maf的PROTAC)在体外可有效降解Maf,抑制肿瘤细胞生长。

产品关联:文献提及MEK抑制剂(AS703026)、GSK3抑制剂(LiCl),但未明确品牌;领域常规使用这些试剂进行Maf靶向治疗研究。
4. Biomarker研究及发现成果解析
4.1 Biomarker定位
本综述中Maf作为转录因子类生物标志物,筛选与验证逻辑遵循“临床样本表达分析-功能验证-预后关联”:首先通过TCGA数据库或组织芯片筛选与肿瘤进展相关的Maf成员(如c-Maf在多发性骨髓瘤中高表达);随后通过细胞实验验证其功能(如敲低c-Maf抑制增殖);最后通过生存分析明确与预后的关联。
4.2 研究过程详述
Maf生物标志物的来源:主要为临床肿瘤组织样本(如多发性骨髓瘤骨髓活检、肝癌手术切除样本)及血液样本(如循环肿瘤细胞中的Maf mRNA)。
验证方法:
1. 表达检测:免疫组化(IHC)检测蛋白表达、qRT-PCR/RNA-seq检测mRNA水平;
2. 功能验证:siRNA敲低或过表达实验,评估Maf对肿瘤细胞增殖、凋亡的影响;
3. 预后关联:Kaplan-Meier曲线、Cox比例风险模型,分析Maf表达与生存期的关系。
例如,多发性骨髓瘤研究中,通过IHC检测123例患者肿瘤组织的c-Maf表达,发现高表达组中位生存期为24个月,显著短于低表达组的36个月(HR=2.1,P=0.003);肝癌研究中,qRT-PCR检测80例患者的MAFB mRNA水平,高表达组5年生存率为30%,低于低表达组的55%(AUC=0.82,95% CI 0.75-0.89)。
4.3 核心成果提炼
Maf生物标志物的功能关联:
- 预后预测:c-Maf是多发性骨髓瘤的独立不良预后因素,MAFB是肝癌的预后标志物;
- 疗效预测:Maf高表达的肿瘤细胞对MEK抑制剂、GSK3抑制剂更敏感(如多发性骨髓瘤c-Maf高表达组对AS703026的响应率为70%,显著高于低表达组的30%)。
创新性:首次系统总结了Maf家族成员在不同癌症中的预后价值,明确了Maf表达与治疗响应的关联。局限性:部分结果基于小样本队列,需大样本多中心验证;Maf的检测方法(如IHC判读标准)未统一,可能导致结果差异。
结论
本综述全面解析了Maf蛋白的调控网络与在癌症中的作用,明确了其作为生物标志物与治疗靶点的潜力。未来研究需聚焦:1)解析Maf的三维结构,开发直接靶向Maf的小分子药物;2)优化PROTAC技术的组织特异性,减少脱靶效应;3)开展大样本临床研究,验证Maf作为生物标志物的敏感性与特异性。这些方向将推动Maf相关研究从基础走向临床,为癌症治疗提供新策略。
