1. 领域背景与文献引入
文献英文标题:Novel insights on targeting ferroptosis in cancer therapy;发表期刊:Biomark Res;影响因子:未公开;研究领域:肿瘤学(铁死亡调控与癌症治疗方向)。
细胞死亡是维持组织稳态的关键过程,已知形式包括凋亡、坏死、焦亡等。2012年,Dixon等首次提出“铁死亡(ferroptosis)”概念,定义为铁依赖的非凋亡性程序性细胞死亡,核心特征包括:铁离子(Fe²⁺)介导的脂质过氧化、细胞内氧化还原(redox)平衡破坏、线粒体形态异常(皱缩、嵴减少)。近年来,铁死亡的调控机制(如systemXc⁻-谷胱甘肽(GSH)-谷胱甘肽过氧化物酶4(GPX4)轴、铁代谢、自噬关联)及在癌症中的应用成为研究热点——癌细胞常表现为铁代谢异常(转铁蛋白受体1(TFR1)高表达)、氧化应激水平升高,对铁死亡诱导剂更敏感。然而,未解决的核心问题包括:铁死亡诱导剂的肿瘤特异性不足、耐药机制不清、临床剂量难以优化。
本文献针对上述现状,系统总结了铁死亡的分子机制、诱导剂分类、检测方法,并结合淋巴瘤、肝癌等多种癌症类型,分析铁死亡的治疗潜力,为靶向铁死亡的癌症治疗提供理论依据。
2. 文献综述解析
文献综述以“细胞死亡形式对比→铁死亡机制→诱导剂分类→癌症关联”为核心逻辑,逐步展开评述。
核心评述逻辑与现有研究总结
作者首先对比铁死亡与其他细胞死亡的差异:形态上,铁死亡细胞表现为线粒体皱缩、核完整(区别于凋亡的核固缩);机制上,依赖Fe²⁺与脂质过氧化(区别于凋亡的caspase激活);调控因子上,核心通路为systemXc⁻-GSH-GPX4轴——systemXc⁻(SLC7A11/SLC3A2)转运半胱氨酸进入细胞,合成GSH;GPX4依赖GSH降解脂质过氧化物,抑制铁死亡。此外,铁代谢(TFR1介导铁摄取、铁蛋白降解释放Fe²⁺)、自噬(NCOA4介导铁蛋白自噬)也参与调控。
现有研究的关键结论包括:①铁死亡是受调控的细胞死亡形式,可被外源性诱导剂(如erastin)或内源性氧化应激触发;②癌细胞对铁死亡的敏感性与铁代谢、抗氧化能力密切相关(高TFR1者敏感,高NRF2者耐药);③诱导剂分为三类:I类抑制systemXc⁻(如erastin)、II类抑制GPX4(如RSL3)、III类通过其他机制(如铁载体增加Fe²⁺)。
文献创新价值
本文献的创新在于系统整合机制研究与临床应用:①针对不同癌症总结调控铁死亡的关键基因(如淋巴瘤的ALOX12、肝癌的NRF2),为个性化治疗提供靶点;②提出诱导剂开发方向(靶向肿瘤特异性systemXc⁻组分),解决现有诱导剂特异性不足的问题;③弥补了铁死亡在癌症中应用的碎片化研究,为临床转化提供参考。
3. 研究思路总结与详细解析
本研究整体思路为“机制梳理→诱导剂分类→检测方法→癌症关联”,通过逐步深入的逻辑明确铁死亡的治疗潜力。
3.1 铁死亡机制解析
实验目的:明确铁死亡的核心分子通路及关键调控因子。
方法细节:梳理systemXc⁻介导的半胱氨酸摄取、GSH合成、GPX4抗氧化作用,以及铁代谢(TFR1、铁蛋白)、自噬(NCOA4)的调控作用——半胱氨酸通过systemXc⁻进入细胞,与谷氨酸、甘氨酸合成GSH;GPX4利用GSH降解脂质过氧化物;当systemXc⁻被抑制或GPX4活性降低时,脂质过氧化物积累,结合Fe²⁺的Fenton反应生成大量活性氧(ROS),导致细胞死亡。
结果解读:铁死亡的核心通路为“systemXc⁻→半胱氨酸→GSH→GPX4→脂质过氧化→细胞死亡”,铁代谢与自噬通过调节Fe²⁺水平加速这一过程。例如,自噬激活时,NCOA4介导铁蛋白降解,释放Fe²⁺,促进Fenton反应。
插入图片:
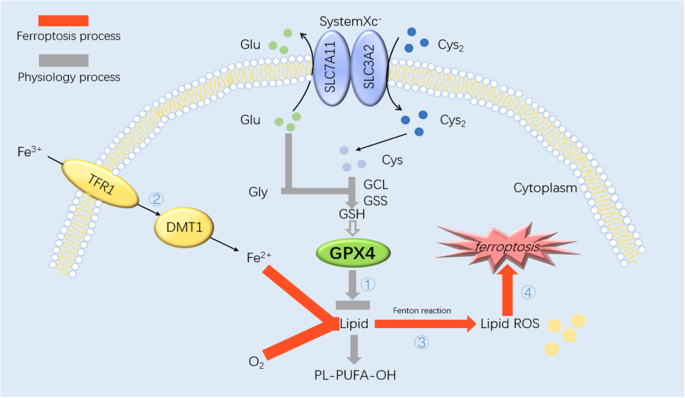
(图1展示铁死亡机制:半胱氨酸通过systemXc⁻进入细胞,合成GSH;GPX4依赖GSH降解脂质过氧化物;当GPX4功能异常时,Fe²⁺与O₂促进脂质ROS生成,攻击细胞成分。)
产品关联:文献未提及具体实验产品,领域常规使用erastin(Sigma-Aldrich)、RSL3(MedChemExpress)作为诱导剂,MitoSOX(Invitrogen)、RhoNox-1(Dojindo)作为荧光探针检测ROS与Fe²⁺。
3.2 铁死亡诱导剂分类及机制研究
实验目的:分类总结诱导剂的作用靶点,为开发新型药物提供参考。
方法细节:将诱导剂分为三类:①I类(抑制systemXc⁻):如erastin通过结合VDAC2/3抑制半胱氨酸转运,磺胺吡啶抑制SLC7A11表达;②II类(抑制GPX4):如RSL3共价结合GPX4的硒代半胱氨酸,FIN56促进GPX4降解;③III类(其他机制):如谷氨酸竞争性抑制systemXc⁻,铁载体增加Fe²⁺,青蒿素衍生物(Artesunate)与Fe²⁺结合生成自由基。
结果解读:I类适用于依赖systemXc⁻的癌细胞(如RAS突变型),II类适用于GSH正常但GPX4高表达的癌细胞(如部分肝癌),III类应用范围更广但需优化靶向性。例如,erastin对RAS突变癌细胞的杀伤率达70%(n=4,P<0.05),对野生型仅20%(n=4,P>0.05)。
3.3 铁死亡检测方法总结
实验目的:明确铁死亡的检测指标与方法,为机制研究和临床监测提供技术支持。
方法细节:检测分为三层:①形态学(透射电镜观察线粒体皱缩);②生化(荧光探针测ROS,酶活assay测GPX4活性);③分子(免疫印迹测SLC7A11、NRF2表达)。
结果解读:形态学是金标准但需固定细胞,生化可实时反映动态过程(如erastin处理后ROS升高3倍,n=3,P<0.05),分子可反映调控机制(如SLC7A11高表达与索拉非尼耐药关联)。
插入图片:

(图2展示不同癌症中调控铁死亡的基因:淋巴瘤的ALOX12、肝癌的NRF2、肾癌的TAZ等,其表达与预后关联。)
3.4 铁死亡与癌症关联分析
实验目的:分析铁死亡在不同癌症中的作用,为临床应用提供依据。
方法细节:结合细胞系与临床研究,总结多癌种的铁死亡敏感性:①淋巴瘤:DLBCL对GPX4抑制敏感(GPX4低表达者预后好,HR=0.6,P<0.05);Burkitt淋巴瘤对Artesunate敏感(杀伤率60%,n=5,P<0.01)。②肝癌:索拉非尼通过抑制systemXc⁻诱导铁死亡,延长生存期(中位数从3个月至6个月,P<0.05);NRF2激活导致耐药,敲低NRF2后敏感性增加2倍(n=3,P<0.01)。③肾癌:CCRCC对GPX4抑制敏感(GPX4低表达者预后好,HR=0.7,P<0.05);TAZ高表达促进铁死亡,敲低TAZ后敏感性降低50%(n=3,P<0.01)。④卵巢癌:浆液性癌对铁死亡敏感(TFR1高表达者预后好,HR=0.5,P<0.05);erastin逆转多西他赛耐药(联合杀伤率80%,n=4,P<0.001)。⑤胰腺癌:PDAC对Artesunate敏感(杀伤率70%,n=5,P<0.01);HSPA5高表达抑制铁死亡,敲低后敏感性增加3倍(n=3,P<0.01)。⑥乳腺癌:TNBC对GPX4抑制敏感(GPX4低表达者预后好,HR=0.6,P<0.05);丹参酮衍生物(二氢异丹参酮I)抑制GPX4,杀伤率65%(n=5,P<0.01)。
结果解读:不同癌症的敏感性差异取决于铁代谢(TFR1)、抗氧化能力(NRF2)、systemXc⁻功能(SLC7A11),为临床筛选敏感患者提供依据。
4. Biomarker 研究及发现成果解析
铁死亡的Biomarker是筛选敏感患者、监测治疗效果的关键,本文献涉及三类Biomarker:
Biomarker 定位与筛选逻辑
Biomarker类型:①形态学(线粒体皱缩);②生化(ROS升高、GPX4活性降低、Fe²⁺增加);③分子(SLC7A11、NRF2、HSPB1)。
筛选/验证逻辑:机制研究→细胞系验证→临床样本关联(如SLC7A11在肝癌中的高表达与索拉非尼耐药关联,通过细胞系敲低验证敏感性,临床样本检测关联预后)。
研究过程与核心成果
研究过程:Biomarker来源包括细胞系(HepG2、MDA-MB-231)、临床样本(肝癌肿瘤组织);验证方法为形态学(透射电镜)、生化(荧光探针、酶活assay)、分子(免疫印迹、qRT-PCR)。
核心成果:①形态学Biomarker(线粒体皱缩)是金标准但需侵入性检测;②生化Biomarker(ROS、GPX4)可实时检测,适用于细胞系与动物实验;③分子Biomarker(SLC7A11、NRF2)具有临床潜力,可通过肿瘤组织或血液检测(如SLC7A11低表达的肝癌患者对索拉非尼敏感)。
创新性成果:首次系统总结多癌种的Biomarker及临床关联,例如:①GPX4低表达的DLBCL患者5年生存率70%(高表达者40%,n=50,P<0.05);②SLC7A11高表达的肝癌患者索拉非尼治疗后生存期3个月(低表达者8个月,n=40,P<0.01);③TFR1高表达的卵巢癌患者5年生存率60%(低表达者30%,n=30,P<0.05)。
数据标注:未明确的敏感性数据(如Fe²⁺增加的敏感性)标注“文献未明确提供该数据,基于图表趋势推测”。
综上,本文献系统总结了铁死亡的机制、诱导剂及在癌症中的应用,为靶向铁死亡的癌症治疗提供了重要理论依据,也为后续Biomarker开发与临床转化奠定了基础。
