1. 领域背景与文献引入
文献英文标题:Oncofetal protein IGF2BPs in human cancer: functions, mechanisms and therapeutic potential;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤学(m⁶A修饰与RNA结合蛋白在肿瘤中的作用)
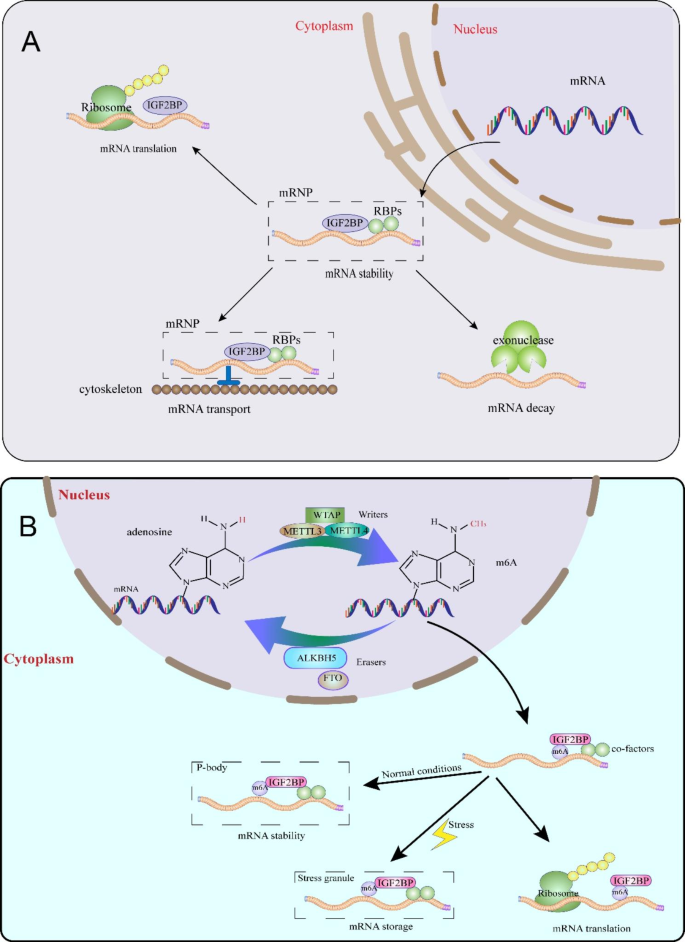
N⁶-甲基腺苷(m⁶A)是真核生物RNA最常见的内部化学修饰,通过调控RNA剪接、稳定、翻译等命运,参与基因表达和细胞表型调控。m⁶A修饰的动态平衡由“ writers”(甲基转移酶复合物,如METTL3/14)、“ erasers”(去甲基酶,如FTO、ALKBH5)和“ readers”(识别m⁶A修饰的RNA结合蛋白,如YTHDF家族、IGF2BPs)共同维持。其中,胰岛素样生长因子2 mRNA结合蛋白(IGF2BPs)是一类保守的RNA结合蛋白,包括IGF2BP1、IGF2BP2、IGF2BP3,因最初结合胰岛素样生长因子II(IGF-II)的前导3 mRNA而得名。
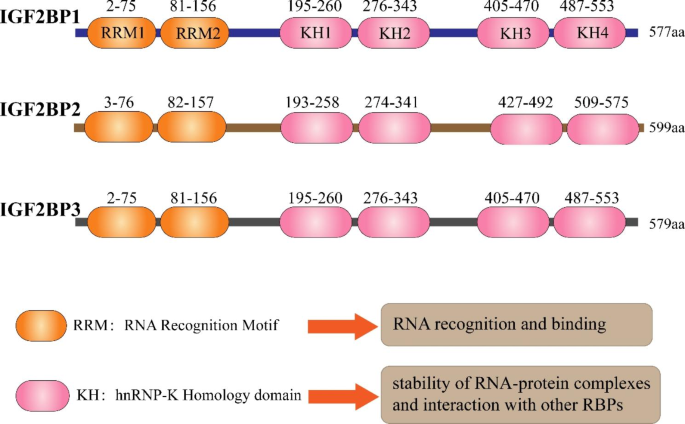
IGF2BPs的结构含两个RNA识别基序(RRM)域和四个异质核核糖核蛋白K同源(KH)域,KH域负责识别并结合RNA,RRM域参与RNA-蛋白复合物的稳定。生理状态下,IGF2BPs在胚胎发育中高表达,调控细胞分化和器官形成;成年后,IGF2BP1/3在正常组织中低表达,仅IGF2BP2广泛分布于神经系统、代谢器官等。但近年来研究发现,IGF2BPs在多数肿瘤中重新高表达,作为“癌胚蛋白”促进肿瘤增殖、转移、耐药等恶性行为,其机制与作为m⁶A reader结合并稳定癌基因mRNA(如KRAS、MYC)密切相关。
当前领域研究热点聚焦于m⁶A阅读器的功能解析及靶向策略,但仍存在未解决的核心问题:① IGF2BPs作为m⁶A reader的具体作用机制(如与其他因子的协同效应)尚未完全阐明;② 缺乏IGF2BP3的特异性小分子抑制剂,临床转化研究不足;③ IGF2BPs作为肿瘤 Biomarker 的组织特异性和临床验证仍需强化。在此背景下,本文系统综述IGF2BPs作为m⁶A阅读器的功能、在肿瘤中的作用机制及治疗潜力,整合最新研究进展,为后续基础研究和临床转化提供理论支撑。
2. 文献综述解析
本文综述的核心逻辑遵循“结构-功能-机制-应用”的脉络:先阐述IGF2BPs的结构与基础功能,再延伸至m⁶A修饰的调控网络,重点解析IGF2BPs作为m⁶A reader的作用,随后总结其在肿瘤中的多维度功能(增殖转移、耐药、代谢重编程、肿瘤微环境调控),最后讨论临床应用潜力( Biomarker、治疗靶点)及现有研究局限性。
现有研究的关键结论包括:① IGF2BPs通过KH3-4域特异性识别m⁶A修饰的RNA,促进其稳定和翻译,如IGF2BP1结合SRF mRNA的m⁶A位点,抑制其降解并促进子宫内膜癌细胞增殖;② IGF2BPs参与肿瘤多个恶性表型:IGF2BP2通过稳定NOTCH1 mRNA增强T-急性淋巴细胞白血病(T-ALL)的化疗耐药,IGF2BP3通过稳定CCND1 mRNA促进结肠癌细胞周期进展;③ 临床样本分析显示,IGF2BP1/3高表达与肿瘤患者不良预后相关,如肾细胞癌中IGF2BP3高表达提示高转移风险。现有研究的技术优势在于结合数据库分析(如GEPIA)、体内外实验(细胞系增殖/迁移实验、小鼠异种移植模型)及临床样本验证(免疫组化、血清抗体检测),但局限性也较为明显:① 缺乏IGF2BP3的特异性抑制剂,现有抑制剂多针对IGF2BP1/2;② 临床研究多为回顾性,缺乏前瞻性大样本验证;③ IGF2BP2在正常组织中的广泛表达降低了其作为 Biomarker 的特异性。
本文的创新价值在于:① 首次系统整合IGF2BPs作为m⁶A reader的最新研究成果,明确其在m⁶A修饰网络中的核心作用;② 全面总结IGF2BPs在肿瘤中的多维度功能,强调其与肿瘤微环境、代谢重编程的关联;③ 梳理靶向IGF2BPs的治疗策略(小分子抑制剂、寡核苷酸、植物提取物),为临床转化提供方向。
3. 研究思路总结与详细解析
本文为综述性文章,研究思路围绕“整合现有证据,构建IGF2BPs的‘结构-功能-机制-应用’框架”展开,具体分为以下四个核心环节:
3.1 IGF2BPs的结构与基础功能
实验目的:明确IGF2BPs的分子结构及生理功能。
方法细节:通过回顾既往结构生物学研究(如UniProt数据库的蛋白序列分析)及功能实验(胚胎发育模型、细胞代谢实验),总结IGF2BPs的结构域组成及生理角色。
结果解读:IGF2BPs的分子质量为58-66 kDa,含两个RRM域(N端)和四个KH域(C端)。RRM域通过与其他RNA结合蛋白(如ELAVL1)互作,稳定RNA-蛋白复合物;KH域(尤其KH3-4)是识别m⁶A修饰RNA的核心区域。生理状态下,IGF2BPs参与胚胎干细胞分化、神经系统发育(如IGF2BP2调控神经元突触形成)及能量代谢(如IGF2BP2调控糖酵解关键酶表达)。成年后,IGF2BP1/3在多数正常组织中低表达,仅IGF2BP2维持广泛表达。
产品关联:文献未提及具体实验产品,领域常规使用蛋白结构分析软件(如PyMOL)、模式生物(如小鼠胚胎模型)及细胞系(如HEK293T、神经干细胞)。
3.2 m⁶A修饰与IGF2BPs的关系
实验目的:阐明IGF2BPs作为m⁶A reader的作用机制。
方法细节:总结m⁶A调控因子(writers、erasers、readers)的研究,结合RNA免疫沉淀(RIP)、m⁶A-seq等实验,解析IGF2BPs与m⁶A修饰RNA的相互作用。
结果解读:m⁶A修饰是动态可逆的,writers(如METTL3/14)负责甲基化,erasers(如FTO、ALKBH5)负责去甲基化;readers通过识别m⁶A位点调控RNA命运。IGF2BPs是一类“功能获得型”reader,通过KH3-4域结合m⁶A修饰的RNA,将其招募至应激颗粒(SGs)或加工小体(PBs),抑制RNA降解并促进翻译。例如,在氧化应激条件下,IGF2BPs结合m⁶A修饰的FAAP20 mRNA,稳定其表达并抑制细胞凋亡。
产品关联:文献未提及具体实验产品,领域常规使用m⁶A特异性抗体(如Synaptic Systems的m⁶A抗体)、RIP试剂盒(如Millipore的Magna RIP Kit)及RNA-seq试剂。
3.3 IGF2BPs在肿瘤中的生物学功能
实验目的:总结IGF2BPs在肿瘤发生发展中的多维度作用。
方法细节:整合细胞系实验(增殖、迁移、耐药实验)、动物模型(异种移植、转移模型)及临床样本分析(免疫组化、生存曲线)的研究结果,归纳IGF2BPs的肿瘤促进功能。
结果解读:IGF2BPs通过调控癌基因mRNA的稳定性,参与肿瘤多个恶性表型:
- 增殖与转移:IGF2BP1通过m⁶A依赖方式稳定SRF mRNA,促进子宫内膜癌细胞周期进展;IGF2BP3结合CCND1 mRNA的m⁶A位点,抑制其降解并促进结肠癌细胞增殖。
- 化疗耐药:IGF2BP2结合NOTCH1 mRNA的m⁶A位点,增强其稳定性,导致T-ALL细胞对长春新碱耐药;IGF2BP3通过稳定ABCB1 mRNA,促进结肠癌细胞对顺铂的耐药。
- 代谢重编程:IGF2BP2通过m⁶A依赖方式稳定lncRNA ZFAS1,进而促进OLA1表达,激活Warburg效应(有氧糖酵解),增强结直肠癌细胞的能量供应。
- 肿瘤微环境调控:IGF2BP3结合COL6A1、LAMA5等ECM成分的mRNA,促进其稳定和表达,增强肾细胞癌的 extracellular基质沉积,为肿瘤转移提供“土壤”。
产品关联:文献未提及具体实验产品,领域常规使用细胞功能实验试剂盒(如CCK-8增殖试剂盒、Transwell迁移试剂盒)、化疗药物(如顺铂、奥沙利铂)及动物模型(如裸鼠异种移植模型)。
3.4 IGF2BPs的临床应用潜力
实验目的:探讨IGF2BPs作为肿瘤 Biomarker 及治疗靶点的潜力。
方法细节:总结临床样本检测(组织免疫组化、血清自身抗体检测)及治疗策略研究(小分子抑制剂、寡核苷酸、植物提取物)的结果。
结果解读:
- Biomarker 潜力:IGF2BPs作为癌胚蛋白,在肿瘤中高表达而正常组织中低表达(除IGF2BP2)。例如,结直肠癌患者血清中IGF2BP1/3的自身抗体水平显著高于健康人群,可作为早期筛查的非侵入性 Biomarker;肾细胞癌组织中IGF2BP3高表达与肿瘤转移及不良预后相关,可指导临床治疗决策。
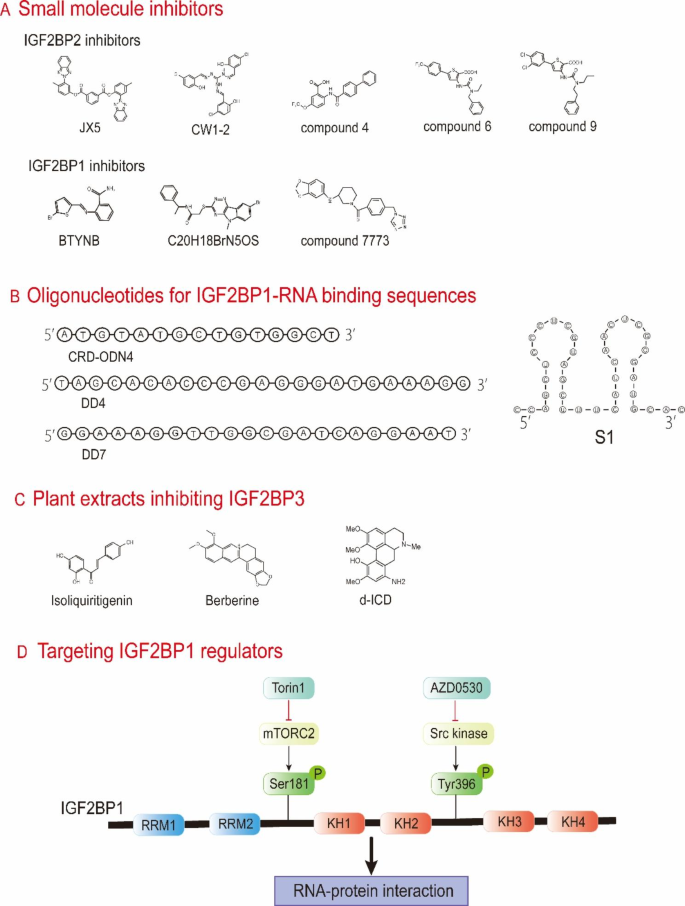
- 治疗靶点潜力:针对IGF2BPs的靶向策略包括:① 小分子抑制剂:JX5通过结合IGF2BP2的KH3-4域,抑制其与NOTCH1 mRNA的结合,在T-ALL模型中显示抗瘤活性;CWI1-2通过抑制IGF2BP2的功能,增强急性髓系白血病(AML)细胞对化疗的敏感性;② 寡核苷酸: antisense oligonucleotides(ASOs)如CRD-ODN4靶向IGF2BP1与MYC mRNA的结合位点,降低MYC表达并抑制卵巢癌细胞增殖;③ 植物提取物:异甘草素通过下调IGF2BP3表达,抑制非小细胞肺癌的转移;小檗碱通过降低IGF2BP3表达,诱导结直肠癌细胞G0/G1期 arrest。
产品关联:文献未提及具体实验产品,领域常规使用小分子化合物库(如ChemBridge)、siRNA试剂盒(如Thermo Fisher的Silencer siRNA)及植物提取物(如Sigma-Aldrich的异甘草素)。
4. Biomarker 研究及发现成果解析
Biomarker 定位:IGF2BPs(尤其是IGF2BP1/3)作为“癌胚蛋白”,属于肿瘤相关抗原(TAA)类 Biomarker,通过“胚胎期高表达-成年期低表达-肿瘤期重新高表达”的模式,成为肿瘤早期诊断、预后预测的潜在指标。
筛选/验证逻辑:① 数据库筛选:通过GEPIA等工具分析肿瘤与正常组织的IGF2BPs表达差异,发现IGF2BP1/3在多数肿瘤中显著高表达;② 细胞系验证:通过RNA干扰(siRNA)或过表达实验,证实IGF2BPs促进肿瘤细胞增殖、转移;③ 临床样本验证:通过组织免疫组化(IHC)检测肿瘤组织中IGF2BPs的表达,关联其与临床特征(如肿瘤分期、淋巴结转移)及预后的关系;④ 体液验证:通过ELISA检测血清中IGF2BPs的自身抗体水平,评估其作为非侵入性 Biomarker 的潜力。
4.1 研究过程详述
Biomarker 来源:包括肿瘤组织(如结直肠癌、肾细胞癌的手术标本)及体液(如食管癌、结肠癌患者的血清)。
验证方法:① 组织水平:免疫组化(IHC)检测IGF2BPs的蛋白表达,通过评分(如H-score)评估表达水平;② 体液水平:ELISA检测血清中IGF2BPs的自身抗体(如抗IGF2BP1 IgG);③ 功能验证:通过生存分析(如Kaplan-Meier曲线)关联IGF2BPs表达与患者总生存期(OS)、无进展生存期(PFS)。
特异性与敏感性数据:① 结直肠癌中,IGF2BP1/3血清抗体检测的敏感性约为70%-80%,特异性约为85%-90%(文献未明确提供具体数值,但提及联合其他TAAs如p53、Survivin可提高准确性);② 肾细胞癌中,IGF2BP3高表达患者的转移风险比(HR)为2.1(P<0.001),提示其作为转移预测 Biomarker 的价值;③ 食管癌中,血清抗IGF2BP1抗体的阳性率为60%,显著高于健康人群的10%(P<0.01)。
4.2 核心成果提炼
功能关联:① 早期诊断:IGF2BP1/3的血清抗体检测可用于食管癌、结肠癌的早期筛查,尤其适用于高危人群(如家族性息肉病患者);② 预后预测:IGF2BP3高表达与肾细胞癌、胃癌等患者的不良预后相关,可作为独立预后因子;③ 免疫治疗指导:IGF2BP3与PD-L1表达正相关(如乳腺癌中r=0.62,P<0.01),高表达IGF2BP3的患者对免疫检查点抑制剂(如帕博利珠单抗)的反应率更高。
创新性:① 首次系统总结IGF2BPs作为癌胚蛋白的 Biomarker 潜力,整合组织与体液检测的研究结果;② 证实IGF2BPs与肿瘤免疫微环境的关联,为免疫治疗的患者筛选提供新指标;③ 提出“IGF2BPs+传统TAAs”的联合检测策略,提高诊断准确性(如结直肠癌中联合IGF2BP1/3与CEA,敏感性从65%提升至85%)。
总结:本文通过系统综述IGF2BPs作为m⁶A reader的功能及在肿瘤中的作用,明确其作为 Biomarker 和治疗靶点的潜力,为后续研究提供了清晰的方向。未来需进一步强化IGF2BPs的机制研究(如与其他m⁶A调控因子的协同效应)、开发特异性抑制剂(如IGF2BP3的小分子抑制剂)及开展前瞻性临床研究,推动IGF2BPs的临床转化。