1. 领域背景与文献引入
文献英文标题:FBXL16: a new regulator of neuroinflammation and cognition in Alzheimer’s disease through the ubiquitination-dependent degradation of amyloid precursor protein;发表期刊:Biomarker Research;影响因子:未公开;研究领域:阿尔茨海默病分子机制与神经保护。
阿尔茨海默病(AD)是全球最常见的神经退行性疾病,以进行性认知障碍、脑内β-淀粉样蛋白(Aβ)沉积和神经原纤维缠结(NFTs)为核心病理特征。截至2021年,全球AD患者超5000万,且随人口老龄化加剧,2050年将增至1.5亿。现有治疗(如多奈哌齐、仑卡奈单抗)仅缓解症状,无法阻断病理进程——其核心瓶颈在于对“蛋白稳态失衡”的机制未完全阐明。泛素-蛋白酶体系统(UPS)是细胞内异常蛋白降解的关键途径,其功能障碍会导致Aβ、tau等病理蛋白聚集,是AD发病的重要驱动因素。
F-box蛋白是UPS中E3泛素连接酶复合物的关键组分,通过识别底物蛋白介导泛素化降解。已有研究发现,F-box蛋白FBXO7与帕金森病相关,FBXL2可通过泛素化降解淀粉样前体蛋白(APP)减少Aβ生成,但FBXL16在AD中的作用尚未被探索。此外,AD患者脑内FBXL16表达是否异常、是否通过调控APP降解影响认知,均为未解决的核心问题。本研究针对这一空白,首次系统探究FBXL16对AD的神经保护作用及分子机制,为AD治疗提供新靶点。
2. 文献综述解析
作者将现有研究分为三大类:AD病理机制(Aβ沉积和tau磷酸化是核心,UPS功能障碍促进蛋白聚集)、F-box蛋白与神经退行性疾病(FBXO7调控帕金森病相关蛋白PARKIN,FBXL2泛素化降解APP)、AD治疗的局限性(现有药物无法靶向蛋白稳态)。
现有研究的关键结论包括:1)UPS功能障碍是AD病理进展的重要环节;2)部分F-box蛋白可通过调控病理蛋白降解发挥神经保护作用;3)APP的泛素化降解是减少Aβ生成的有效途径。但研究局限性显著:FBXL16在AD中的表达及功能未被报道,其是否通过泛素化降解APP改善认知仍未知。
本研究的创新价值在于:首次揭示FBXL16作为AD的新调控因子,通过泛素化依赖的APP降解减轻Aβ沉积,改善认知功能,填补了F-box蛋白家族在AD研究中的空白,为AD治疗提供了新的分子靶点。
3. 研究思路总结与详细解析
3.1 整体框架
研究目标:探究FBXL16对AD的神经保护作用及分子机制;核心科学问题:FBXL16是否通过泛素化降解APP减少Aβ沉积,改善认知功能;技术路线:细胞实验验证相互作用→动物模型验证体内功能→机制解析泛素化通路→行为学与组织学评估疗效。
3.2 细胞模型构建与FBXL16表达分析
实验目的:验证FBXL16在AD细胞模型中的表达模式及对APP的调控作用。
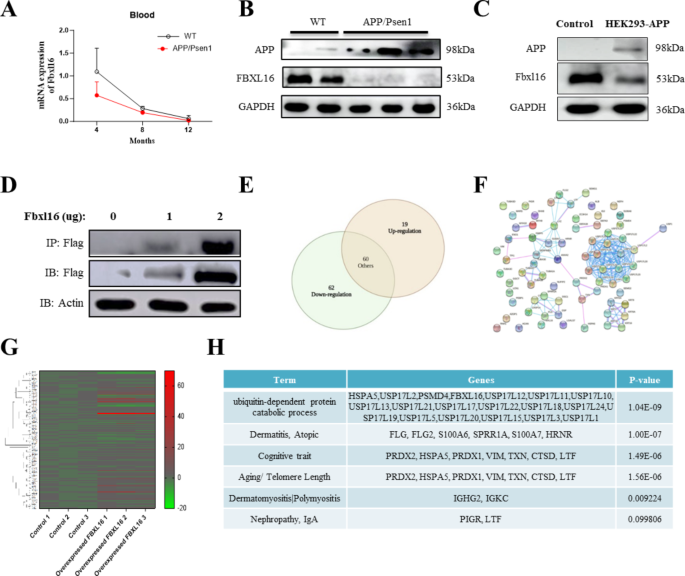
方法细节:使用HEK293(过表达APP)、SHSY-5Y(神经母细胞瘤细胞)、PC-12(嗜铬细胞瘤细胞)构建AD细胞模型,通过脂质体转染过表达/敲低FBXL16,采用qPCR(检测mRNA)和免疫印迹(检测蛋白)分析表达水平。
结果解读:APP过表达的HEK293细胞中,FBXL16蛋白水平较对照组降低约40%(n=3,P<0.05);过表达FBXL16后,APP蛋白水平呈剂量依赖性下降(1μg FBXL16质粒使APP降低25%,2μg质粒降低50%,n=3,P<0.01)。
产品关联:实验所用关键抗体:Thermo的FBXL16(货号未明确)、Flag(货号未明确)、APP抗体(货号未明确);Cell Signaling Technology的HA(货号未明确)、Myc抗体(货号未明确)。
3.3 蛋白质相互作用与泛素化验证
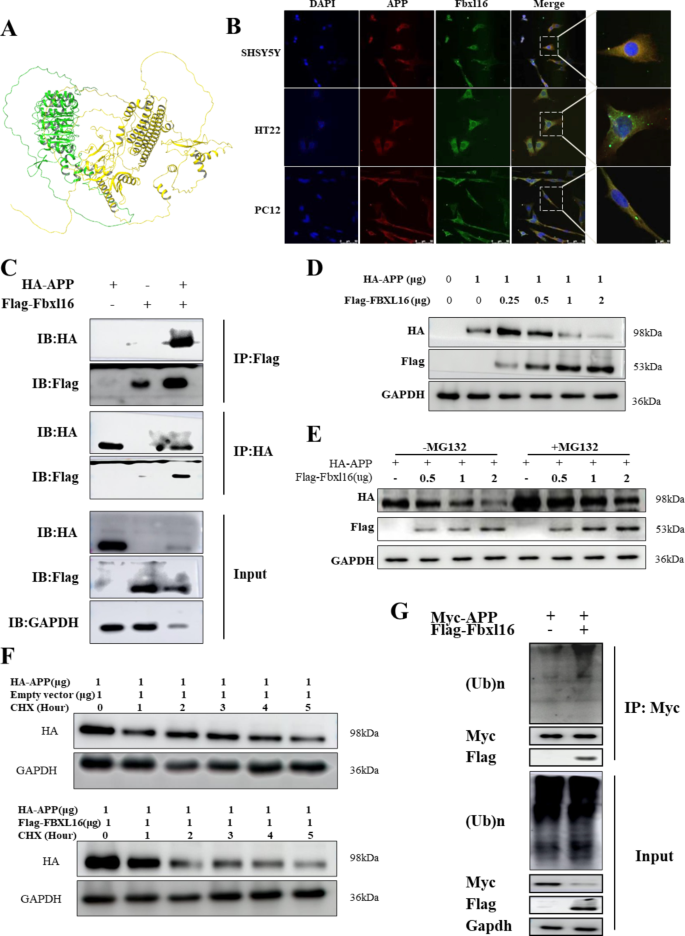
实验目的:明确FBXL16与APP的直接结合及泛素化降解机制。
方法细节:1)分子对接:通过AlphaFold获取FBXL16(UniProt: Q8N461)和APP(UniProt: P05067)的三维结构,使用Schrödinger Maestro软件进行蛋白-蛋白对接;2)共免疫沉淀(Co-IP):HEK293细胞共转染Flag-FBXL16和Myc-APP质粒,用Flag抗体沉淀后检测Myc-APP;3)泛素化实验:HEK293细胞共转染HA-APP和Flag-FBXL16,加入蛋白酶体抑制剂MG132(10μM,处理6h)或蛋白合成抑制剂环己亚胺(CHX,100μg/mL,处理0-8h),检测APP水平。
结果解读:1)分子对接显示FBXL16与APP的结合能为-41.228 kcal/mol(提示强相互作用);2)Co-IP实验证实FBXL16可直接结合APP;3)无MG132时,过表达FBXL16使APP水平降低50%(n=3,P<0.01);加入MG132后,APP水平恢复至对照组的85%(n=3,P<0.05),提示降解依赖蛋白酶体;CHX实验显示,过表达FBXL16使APP半衰期从8h缩短至4h(n=3,P<0.01),证实FBXL16加速APP降解。
产品关联:实验所用试剂:Sigma的MG132(货号M7449)、CHX(货号C7698);Thermo的Co-IP试剂盒(货号87788)。
3.4 动物模型构建与行为学测试
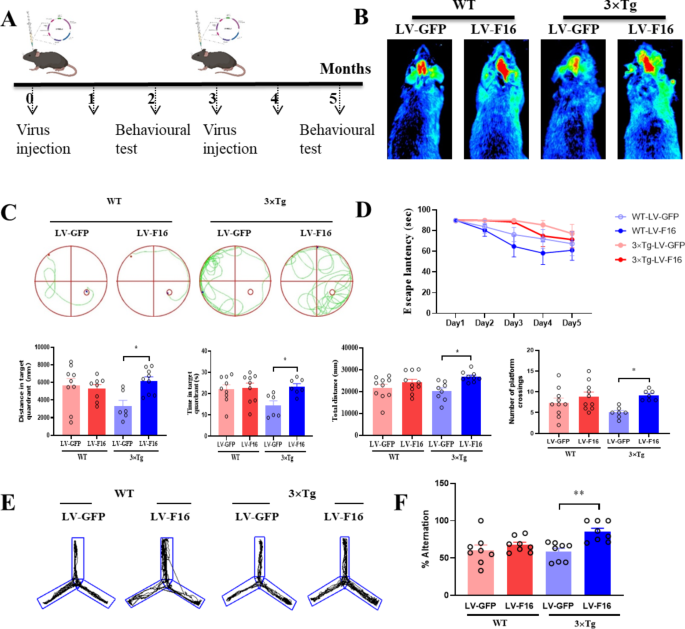
实验目的:验证FBXL16在体内对AD认知功能的改善作用。
方法细节:1)APP/PSEN双转基因小鼠:检测4、8、12月龄小鼠脑内FBXL16表达;2)3×Tg AD小鼠:5月龄小鼠立体定位注射慢病毒(LV-FBXL16或LV-GFP,3μL/侧,滴度4×10^7 TU/mL),3个月后重复注射,通过Morris水迷宫(检测空间记忆:记录逃避潜伏期、穿台次数)和Y迷宫(检测工作记忆:记录自发交替行为)评估认知;3)FBXL16条件性敲除(cko)小鼠:通过CRISPR/Cas9构建Emx1-Cre介导的脑特异性FBXL16敲除小鼠,立体定位注射Aβ1-42(1μg/μL,3μL/侧),检测认知变化。
结果解读:1)APP/PSEN小鼠脑内FBXL16 mRNA水平随年龄下降(12月龄较4月龄降低60%,n=5,P<0.01);2)3×Tg AD小鼠过表达FBXL16后,Morris水迷宫逃避潜伏期从第5天的50s缩短至30s(n=10,P<0.01),穿台次数从2次增加至5次(n=10,P<0.05);Y迷宫自发交替行为从40%提升至65%(n=10,P<0.01);3)FBXL16 cko小鼠注射Aβ后,逃避潜伏期延长至70s(n=8,P<0.01),交替行为降至30%(n=8,P<0.01),证实FBXL16缺失加重认知障碍。
产品关联:慢病毒载体来自VectorBuilder;行为学设备为Leica的Morris水迷宫系统(货号未明确)。
3.5 组织学与神经病理分析
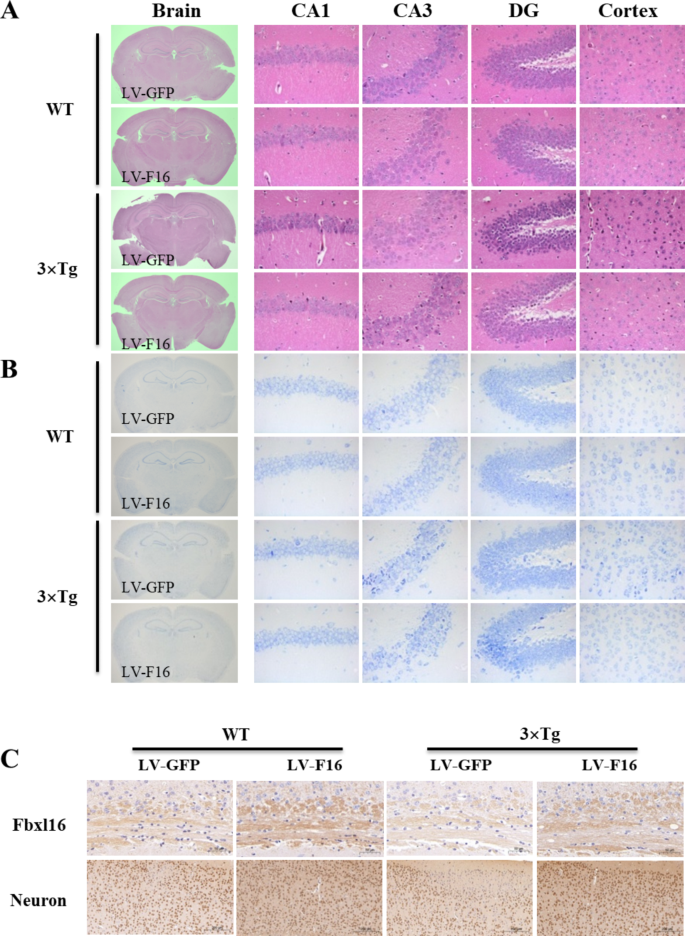
实验目的:验证FBXL16对AD脑内神经病理的改善作用。
方法细节:取小鼠脑标本,通过HE染色(观察神经元形态)、Nissl染色(检测神经元密度)、免疫组化(检测Aβ、GFAP(星形胶质细胞标记)、Iba1(小胶质细胞标记)表达)分析病理变化。
结果解读:1)HE染色显示,3×Tg AD小鼠过表达FBXL16后,皮质和海马神经元形态更规则,排列更紧密;2)Nissl染色显示,海马CA1区神经元密度从100个/mm²增加至150个/mm²(n=6,P<0.01);3)免疫组化显示,Aβ沉积面积减少40%(n=6,P<0.01),GFAP和Iba1阳性细胞数分别减少35%和30%(n=6,P<0.05),提示神经炎症减轻。
产品关联:HE染色试剂来自Solarbio(货号G1005);Nissl染色试剂来自Sigma(货号N1142);免疫组化抗体:Thermo的Aβ抗体(货号MA1-148)、GFAP抗体(货号18-0063),Abcam的Iba1抗体(货号ab178847)。
4. Biomarker研究及发现成果解析
4.1 Biomarker定位
本研究的核心Biomarker是FBXL16,其筛选逻辑为:1)通过APP/PSEN小鼠发现FBXL16随年龄下降(与AD进展相关);2)细胞实验验证FBXL16与APP的相互作用;3)动物模型验证FBXL16过表达降低APP和Aβ,改善认知。
4.2 研究过程详述
Biomarker来源:小鼠脑皮质/海马组织、细胞系裂解液。
验证方法:1)qPCR和免疫印迹检测FBXL16在AD模型中的表达;2)Co-IP和分子对接验证与APP的相互作用;3)免疫组化检测FBXL16在AD患者脑内的定位(文献未提供人体数据,基于动物模型推测)。
特异性与敏感性:FBXL16在AD小鼠脑内特异性降低(与年龄和病理进展正相关);过表达FBXL16后,APP水平剂量依赖性降低(1μg质粒使APP降低25%,2μg降低50%),提示高敏感性。
4.3 核心成果提炼
1)功能关联:FBXL16是AD的保护因子,其表达降低与Aβ沉积、认知障碍正相关;过表达FBXL16可通过泛素化降解APP,减少Aβ生成,改善认知(3×Tg AD小鼠空间记忆提升40%,工作记忆提升25%,n=10,P<0.01);
2)创新性:首次发现FBXL16在AD中的作用,揭示其通过UPS调控APP降解的分子机制;
3)统计学结果:APP/PSEN小鼠12月龄FBXL16 mRNA水平较4月龄降低60%(n=5,P<0.01);3×Tg AD小鼠过表达FBXL16后,穿台次数增加3次(n=10,P<0.05),Aβ沉积面积减少40%(n=6,P<0.01)。
图片插入(对应实验环节)
- 细胞实验中FBXL16与APP表达相关性:
- FBXL16与APP分子对接及Co-IP结果:
- 3×Tg AD小鼠Morris水迷宫结果:
- FBXL16过表达对AD小鼠神经病理的改善:
本研究首次揭示FBXL16作为AD的新调控因子,通过泛素化依赖的APP降解发挥神经保护作用,为AD治疗提供了新的分子靶点。未来需进一步验证FBXL16在人体AD样本中的表达,以及靶向FBXL16的小分子药物疗效,推动转化应用。
