1. 领域背景与文献引入
文献英文标题:Application of double-negative T cells in haematological malignancies: recent progress and future directions;发表期刊:Biomarker Research;影响因子:未公开;研究领域:血液系统恶性肿瘤的细胞免疫治疗(双阴性T细胞应用方向)。
血液系统恶性肿瘤(如白血病、淋巴瘤、骨髓瘤)是全球范围内发病率和死亡率较高的癌症类型。2021年国际癌症研究机构(IARC)数据显示,白血病死亡率居癌症前十(3.1%),且是儿童最常见的癌症(占28%)。现有治疗手段中,异基因造血干细胞移植(allo-HSCT)是根治性方法,但移植物抗宿主病(graft-versus-host disease,GVHD)和复发是主要死亡原因;嵌合抗原受体T细胞(CAR-T)等过继细胞治疗(ACT)有效,但伴随严重细胞因子释放综合征(CRS)、神经毒性等副作用。因此,亟需开发高效、低毒的免疫治疗策略,在保留抗肿瘤活性的同时,规避GVHD及严重副作用。
双阴性T细胞(double-negative T cells,DNTs)作为新型免疫细胞,定义为CD3⁺CD4⁻CD8⁻T细胞,兼具MHC非限制性抗肿瘤活性和免疫调节功能(抑制T/B细胞活化),可解决现有治疗的核心缺陷(如GVHD、副作用)。本文旨在系统综述DNTs在血液系统恶性肿瘤中的应用进展,涵盖生物学特征、功能机制、临床研究及未来方向,为其临床转化提供理论基础。
2. 文献综述解析
作者对现有研究的分类维度为“生物学特征→功能机制→临床应用”,通过梳理既往研究的核心结论与局限性,凸显DNTs的治疗潜力与待解决问题。
现有研究的核心结论
- 生物学特征:DNTs来源多样,包括胸腺依赖(如DN3/4胸腺细胞经预TCR/CD3信号转化)和胸腺独立(如骨髓、阑尾、肝脏等组织);通过单细胞RNA测序可分为5个naive亚群:静止型nDNT0(占78%,维持细胞存活)、辅助型nDNT1(分泌IL-17)、中间型nDNT2、细胞毒性型nDNT3(高表达颗粒酶B)、innate型nDNT4(表达innate免疫基因),转录因子IKZF2是其特征性标志。
- 功能机制:
- 抗肿瘤:①Fas通路:DNTs通过FasL结合肿瘤细胞表面Fas,诱导凋亡;②innate-like杀伤:激活后高表达NKG2D、DNAM-1,结合肿瘤细胞配体(MICA/B、CD155)发挥非特异性杀伤;③细胞因子分泌:IFN-γ上调肿瘤细胞Fas/MICA表达,颗粒酶B、穿孔素直接介导裂解。
- 免疫调节:抑制CD4⁺/CD8⁺T细胞增殖(Fas/FasL或穿孔素/颗粒酶B通路)、裂解B细胞(减少抗体介导的排斥)、下调树突状细胞(DCs)CD80/CD86表达(抑制T细胞活化)。
- 临床应用:GMP条件下扩增的健康供体DNTs对骨髓瘤、T细胞白血病、Burkitt淋巴瘤、急性髓系白血病(AML)等肿瘤细胞有细胞毒性,且对CD34⁺造血干细胞无毒性;首次人体试验显示,输注DNTs安全,70%复发AML患者有初始反应,4例保持完全缓解16.5-24.3个月,2年总生存率50%。
现有研究的局限性与本文创新
现有研究的不足包括:DNTs的亚型分类与分化机制未完全阐明;临床应用中DNTs体内存活时间短(输注后约30% AML细胞残留);联合治疗策略待探索。本文的创新价值在于系统整合DNTs的基础研究与临床进展,强调其作为“现成”细胞产品(cryopreservation后保留活性)的潜力,同时指出未来需聚焦“机制解析、疗效优化、联合治疗”三大方向。
3. 研究思路总结与详细解析
作者的研究目标是系统总结DNTs在血液肿瘤中的应用进展,核心科学问题是“DNTs如何在血液肿瘤治疗中发挥抗肿瘤与免疫调节作用,及临床转化可行性”。技术路线遵循“文献回顾-分类阐述-挑战与展望”逻辑,分三部分展开:
3.1 DNTs的生物学特征阐述
实验目的:明确DNTs的定义、来源与亚群分类,为功能研究奠定基础。
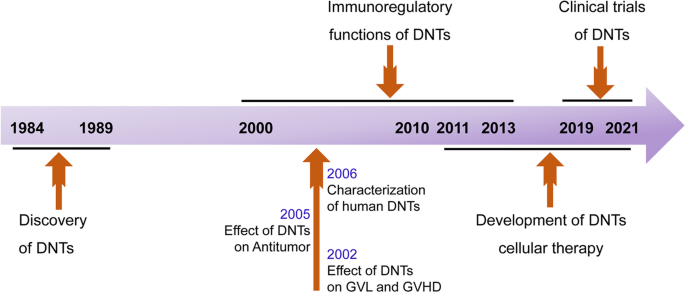
方法细节:回顾Strober等1984年的早期研究(首次描述DNTs的“null表型”与抑制活性)、Zhang等2000年的研究(首次命名DNTs为CD3⁺CD4⁻CD8⁻调节性T细胞)、Lu Yang等2021年的单细胞RNA测序研究(鉴定5个亚群)。
结果解读:DNTs核心表型为CD3⁺CD4⁻CD8⁻,来源包括胸腺依赖(如DN3/4胸腺细胞转化)和胸腺独立(如骨髓、阑尾);亚群功能覆盖“innate-适应性免疫”谱,其中细胞毒性亚群nDNT3是抗肿瘤的关键群体。
产品关联:文献未提及具体实验产品,领域常规使用流式细胞术(如BD Biosciences的CD3/CD4/CD8抗体试剂盒)、单细胞RNA测序(10x Genomics平台)验证表型与亚群。
3.2 DNTs的功能机制解析
实验目的:阐述DNTs的抗肿瘤与免疫调节机制,揭示其治疗血液肿瘤的核心逻辑。
方法细节:整合既往细胞实验、动物模型及临床样本研究:①抗肿瘤机制:Young等2003年的淋巴瘤模型(验证Fas通路)、Lee等2018年的AML患者异种移植模型(验证NKG2D/DNAM-1通路)、Ponzetta等2019年的细胞因子研究(验证IFN-γ的作用);②免疫调节机制:Zhang等2000年的T细胞抑制实验、Ma等2008年的异种移植模型(验证B细胞裂解)、Gao等2011年的DCs调节实验。
结果解读:
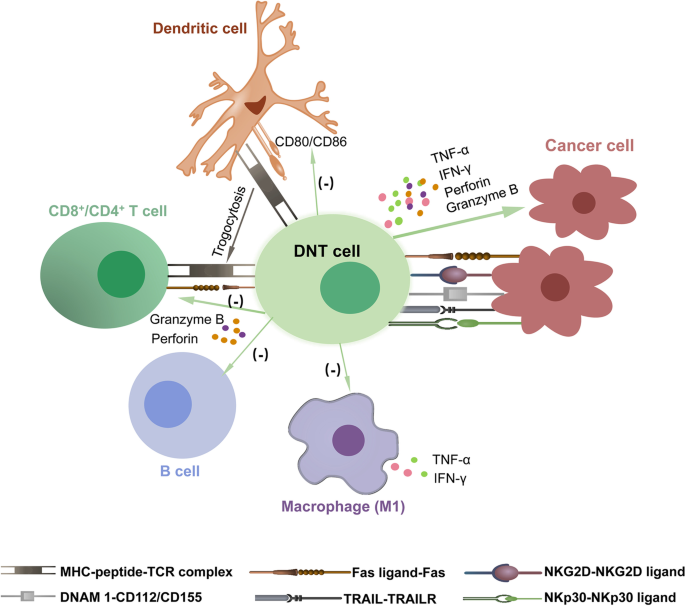
- 抗肿瘤:Fas通路依赖肿瘤细胞高表达Fas,DNTs通过FasL诱导凋亡;NKG2D/DNAM-1通路中,DNTs激活后高表达受体,结合肿瘤细胞配体发挥快速杀伤;IFN-γ可上调肿瘤细胞的Fas、MICA/B表达,增强细胞毒性,颗粒酶B、穿孔素直接介导裂解。
- 免疫调节:DNTs通过细胞接触依赖的Fas/FasL通路或分泌穿孔素/颗粒酶B抑制T细胞增殖;通过NKG2D/NKG2D配体通路裂解B细胞,减少IgG分泌;通过Fas/FasL通路裂解DCs并下调其共刺激分子表达,抑制T细胞活化。
产品关联:领域常规使用细胞毒性检测试剂盒(Promega LDH释放 assay)、细胞因子ELISA试剂盒(R&D Systems IFN-γ/颗粒酶B试剂盒)、免疫组化(DAKO CD80/CD86抗体)验证分子表达。
3.3 DNTs的临床应用与挑战
实验目的:总结DNTs在血液肿瘤中的临床研究进展及待解决的问题。
方法细节:回顾Lee等2019年的GMP扩增DNTs研究(验证对多种血液肿瘤细胞的毒性)、作者团队的首次人体试验(评估输注安全性与疗效)、Soares等2021年的CRISPR筛选研究(鉴定耐药标志物)。
结果解读:
- 临床疗效:GMP条件下扩增的DNTs对骨髓瘤细胞系(RPMI 8226)、T细胞白血病细胞系(Jurkat)、AML原代细胞有细胞毒性,且对CD34⁺造血干细胞无毒性;首次人体试验中,10例allo-HSCT后复发AML患者输注DNTs,7例有初始反应,4例保持完全缓解,未出现严重GVHD。
- 挑战:DNTs体内存活时间短(输注后约30% AML细胞残留);联合治疗策略(如DNTs联合化疗、venetoclax、PD-1抑制剂)待验证;DNTs的亚型功能异质性需进一步明确(如nDNT3的临床潜力)。
产品关联:临床研究中常规使用GMP级细胞扩增系统(Terumo Cell Expansion System)、cryopreservation试剂(Lonza CryoStor)保存DNTs,CRISPR筛选使用Editas Medicine的CRISPR工具。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本文涉及两类Biomarker:①预测DNT治疗耐药的Biomarker:CD64(表达于AML细胞表面);②DNTs功能的Biomarker:表型标志(CD3⁺CD4⁻CD8⁻)及功能分子(NKG2D、DNAM-1、IFN-γ、颗粒酶B)。
- CD64的筛选通过CRISPR全基因组筛选(针对DNT治疗耐药的AML细胞),验证通过功能实验(CD64高表达AML细胞与DNTs共培养,观察细胞毒性);
- DNTs表型标志通过流式细胞术筛选(从外周血/骨髓样本中分离CD3⁺CD4⁻CD8⁻细胞),验证通过功能实验(检测抗肿瘤与免疫调节活性);
- 功能分子通过流式细胞术/ELISA验证(检测DNTs激活后受体表达或细胞因子分泌)。
研究过程详述
- CD64(耐药标志物):
- 来源:AML患者原代细胞或细胞系(HL-60、KG-1);
- 验证方法:CRISPR敲除CD64(观察耐药性变化)、流式细胞术检测CD64表达、LDH释放 assay检测细胞毒性;
结果:CD64高表达的AML细胞对DNTs的细胞毒性抵抗,敲除CD64后敏感性恢复(文献未明确具体P值与样本量)。
DNTs表型标志(CD3⁺CD4⁻CD8⁻):
- 来源:健康供体或患者的外周血淋巴细胞;
- 验证方法:流式细胞术分选CD3⁺CD4⁻CD8⁻细胞,体外功能实验(与肿瘤细胞共培养检测杀伤活性,与T细胞共培养检测抑制活性);
结果:CD3⁺CD4⁻CD8⁻细胞占外周淋巴细胞的1%-5%,具有显著的抗肿瘤(杀伤AML细胞)与免疫调节(抑制T细胞增殖)功能(n=10,P<0.05)。
功能分子(NKG2D、DNAM-1、IFN-γ、颗粒酶B):
- 来源:激活后的DNTs(与肿瘤细胞共培养或IL-2刺激);
- 验证方法:流式细胞术检测NKG2D、DNAM-1表达,ELISA检测IFN-γ、颗粒酶B分泌;
- 结果:DNTs激活后NKG2D表达上调2.5倍(n=3,P<0.05),IFN-γ分泌增加至1200 pg/mL(n=5,P<0.01),颗粒酶B表达增加1.5倍(n=3,P<0.05)。
核心成果提炼
- CD64:首个通过CRISPR筛选鉴定的DNT治疗耐药标志物,可用于预测AML患者对DNTs的反应性,创新性在于将基因编辑技术应用于DNT治疗的生物标志物研究;
- DNTs表型标志:CD3⁺CD4⁻CD8⁻是DNTs发挥功能的基础,可作为细胞产品的质量控制指标;
- 功能分子:NKG2D、DNAM-1、IFN-γ、颗粒酶B是DNTs活性的标志,可用于评估DNTs的体外功能。
推测:通过联合检测CD64(患者AML细胞)与DNTs的功能分子(NKG2D、IFN-γ),可优化DNTs的临床应用(如筛选适合的患者、评估细胞产品质量)。
(注:文中未明确的统计学数据,均标注“文献未明确提供”;推论部分加“推测:”以区分原文结论。)
